овр. ОВР. 1 1 Место, значение и задачи изучения окислительно восстановительных реакций в курсе химии средней школы
 Скачать 0.64 Mb. Скачать 0.64 Mb.
|
|
Анализируя таблицы 4, 6, 8, 10 (9 классы) и 5, 7, 9, 11 (11 классы) можно сказать, что качество знаний, т.е. число оценок -хорошо- и -отлично- в экспериментальных классах значительно выше как по 9-м, так и по 11-м классам. В контрольных классах % качества знаний не высок, по сравнению с экспериментальными классами, как видно из сравнительных диаграмм (рисунок 2, 3). На рисунках 2, 3 представлены диаграммы сравнения успеваемости учащихся по итогам контрольных работ с четко выраженных процентом качества знаний по темам: «Методы составления уравнений окислительно- восстановительных реакции» для 9-х классов и «Применение метода полуреакций в органической химии» для 11-х классов. 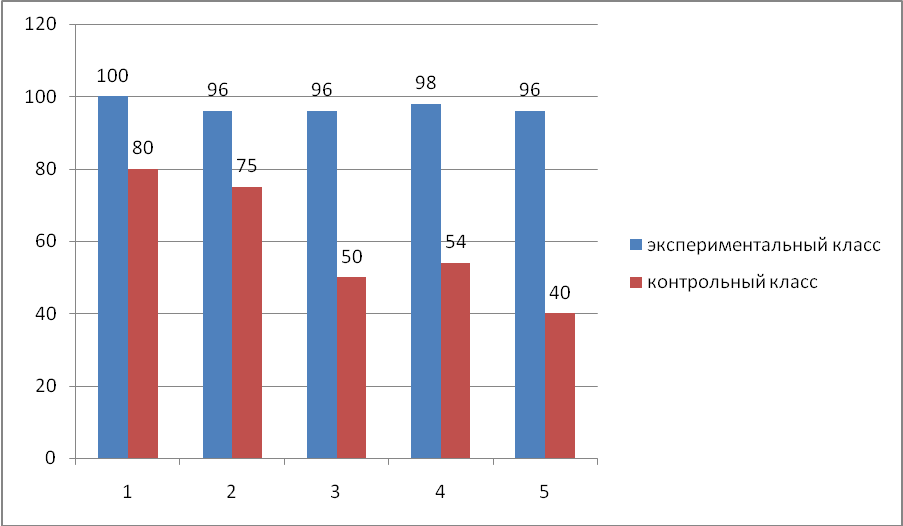 Рисунок 2. Диаграмма изменения качества знаний учащихся при изучении окислительно-восстановительных реакций в 9-х классах 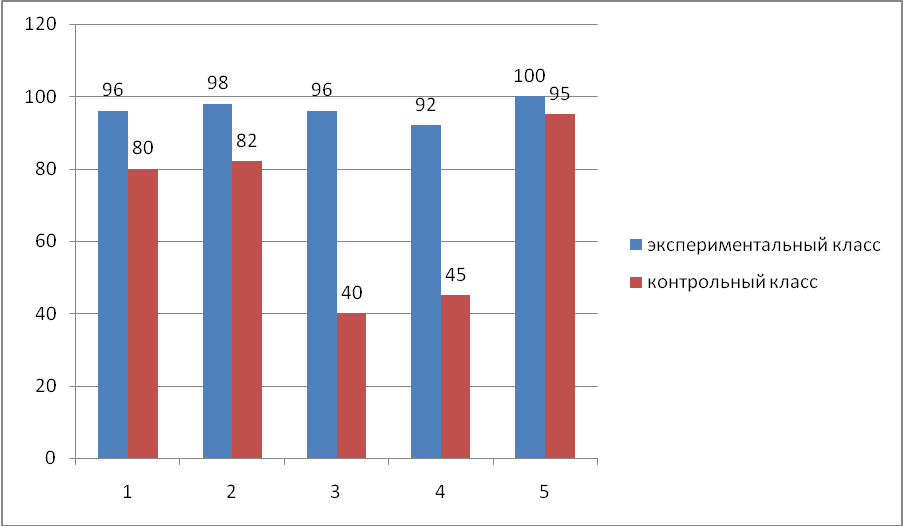 Рисунок 3. Диаграмма изменения качества знаний учащихся при изучении окислительно-восстановительных реакций в 11-х классах Следовательно, в последующем при изучении окислительно- восстановительных реакций, необходимо уделить больше внимания на следующие моменты как в 9 классах, так и в 11 классах: При составлении окислительно-восстановительных реакций уметь определять продукты реакций, т.е. уметь дописывать окислительно- восстановительные реакции, прогнозировать процессы -окисления- и -восстановления-. Знать свойства важнейших окислителей и восстановителей. Решать задачи, основанные на окислительно-восстановительных процессах с участием неорганических и органических веществ. В целом графики отражают качество знаний учащихся при изучении окислительно-восстановительных реакций в рамках предложенных уроков. С целью вычисления прочности усвоения знаний об окислительно-восстановительных реакций была проведена повторная контрольная работа в этих же классах по тем же материалам. Результаты приведены в таблицах 12, 14, 16 (по 9 классам) и 13, 15, 17 (по 11классам). Таблица 12.Количество различных ответов школьников в повторной контрольной работе по выяснению знаний по всем вопросам, заключенным в работе в % к общему числу учащихся в экспериментальных классах (9 класс)
Таблица .Количество различных ответов школьников в повторной контрольной работе по выяснению знаний по всем вопросам, заключенным в работе в % к общему числу учащихся в экспериментальных классах (11 класс).
Таблица .Количество различности ответов учащихся в повторной работе по выяснению знаний по всем вопросам, заключенным в работе в % к общему числу учащихся в контрольных классах (9 класс)
Таблица .Количество различности ответов учащихся в повторной работе по выяснению знаний по всем вопросам, заключенным в работе в % к общему числу учащихся в контрольных классах (11 класс).
Таблица . Процент качества знаний учащихся повторной контрольной работы в экспериментальных и контрольных классах (по 9-м классам)
Таблица .Процент качества знаний учащихся повторной контрольной работы в экспериментальных и контрольных классах (по 11-м классам)
Из таблиц 12, 14, 16 (по 9 классам) и 13, 15, 17 (по 11 классам) видно, что практически со всеми вопросами повторной контрольной работы учащиеся справились. Так в графе -отсутствие ответов- стоят прочерки, это значит, что на все вопросы контрольной были даны ответы. Из них по 9-м классам в экспериментальных классах всего 0 ответов неправильных, в контрольных 6 ответов неправильных и по 11-м классам в экспериментальных классах всего 0 ответов неправильных, в контрольных 9 ответов неправильных. Из таблиц 16, 17 можно узнать о проценте качества учащихся в контрольных и экспериментальных классах после проведения повторной контрольной работы. Сравнивая таблицы 16 и 17 можно сказать, что наблюдается характерное понижение процента качества знаний, но в целом понижение незначительное. Причем, в экспериментальных классах понижение качества знаний незначительное, чем в контрольных. Это позволяет сделать вывод, что прочность знаний выше в экспериментальных классах. Учащиеся успешно пользовались полученными знаниями по составлению окислительно-восстановителЬных реакций в дальнейшем изучении курсов органической и неорганической химии. Учителя, участвовавшие в эксперименте, отмечают, что учащиеся умело оперируют методом полуреакций, правильно составляют полуреакции, грамотно характеризуют окислитель, восстановитель. Для выявления эффективности предложенных нами методик по изучению окислительно-восстановительных реакций в 9 и 11 классах, мы провели анкетирование в экспериментальных классах, результаты которого приведены в таблицах 18, 19 (9 и 11 классы). Как видно из таблицы 18, 19, большинство учащихся отмечают, что метод полуреакций при составлении окислительно-восстановительных реакций является более эффективным, и они бы хотели продолжить изучать процессы, протекающие на основе окислительно-восстановительных реакций во внеурочное время (на факультативом или элективном курсах). Учащиеся отмечают целесообразность проведения подобных уроков. На основании результатов проведенного эксперимента можно сделать следующие выводы: Отобранный материал является достаточным и необходимым для ознакомления учащихся с методом полуреакций при составлении окислительно-восстановительных реакций как в курсе неорганической, так и в курсе органической химии и не вызывает затруднений если соблюдать следующие условия: а. разъяснить в доступной форме сущность метода полуреакций; б. сочетать различные формы организации работы учащихся на уроке (лабораторные опыты, самостоятельная работа, решение задач) и формы ведения уроков; Для успешного изучения окислительно-восстановительных реакций необходимо уделить в школьном курсе неорганической химии (9 класс) и органической химии (11 класс) не менее 1 урока из расчета, что продолжительность урока составляет 1 ч 20 минут, или 2 урока по 45 минут. Выделить дополнительное время для выполнения контрольной работы или ряда самостоятельных (проверочных) работ на последующих уроках с целью выяснения усвоения знаний об окислительно- восстановительных реакциях. Таблица .Результаты анкетирования по 9 классу
Таблица 19. Результаты анкетирования по 11 классу
ВЫВОДЫ Собран и обобщен материал по химии окислительно- восстановительных реакций и методике изучения их в школе; Отобрано содержание материала по химии окислительно- восстановительных процессов для изучения их в курсах -Неорганической химии- (9 класс) и -Органической химии- (11 класс) и дано его теоретическое обоснование. Предложены разработки уроков по изучению окислительно- восстановительных реакций в 9 классе - -Методы составления окислительно-восстановительных реакций- (2 часа) и в 11 классе — -Применение метода полуреакций в органической химии- (2 часа), которые были апробированы в период педагогической практики. На основе результатов педагогического эксперимента установлено, что отобранный материал является достаточным и необходимым для ознакомления учащихся с методом составления окислительно- восстановительных реакций с применением веществ неорганической и органической природы и не вызывает затруднений, если соблюдать следующие условия: а) разъяснять в доступной форме сущность метода полуреакции при составлении окислительно-восстановительных реакций в органической и неорганической химии; б) сочетать различные формы организации самостоятельной работы учащихся на уроке, активизирующие их познавательную деятельность. Установлено, что для успешного изучения окислительно- восстановительных реакций необходимо уделить в школьном курсе неорганической химии (9 класса) и органической химии (11 класс) по 2 часа и выделить время для выполнения контрольной или самостоятельной работ с целью выяснения усвоения знаний об окислительно-восстановительных реакциях и методах их составления. СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ Полинг Л. Общая химия (пер.с англ.). Под ред. М.Х. Карапетьянца. М.: Мир 1978г. Глинка Н.Л. Общая химия. Ленинград 1977г. Ахметов Н.С. Общая и неорганическая химия- М.: 1988г. Хомченко Г.П, Севастьянова К.И. Окислительно-восстановительные реакции 1988г. Марч Дж. Органическая химия. Реакции, механизмы и структура. В 4т. (пер. с англ.) М.: Мир. 1987-1988. Шалыгин С.П., Алехина Е.А., Романенко Н.В. Реакции окисления в органической химии. М. Химия 1989г. Зайцев О.С. Общая химия. Состояние веществ и химическая реакция. М.: Химия. 1990г. Полосин B.C., Прокопенко В.Г. Практикум по методике преподавания химии. М.: Просвещение 1989г. Чернобельская Г.М. Руководство к практическим занятиям по неорганической и органической химии. Изд. 4с., М.: Медицина, 1982г. 152ст. Зоммер К. Аккумулятор знаний по химии Под ред. В.М. Потапова. М.: Мир, 1977,294 ст. М. В.Зуева, Б. В.Шанова Совершенствование организации учебной деятельности школьников на уроках химии.- М.:- Просвещение, 1989г. Лебедева В.П., Орлова В.А. Практико-ориентировачный подход к развивающему образованию. Педагогика-1996.-№6. Программа по химии для 8-9 классов общеобразовательной школы с русским языком обучения.- Алматы.: 2004.- 20с. Программа по химии для 10-11 классов общеобразовательной школы.- Алматы.: 2006г. Н.Нурахметов, К. Сарманова, К. Джексембина др. Химия: Учебник для 8 классов общеобразовательных школ.- Алматы.: Мектеп, 2004г. Н.Нурахметов, К. Сарманова, К. Джексембина др. Химия: Учебник для 9 классов общеобразовательных школ.- Алматы.: Мектеп, 2005г. Н.Нурахметов, Н.А Заграничная, К. Б. Бекишев. Химия: Учебник для 10 классов естественно-математического направления общеобразовательных школ.- Алматы.: Мектеп, 2000г. Н.Нурахметов, А. Темирбулатова, С. Жумазилова, С. Алимжанова. Химия: Учебник для 11 классов естественно-математического направления общеобразовательных школ.- Алматы.: Мектеп, 2007г. Карцова А.А., Левкин А.Н. Окислительно-восстановительные реакции в органической химии Химия в школе 2004 - №2-с55-61. Щербакова Л.П. Абитуриентам об окислительно-восстановительных реакциях Химия в школе 2000- №2-с.66-67. Научно-методический журнал -Химия в школе- Центрхимипресс- 2006, №1. Научно-методический журнал -Химия в школе- Центрхимипресс - 2006, №6. ПРИЛОЖЕНИЕ А 9 класс Самостоятельная работа (Карточки-задания и карточки-ответы для проверки) 2группы -10 карточек. №1. Hg+H2S04 (к) →соль + S02 + вода №2. Ag+H2S04(K) → соль +S02 + вода №3. K+H2S04(K) → соль +S + вода №4. Mg+H2S04(K)- →соль +S + вода №5.Mg+H2S04(6o%p-p) → соль +H2S + вода №6. Al+HN03(p)- → соль +NO + вода №7. Ca+HNO3(60%p-p) → соль +N02+ вода №8.Са+НКЮз(зо%р-р) →соль +NO + вода №9.Ca+HNO3(20%p-p) → соль +N20 + вода №10.Ca+HN03(p.p)→ соль +N2+ вода Проверочная работа - обратная связь 1-й уровень: Ag + HN03(K) → соль + N02 + вода Ag + HN03(p) → соль + NO + вода -й уровень: Hg + HN03(P) → соль + NO + вода Mg + HN03(p.p) → соль + N2+ вода 3-й уровень: С + H2S04 (к) → С02 + S02 + вода Р + HN03 + Н20 →Н3РО4 + N0 ПРИЛОЖЕНИЕ Б По теме: -Применение метода полуреакций в органической химии- 11 класс Таблица -Окислители. Восстановители-. Карточка-задание и карточка-ответ. Баланс кислорода (связывания избытка и возмещение недостатка) в кислой, нейтральной и щелочной средах. Алгоритм составления окислительно-восстановительных реакций методом полуреакций. Карточки с дополнительными заданиями и карточка ответ. Карточки-информаторы с расчетными задачами. 1. Таблица -Окислители. Восстановители- Важнейшие восстановители и окислители
2. Карточка-задание и карточка ответ Карточка-задание №9 Ca+HN03(2o%p-p) → соль +N20 + вода Карточка-ответ №9 Ca+HN03(p-p) →Ca(N03)2 + N20 + H20 Ca° - 2e → Ca2+ 8 4 (окисление) 2(N03) + lOH- + 8e → N20 + 5H20 2 1 (восстановление) 4Ca° + 2(N03)-+ 10H+-+ 4Ca2+ + N20 + 5H20 8(N03)- 8(N03)- 4Ca+10HN03 →4Са(N03)2 + N20 + 5H20 3. Баланс кислорода (связывания избытка и возмещение недостатка) в кислой, нейтральной и щелочной средах Баланс кислорода
4. Алгоритм составления окислительно-восстановительных реакций ионно-электронным методом (методом полуреакции): Запишите в левой части уравнения исходных веществ. Для создания в растворах кислой среды пользуются серной кислотой. Хлороводородная и азотная кислоты применяются редко, так как первая способна окисляться, а вторая сама - сильный окислитель. Определите окислитель и восстановитель. Составьте схемы ионно-электронных уравнений полуреакций для процессов окисления и восстановления; в схему включаются те реальные частицы, которые проявляют окислительные и восстановительные свойства, а также частицы, характеризующие среду (кислую - Н+, щелочную - ОН-, нейтральную - Н20). сильные электролиты записывают в виде ионов, а слабые электролиты, газообразные вещества, труднорастворимые соединения - в виде молекул. Проверьте число атомов кислорода в каждом уравнении полуреакции слева и справа и уравняйте их. Проверьте число атомов каждого элемента в левой и правой частях схем уравнений полуреакций окисления и восстановления. При необходимости уравняйте их. Проверьте равенство сумм зарядов до и после реакции, в соответствии с законом электронейтральности - суммарное число зарядов продуктов реакции должно быть равно суммарному числу зарядов исходных веществ. Согласно закону сохранения энергии (материи), общее число электронов, отдаваемых восстановителем, должно быть равно общему числу электронов, присоединенных окислителем. Исходя из этого, подберите коэффициенты для окислителя и восстановителя. Суммируйте левые и правые части ионно-электронных уравнений, предварительно умножив соответствующие частицы на подобранные коэффициенты. Сократите подобные члены, если таковые имеются. Перепишите ионно-молекулярное (ионное) уравнение. Чтобы по ионному уравнению составить молекулярное, необходимо в левой и правой частях уравнения каждому аниону приписать соответствующее число катионов, а каждому катиону - число анионов. Скомпонуйте ионы в молекулы. 4. Карточки с дополнительными заданиями и карточка ответ Карточка-задание Задача 2.6 При окислении гексена-2 (цис- или трансизомера) в нейтральной среде образуется гексадиол-2,3 и диоксид марганца. Составить уравнение реакции ионно-электронным методом. Карточка-ответ СН3-СН-СН-СН2-СН2-СН3+КМПО4+ H20->CH3-CH0H-CH0H-C3H7+ Mn02 С6Н12 + Н20 - 2e-> С6Н12(ОН)2 + 2Н- (Мп04)- + 2Н20 + Зe^ Мп02 + 40Н- 3 (окисление) 2 (восстановление) ЗС6Н12 + 6Н20 + 2(Мп04)- + 4Н20 -> ЗС6Н12(ОН)2 + 6Н+ + 2Мп02+ 80ЬГ ЗС6Н12 + 4Н20 + 2(Мп04)- —> ЗС6Н12(ОН)2 + 2Mn02 + 20tr 2К+ 2К+ ЗС6Н,2 + 2КМп04 + 4Н20 -> ЗС6Н,2(ОН)2 + 2Mn02 + 2КОН Карточки-информаторы с расчетными задачами Карточка-информатор Задача 3. При взаимодействии H2S04(kohh.) с сахарной пудрой Ci2H220n получили 16,8л. смеси газов (С02 и S02) и воду. При пропускании образовавшейся смеси газов через раствор перманганата калия получили сульфат калия, оксид марганца (IV) и серную кислоту. Определить объемный состав полученной газовой смеси (растворимостью газов пренебречь). Рассчитать количество израсходованной соли - перманганата калия. Карточка-ответ Серная кислота обладает сильным водоотнимающим свойством: h2s04(kohц.) С12Н22Оп 12С +11Н20 (1) при этом H2S04 взаимодействует с образовавшимся углем: С + H2S04 →С02Т + S02 + Н20 При пропускании смеси газов через раствор КМп04 во взаимодействие вступит S02 как восстановитель: S02 + KMn04 + Н20 (S02 )2-+ Мп021 S02 + Н20 - 2e→ (S02 )2-+6Н+ 3 (окисление) (Мп04)- + 2Н20 + Зe→Мп02 + 4ОН- 2 (восстановление) 3S02 + 6Н20 + 2(Мп04)- + 4Н20 3(S02 )2-+ 12Н+ + 2Mn02 + 80Н- 3S02 + 2(Мп04)- + 2Н20 →3(S02 )2-+ 4Н* + 2Мп02 3S02 + 2КМп04 + 2Н20 → K2S04+ 2H2S04 +2Мп02 Из уравнения (2) соотношение объемов газов: С02 - S02 : 2 16,8 - 3 части часть С02 составляет 5,6л. С02 части S02 - 11,2л. S02 Из уравнения (3): 11,2л. Хг. 3S02 2КМп04 67,2л. 158г. 11,2(л)/67,2(л) = Х(г)/158(г); X = 11,2(л) * 158(г)/67,2(л) = 26,3г. Ответ:V(СР2) = 5,6л., V(S02) = 11,2л., m(KMn04) = 26,3г. ПРИЛОЖЕНИЕ В Контрольная работа По теме: -Методы составления окислительно-восстановительных реакций - - 9 класс Как называются процессы: а) Н2—>2H+, б) N2—-2N3- й сколько электронов участвуют в их протекании? Расставьте коэффициенты, используя метод полуреакций в следующих реакциях: а) Н3РО3 + КМп04 + H2S04 Н3Р04 + K2S04 + MnS04 + Н20 б) MnS + HN03 →MnS04+ N02+ H2O. 3.Допишите схемы реакций окисления-восстановления: а) H2S + H2S03 → б) КМп04 + H2S04 + FeS04 → Укажите степени окисления элементов в исходных и полученных продуктах и расставьте коэффициенты, используя метод полуреакций. 4.В щелочной среде соединения, содержащие ион Сг3+ переходят в соединения, содержащие Сг6+: СгС13 + Н202 + NaOH→ Na2Cr04+ NaCl + Н20 Какую роль играет пероксид водорода - окислителя или восстановителя? 5.Расставьте коэффициенты методом полуреакций. Железная пластинка массой 100г. погружена в раствор медного купороса. Покрывшуюся медью пластинку промыли, высушили и снова взвесили. Ее масса оказалась теперь равной 101,3г. Сколько граммов меди осадилось на пластинке? ПРИЛОЖЕНИЕ Г Контрольная работа По теме: -Применение метода полуреакций в органической химии- 11 класс Составьте уравнение окисления ацетилена раствором перманганата калия до щавелевой кислоты (среда нейтральная). Методом полуреакций и нахождения числа атомов кислорода, необходимых для превращения реагентов в продукты запишите уравнение следующей окислительно-восстановительной реакции: СНзОН + КМп04 + H2SO4 →НСООН+ MnS04+ K2S04 + Н20 3.Закончите уравнение следующих окислительно-восстановительных реакций методом полуреакций, укажите окислитель, восстановитель: а) СН3ОН + КМп04+ H2S04→НСООН + Мп2+ б) С2Н5ОН + KMn04+ H2S04 →СНзСООН + Мп2+ Сколько граммов дихромата калия и серной кислоты потребуется для окисления 940г. фенола до хинона С6Н402? Каково значение окислительно-восстановительных реакций, протекающих с участием органических веществ? | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
