Ответы на 1 и 2 вопросы экзамена за 1 курс. Все билеты.. 1 Электролиз
 Скачать 323 Kb. Скачать 323 Kb.
|
|
энергетическим уровнем. Число уровней, на которых находятся электроны в основном состоянии атома, совпадает с номером периода, в котором располагается элемент. Номера этих уровней обозначают цифрами: 1, 2, 3,... Спектральные линии, узкие участки в спектрах оптических, каждый из которых можно охарактеризовать определённой длиной волны l (или частотой 9-2. Процесс распада электролитов на ионы под влиянием растворителя называется электролитической диссоциацией. Вещества, растворы или расплавы которых проводят электрический ток, называются электролитами. К ним относится подавляющее большинство кислот, оснований и солей. При попадании этих веществ в полярный растворитель происходит электролитическая диссоциация, сопровождающаяся образованием сольватированных заряженных частиц положительно заряженных катионов и отрицательно заряженных анионов. Электролитическая диссоциация вызывается взаимодействием полярных молекул растворителя с частицами растворяемого вещества. Количественной характеристикой электролитической диссоциации служит степень диссоциации , равная отношению числа диссоциированных молекул Nдисс к общему числу молекул электролита в растворе Nобщ: = I ступень: H2C2O4 H+ + HC2O4, Ka(I) = 6,4610–2; II ступень: HC2O4 H+ + C2O42, Ka(II) = 6,1710–5; общее уравнение диссоциации: H2C2O4 2H+ + C2O42, Ka = Ka(I) Ka(II). Аналогично, для гидроксида свинца можно записать: I ступень: Pb(OH)2 PbOH+ + OH, Kb(I) = 9,5510–4; II ступень: PbOH+ Pb2+ + OH, Kb(II) = 3,010–8; 10-1. Cвязь между атомами возникает при перекрывании их атомных орбиталей с образованием молекулярных орбиталей (МО). Различают два механизма образования ковалентной связи. ОБМЕННЫЙ МЕХАНИЗМ - в образовании связи участвуют одноэлектронные атомные орбитали, т.е. каждый из атомов предоставляет в общее пользование по одному электрону: 10-2. Оствальда закон разбавления, соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора: 11-1. Ионная связь. Ионная связь — это электростатическое взаимодействие между ионами с зарядами противоположного знака.Коссель предположил, что ионная связь образуется в результате полного переноса одного или нескольких электронов от одного атома к другому. Такой тип связи возможен только между атомами, которые резко отличаются по свойствам. Например, элементы I и II групп периодической системы (типичные металлы) непосредственно соединяются с элементами VI и VII групп (типичными неметаллами). В качестве примеров веществ с ионной связью можно назвать MgS, NaCl, А2O3. Такие вещества при обычных условиях являются твердыми, имеют высокие температуры плавления и кипения, их расплавы и растворы проводят электрический ток. Валентность элементов в соединениях с ионными связями очень часто характеризуют степенью окисления, которая, в свою очередь, соответствует величине заряда иона элемента в данном соединении. Правило октета объясняет, как атомы образуют ионы. Рассмотрим в качестве примера натрий. В его атоме 11 электронов: два во внутреннем слое, восемь в следующем и один во внешнем слое. Этот внешний электрон очень подвижен, поэтому, если атому натрия передается энергия (например, в результате столкновения с другим атомом), он легко образует ион натрия с единичным положительным зарядом. Чтобы удалить электрон с внутреннего слоя, энергии потребуется в десять раз больше, поэтому ион натрия с двойным положительным зарядом — большая редкость. Точно так же кальций, имеющий 2 электрона во внешнем слое и 8 в следующем, более низком слое, образует ион, теряя 2 электрона. То есть, когда атомы превращаются в ионы, они по строению становятся похожи на атомы благородных газов.Правило октета помогает нам понять, как устроены химические связи. Но оно работает далеко не для всех элементов. Например, олово имеет во внешнем незаполненном слое 14 электронов, но может отдавать только 2 или 4 электрона: отрыв большего количества электронов потребовал бы непомерных затрат энергии. Поэтому олово образует ионы с положительным зарядом 2 или 4. Предельным случаем ковалентной полярной связи является ионная связь. Если электроотрицательности атомов различаются очень сильно (например, атомов щелочных металлов и галогенов), то при их сближении валентные электроны одного атома полностью переходят на второй атом. В результате этого перехода оба атома становятся ионами и принимают электронную структуру ближайшего благородного газа. Например, при взаимодействии атомов натрия и хлора, они превращаются в ионы Na+ и Сl-, между которыми возникает электростатическое притяжение. Чем больше поляризация ионов, тем меньше степень ионности связи, т. е. тем больше ковалентный характер связи между ними. 11-2. Явление изменения скорости реакции под действием катализаторов называется катализом. Катализатор – вещество, не расходующиеся в результате протекания реакции, но влияющие на её скорость. В случае гомогенного катализа катализатор и реагирующие вещества образуют одну фауз. В случае гетерогенного – катализатор находится в системе в виде самостоятельной фазы. Бывают катализаторы как ускоряющие скорость реакции, так и замедляющие её. В первом случае катализ – положительный, во втором – отрицательный. В большинстве случаев действие катализаотра обьясняется тем, что он снижает энергию активации реакции. В присутствии катализатора реакция проходит через другие промежуточные стадии, чем без него, причём эти стадии энергетически более доступны. Брожение. Переработка нефти состоит из нескольких каталитических процессов: крекинга, риформинга, гидросульфирования, гидрокрекинга, изомеризации, полимеризации и алкилирования. 12-1. Окисление – процесс отдачи электронов, сопровождающийся повышением степени окисления элемента. Восстановление – присоединение электронов, с понижением степени окисления элемента. Степенью окисления называется заряд элемента, вычисленный исходя из предположения, что соединение состоит только из ионов.Степень окисления является формализованным отображением общей валентности элемента в соединении, определяемой суммой ковалентности и электровалентности. Энергия ионизации — это энергия, необходимая для отрыва наиболее слабо связанного электрона от атома. Она обычно выражается в электрон-вольтах. При отрыве электрона от атома образуется соответствующий катион.Энергия ионизации для элементов одного периода возрастает слева направо с возрастанием заряда ядра. В подгруппе она уменьшается сверху вниз вследствие увеличения расстояния электрона от ядра. Энергия ионизации связана с химическими свойствами элементов. Так, щелочные металлы, имеющие небольшие энергии ионизации, обладают ярко выраженными металлическими свойствами. Химическая инертность благородных газов связана с их высокими значениями энергии ионизации.Сродство к электрону. Атомы могут не только отдавать, но и присоединять электроны. При этом образуется соответствующий анион. Энергия, которая выделяется при присоединении к атому одного электрона, называется сродством к электрону. Обычно сродство к электрону, как и энергия ионизации, выражается в электрон-вольтах. Значения сродства к электрону известны не для всех элементов; измерять их весьма трудно. Наиболее велики они у галогенов, имеющих на внешнем уровне по 7 электронов. Это говорит об усилении неметаллических свойств элементов по мере приближения к концу периода. 12-2. Опыт показывает, что при гетерогенном катализе большое значение имеютструктура, химический состав и величина поверхности катализатора. Так,гладкая платиновая пластинка, опущенная в раствор пероксида водорода,практически не вызывают разложения последнего. Если же поверхность этойпластинки шероховатая, разложение пероксида водорода протекает заметно. Ещёбольше увеличивается скорость разложения, если в качестве катализатораиспользовать платину в виде порошка. И, наконец, если к раствору пероксидаводорода прибавить еще более раздробленную платину в виде её коллоидногораствора, то разложение Н2О2 произойдёт практически мгновенно - в видевзрыва. Скорость химической реакции определяют как уменьшение количествареагирующего вещества или увеличение количества за единицу времени,например за секунду. Скорость гетерогенных взаимодействий зависит не только от самогохимического взаимодействия, но и от стадии переноса вещества, каковымявляются подвод молекул газообразного или растворённого реагента из объёма V к реакционной поверхности S и интенсивность отвода от поверхностипродуктов реакции. Скорость протекания всего гетерогенного взаимодействияопределяет та из трёх стадий скорость, которой минимальна. Её называютимитирующей стадией. Таким образом, в константу равновесия гетерогенной реакции входят только парциальные давления газообразных участников реакции. Однако, следует иметь в виду, что величина этой константы определяется свойствами всех веществ, участвующих в реакции. 13-1. Понятие атомного радиуса достаточно относительно, так как полностью определяется тем состоянием, в котором находится данный атом: свободном, молекулярном, жидком, кристаллическом, причем надо также учитывать, например, тип химической связи и кристаллической структуры. В среднем атомный радиус возрастает с ростом порядкового номера элемента (заряда ядра), особенно с переходом к новому периоду. Однако внутри каждого периода с ростом числа электронов величина радиуса падает, что обусловлено ростом заряда атомного ядра, увеличивающую силу притяжения электронов на данной орбите.При заполнении р-подуровня подобная тенденция слабее, хотя также имеет место. Незначительные искажения, обнаруживаемые для радиусов переходных элементов, обусловлены особенностями заполнения электронами d-орбитали. Энергия ионизации характеризует величину силы связи электрона с ядром, по которой можно судить о стабильности той или иной электронной конфигурации, а также, частично, о легкости или трудностях передачи электрона от одного атома к другому при образовании чисто ионной химической связи в окислительно-восстановительных процессах. очти все нейтральные атомы обладают способностью присоединять электрон: Эл(г) + е(г) - ? Эл (г) -,где Эл - химический элемент; е- - электрон; (г) - газ.Энергия, которая выделяется при присоединении электрона к свободному нейтральному газовому атому в его основном состоянии с образованием свободного отрицательно заряженного иона, называется сродством к электрону. Следует различать первую энергию сродства, вторую, третью и т.д., хотя добавление более одного электрона всегда требует затраты энергии. Сродство к электрону, как и потенциал ионизации, определяет способность данного элемента к взаимодействию с другими и с этой точки зрения является характеристикой межатомной связи. Естественно, что и сродство к электрону, и потенциал ионизации определяются электронной конфигурацией атома и, соответственно, положением элемента в периодической таблице. Средние численные значения сродства к электрону, полученные экспериментально для некоторых элементов, приведены на плакате 3. Максимальным сродством к электрону обладают элементы VI и VII групп. Нулевое сродство к электрону имеют благородные газы. Практически нулевым сродством обладают щелочноземельные металлы, отличающиеся заполненным внешним s -подуровнем. Элементы с наполовину заполненным р-подуровнем обладают пониженным сродством к электрону. 13-2. если на систему, находящуюся в равновесии, производится какое-либо внешнее воздействие (изменяется концентрация, температура, давление) то ,оно благоприятствует протеканию той из двух противоположных реакций, которая ослабляет воздействие. Если внешнее воздействие выражается в увеличении концентрации азота или водорода, то оно благоприятствует реакции, вызывающей уменьшение концентрации этих веществ, и, следовательно, равновесие сместится в сторону образования аммиака. Соответственно увеличение концентрации аммиака смещает равновесие в сторону исходных веществ. Поскольку прямая реакция, как видно из уравнения, протекает с выделением теплоты, повышение температуры смеси благоприятствует протеканию реакции с поглощением теплоты, и равновесие сместится в сторону исходных веществ; понижение температуры вызовет смещение равновесия в сторону продукта реакции.Чтобы определить влияние давления на смещение равновесия, необходимо подсчитать число молекул в левой и правой частях уравнения. В приведенном примере в левой части уравнения содержится две молекулы, а в правой - одна. Поскольку увеличение давления должно благоприятствовать процессу, ведущему к уменьшению числа молекул, то в данном случае равновесие сместится в сторону продукта реакции. Очевидно, уменьшение давления сместит равновесие в сторону исходных веществ. 14-1. В молекуле любого комплексного соединения один из ионов, обычно положительный, занимает центральное место и называется комплексообразователем. Вокруг него расположено некоторое число противоположно заряженных ионов или электронейтральных молекул,называемых лигандами и образующих внутреннюю сферу. Остальные расположены дальше от центрального иона и образуют внешнюю сферу. Теория валентных связей была первой из квантовомеханических теорий, использованной для приближенного объяснения характера химических связей в комплексных соединениях. В основе ее применения лежала идея о донорно-акцепторном механизме образования ковалентных связей между лигандом и комплексообразователем.Координационное число – кол-во лигандов. Лиганд считается донорной частицей, способной передать пару электронов акцептору – комплексообразователю, предоставляющему для образования связи свободные квантовые ячейки (атомные орбитали) своих энергетических уровней. Для образования ковалентных связей между комплексообразователем и лигандами необходимо, чтобы вакантные s-, p- или d-атомные орбитали комплексообразователя подверглись гибридизации определенного типа. Гибридные орбитали занимают в пространстве определенное положение, причем их число соответствует координационному числу комплексообразователя. При этом часто происходит объединение неспаренных электронов комплексообразователя в пары, что позволяет высвободить некоторое число квантовых ячеек – атомных орбиталей, которые затем участвуют в гибридизации и образовании химических связей. Неподеленные пары электронов лигандов взаимодействуют с гибридными орбиталями комплексообразователя, и происходит перекрывание соответствующих орбиталей комплексообразователя и лиганда с появлением в межъядерном пространстве повышенной электронной плотности. Электронные пары комплексообразователя, в свою очередь, взаимодействуют с вакантными атомными орбиталями лиганда, упрочняя связь по дативному механизму. Таким образом, химическая связь в комплексных соединениях является обычной ковалентной связью, достаточной прочной и энергетически выгодной. Электронные пары, находящиеся на гибридных орбиталях комплексообразователя, стремятся занять в пространстве такое положение, при котором их взаимное отталкивание будет минимально. Это приводит к тому, что структура комплексных ионов и молекул оказывается в определенной зависимости от типа гибридизации. Характерное координационное число приближённо равно заряду центрального иона. Бывает: 2,3,4,5. Ag2S + 2NH3 + 2NH4--- 2[Ag(NH3)2] + H2S . 14-2. ГОМОГЕННЫЕ РЕАКЦИИ, хим. р-ции, протекающие полностью в одной фазе. Примеры Г. р. в газовой фазе: термич. разложение оксида азота 2N2O5 -> 4NO2 + О2; хлорирование метана СН4 + С12 -> СН3С1 + НС1; горение этана 2С2Нб + 7О2 -> 4СО2 + 6Н2О; образование озона в земной атмосфере ЗО2 -> 2О3. В жидкой фазе гомогенно протекают разнообразные гомолитич. р-ции распада молекул на радикалы, нуклеоф. и электроф. замещения, отщепления, перегруппировки, а также цепные р-ции (галоидирование, окисление, полимеризация). Скорость простой Г. р. при постоянном объеме подчиняется действующих масс закону. Г. р. между реагентами, первоначально находящимися в разных фазах, возможны при условии, что диффузия реагентов в ту фазу, где идет р-ция, много быстрее самой р-ции. При относительно медленной диффузии реагентов и быстром хим. взаимод. р-ция протекает на границе раздела фаз (см. Гетерогенные реакции). Кинетич. особенности и механизм Г. р. определяются условиями взаимод. реагентов в данной фазе. Важный тип Г. р.-цепные реакции. скорость каталитической реакции пропорциональна концентрации катализатора. в состоянии равновесия при постоянной температуре соблюдается соотношение 15-1. В 1869 году Д.И.Менделеев формулирует открытый им периодический закон: ``Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов''. В настоящее время вместо понятия ``атомный вес'' используется понятие ``атомная масса''. Дальнейшее развитие естествознания, особенно учения о строении атома, показало, что индивидуальность химического элемента определяется зарядом его ядра, а химические свойства элементов и их соединений, периодическая повторяемость их у разных элементов, определяются строением электронной оболочки атома, которая в свою очередь зависит от заряда ядра атома. Современная формулировка периодического закона Менделеева такова: ``Свойства простых веществ, а также формы и свойства соединений химических элементов находятся в периодической зависимости от величины заряда ядер их атомов''. Периодическая система элементов Д. И. Менделеева, естественная классификация химических элементов, являющаяся табличным (или др. графическим) выражением периодического закона Менделеева. П. с. э. разработана Д. И. Менделеевым в 1869—1871. Очевидно, причину периодического изменения свойств элементов следует искать не в ядре, а в окружающей его электронной оболочке. Первая мысль, при этом возникающая, состоит в том, что электроны вокруг ядра расположены не беспорядочно, а слоями-оболочками. Начало заполнения новой оболочки совпадает с началом нового периода, и как раз в этот момент скачком изменяются химические свойства элементов. После работ Бора подобная мысль казалась очень естественной, и он сам же ее впервые и высказал. Однако приведенные наблюдения не подсказывают способа вычислить длину периода. На первый взгляд длина периодов в таблице меняется весьма прихотливо: в I периоде — два элемента, во II и III — восемь, в IV и V — восемнадцать, в VI — тридцать два. Но еще в 1906 году Иоганн Ридберг заметил, что ряд чисел 2, 8, 18, 32 подчиняется простой формуле: 2n2. Эту закономерность удалось объяснить Паули только в 1924 году, после открытия им принципа запрета. Ход рассуждений Паули легко понять. В самом деле, движение электрона в атоме описывается четырьмя квантовыми числами, о которых мы подробно говорили в предыдущей главе и которые напомним теперь еще раз: n — главное квантовое число, которое может принимать значения 1, 2, 3,...; l — орбитальное квантовое число, которое при заданном n принимает значения О, 1, 2,..., (n — 1); m — магнитное квантовое число; при заданных n и l оно пробегает ряд значений —l, —(l—1),... —1, О, 1, ... (l—1), l, — всего 2l+1 значений; S — спиновое квантовое число, принимающее значения +1/2 и -1/2. Принцип запрета Паули гласит: В атоме не может быть двух электронов с одинаковыми квантовыми числами. 15-2. Гидролизом называется процесс взаимодействия вещества с водой, при котором составные части вещества взаимодействуют с составными частями воды, образуя слабодиссоциирующие ионы или молекулы. При гидролизе происходит изменение реакции среды. Гидролизу подвергаются соединения различных классов. Мы рассмотрим лишь случай гидролиза солей. Любую соль можно рассматривать как продукт, образованный взаимодействием соответствующих основания и кислоты. Гидролизу будут подвергаться соли, образованные: а) слабым основанием и сильной кислотой, б) слабой кислотой и сильным основанием, в) слабой кислотой и слабым основанием. Наличие иона от слабого основания является причиной гидролиза. 1. Гидролиз соли, образованной сильным основанием и слабой кислотой (I ступень):Na2CO3 + HOH ⇄ NaHCO3 + NaOH;2Na+ + C 2. Гидролиз соли, образованной слабым основанием и сильной кислотой (I ступень):ZnCL2 + HOH ⇄ ZnOHCl + HCl;Zn2+ + 2Cl- + HOH ⇄ ZnOH+ + 2Cl- + H+;Zn2+ + HOH ⇄ ZnOH+. константы гидролиза 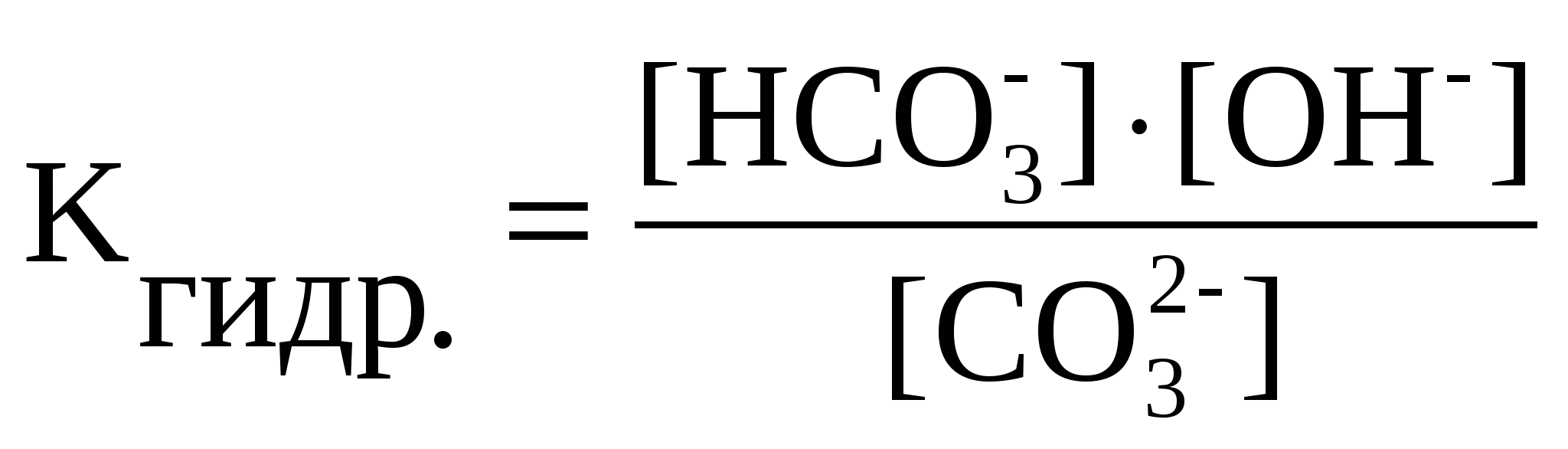 Степень гидролиза, т. е отношение числа молекул, подвергшихся гидролизу, к общему числу молекул, как правило, невелика. Причиной этого является то, что вода – очень слабый электролит, поэтому равновесие реакции гидролиза смещено в сторону исходных веществ. В разбавленных растворах соли гидролизуются сильнее. При повышении температуры степень гидролиза увеличивается. Степень гидролиза, т. е отношение числа молекул, подвергшихся гидролизу, к общему числу молекул, как правило, невелика. Причиной этого является то, что вода – очень слабый электролит, поэтому равновесие реакции гидролиза смещено в сторону исходных веществ. В разбавленных растворах соли гидролизуются сильнее. При повышении температуры степень гидролиза увеличивается.16-1. атомов, имеющих больше одного электрона, не может быть двух и более электронов с одинаковыми значениями всех четырех квантовых чисел. Это – принцип Паули. Принцип наименьшей энергии. При заполнении электронами уровней и подуровней последовательность размещения электронов должна отвечать как наименьшей энергии электрона, так и наименьшей энергии атома в целом. Электрон не занимает вышележащий уровень, если в нижележащем есть ячейки, располагаясь в которых, он будет обладать меньшей энергией. Этот принцип выражает общее термодинамическое требование к устойчивости системы: максимуму устойчивости системы соответствует минимум ее энергии. Но помните также и о том, что в состоянии максимальной устойчивости электронной системы в атоме связь электронов с ядром наиболее прочна. Чем ближе к ядру находится электрон, тем прочнее его связь с ядром. Правило Гунда (Хунда). Заполнение электронами ячеек p-, d- и f-подуровней вначале происходит неспаренными электронами, и лишь после такого заполнения подуровня начинается вхождение в ячейки вторых электронов (с противоположными спиновыми квантовыми числами), т. е. происходит их спаривание. 16-2. Растворение веществ сопровождается тепловым эффектом: выделением или поглощением теплоты - в зависимости от природы вещества. При растворении в воде, например, гидроксида калия, серной кислоты наблюдается сильное разогревание раствора, т.е. выделение теплоты, а при растворении нитрата аммония - сильное охлаждение раствора, т.е. поглощение теплоты. В первом случае осуществляется экзотермический процесс (∆H < 0), во втором - эндотермический (∆H > 0). Теплота растворения ∆H - это количество теплоты, выделяющееся или поглощающееся при растворении 1 моль вещества. Так, для гидроксида калия ∆H ° = -55,65 кДж/моль, а для нитрата аммония ∆H ° = +26,48 кДж/моль. СОЛЬВАТАЦИЯ, взаимод. молекул растворенного в-ва (или их ассоциатов) с молекулами р-рителя. Приводит к изменению св-в молекул в р-ре (в сравнении со св-вами газовой фазы), влияет на все физ. и физ.-хим. процессы, протекающие в р-рах, в т.ч. определяет скорость реакций в растворах и положение равновесия, а в ряде случаев и их механизм. С. в водных средах часто наз. гидратацией. Энтальпия растворения – изменение энтальпии при растворении одного моля вещества. Растворимость большинства (но не всех!) твердых веществ с увеличением температуры увеличивается, а растворимость газов, наоборот, уменьшается. Это связано прежде всего с тем, что молекулы газов при тепловом движении способны покидать раствор гораздо легче, чем молекулы твердых веществ. 17-1. Прочность комплексного иона характеризуется его константой диссоциации, называемой константой нестойкости. Для записи константы нестойкости К уравнение диссоциации составляется обычным способом (без участия молекул воды): Двойные соли – соли, образованные металлами и одной кислотой. 17-2. К первичным источникам можно отнести гальванические элементы, в которых возникает разность потенциалов непосредственно после изготовления элемента. К ним относятся широко используемые химические источники - гальванические элементы. В народе их называют - батареи. Принцип работы всех гальванических элементов одинаковый, отличаются они применяемыми материалами. Конструктивно они состоят из двух электродов, между которыми находится электролит (раствор, который проводит электрический ток). Наиболее распространенными элементами является угольно-цинковый элемент. У этих элементов один электрод угольный, имеющий положительный потенциал, и второй электрод из цинка, имеющий отрицательный потенциал. Как правило, цинковый электрод является корпусом элемента. В качестве электролита используется раствор соли, кислоты или щелочи. Вторичные химические источники тока, так же как и первичные преобразуют химическую энергию в электрическую. Они так же как гальванические элементы имеют электролит и два электрода (полюса): с положительным и отрицательным потенциалом. Отличаются только тем , что они после изготовления не имеют электрического заряда. В них сначала надо аккумулировать электрический заряд (накопить), после чего они накопленный заряд отдают во внешний участок электрической цепи. Такие устройства получили название - Аккумуляторы. Работает аккумулятор по принципу превращения электрической энергии в химическую (при заряде) и обратном превращении - химической энергии в электрическую (при разряде). Активные вещества заряженного свинцового аккумулятора, принимающие участие в токообразующем процессе: - на положительном электроде - двуокись свинца темно - коричневого цвета;- на отрицательном электроде - губчатый свинец серого цвета; - электролит - водный раствор серной кислоты плотностью 1,28 г/см3, который, как и активная масса электродов, принимает участие в токообразующем процессе. В процессе разряда активная масса как положительного, так и отрицательного электродов превращается в сульфат свинца (белого цвета). Поэтому теория, описывающая химические процессы, протекающие при заряде и разряде свинцового аккумулятора, называется теорией двойной сульфатации. 18-1. КРАТНЫЕ СВЯЗИ, хим. связи двухцентрового типа, к-рые в отличие от простой связи образованы более чем одной парой электронов. По числу пар электронов, образующих К. с., различают двойные, тройные и четверные связи. Сигмаи пи-связи (sи p-связи), ковалентные химические связи, характеризующиеся определенней, но различной пространственной симметрией распределения электронной плотности. Как известно, ковалентная связь образуется в результате обобществления электронов взаимодействующих атомов. Результирующее электронное облако s-связи симметрично относительно линии связи, т. е. линии, соединяющей ядра взаимодействующих атомов. Простые связи в химических соединениях обычно являются (т-связями (см. Простая связь). Электронное облако p-связи симметрично относительно плоскости, проходящей через линию связи (рис. 1, б), причём в этой плоскости (называемой узловой) электронная плотность равна нулю. 19-1. В настоящее время в ядре атома открыто большое число элементарных частиц. Важнейшими из них являются протоны (символ p) и нейтроны (символ n). Обе эти частицы рассматриваются как два различных состояния ядерной частицы нуклона. Элементарные частицы характеризуются определенной массой и зарядом. Протон обладает массой 1,0073 а. е. м. и зарядом +1. Масса нейтрона равна 1,0087 а. е. м., а его заряд — нулю (частица электрически нейтральна). Можно сказать, что массы протона и нейтрона почти одинаковы. Электрон - ee = –1,602×10–19 ; me = 9,109×10–31 . Заряд ядра атома определяется числом протонов которые входят в состaв. Следовательно, число протонов в ядре атома также pавно порядковому номеру элемента в периодической системе Д, И, Менделеева. Массовое число А равно числу нуклонов в ядре, оно представляет собой выраженную в атомных единицах массы (а.) массу атома элемента, округленную до целого числа. Относительная атомная масса элемента это число, которое показывает, во сколько раз абсолютная масса атома данного элемента больше 1/12 части абсолютной массы атома углерода, т.е. атомной единицы массы. ИЗОТОПЫ (от изо... и греч. topos - место), нуклиды одного хим. элемента, т.е. разновидности атомов определенного элемента, имеющие одинаковый атомный номер, но разные массовые числа. Обладают ядрами с одинаковым числом протонов и разл. числом нейтронов, имеют одинаковое строение электронных оболочек и занимают одно и то же место в периодич. системе хим. элементов. 19-2. Закон разбавления (разведения) Оствальда устанавливает взаимосвязь между , Kдис и молярной концентрацией растворенного вещества в растворе СМ Kдис. = CM 2.По величине степени диссоциации электролиты условно делят на слабые ( 3 %), сильные ( 30 %) и средней силы ( = 3-30 %). В растворах сильных электролитов (особенно при малых концентрациях См 0,1 моль/л) можно принять, что все молекулы растворенного вещества полностью распадаются на ионы, а недиссоциированные молекулы отсутствуют. 20-1. Влияние температуры на количество столкновений молекул может быть показано с помощью модели. В первом приближении влияние температуры на скорость реакций определяется правилом Вант-Гоффа (сформулировано Я. Х. Вант-Гоффом на основании экспериментального изучения множества реакций): В интервале температур от 0оС до 100оС при повышении температуры на каждые 10 градусов скорость химической реакции возрастает в 2-4 раза: 20-2.Электролиз – это окислительно-восстановительная реакция, протекающая при прохождении постоянного электрического тока через раствор или расплав электролита. При электролизе раствора соли на катоде восстанавливаются металлы стоящие после водорода в ряду напряжений, то есть это: Cu, Ag, Au, Hg, Pt. Все, что стоят до водорода - из раствора не восстанавливаются (Исключение Fe3+, в отличае от Fe2+ оно стоит после водорода). Короче, металлы разряжаются в такой последовательности, в какой они находятся в ряду напряжений, только в обратную сторону.
При электролизе масса превращенного вещества прямо пропорциональна количеству электричества, прошедшего через электролитическую ячейку. При прохождении через электролит одного и того же количества электричества масса превращенного вещества зависит от массы и заряда ионов вещества.Два закона электролиза — это всего лишь небольшая часть вклада Майкла Фарадея в науку. Электролиз — это совокупность процессов, происходящих при пропускании электрического тока через электролит — плавленое ионное вещество (например, плавленая соль) или раствор, в котором присутствуют ионы. Электрический ток проходит через электролит от одного электрода к другому. Положительно заряженные ионы при этом движутся к отрицательному электроду, аноду, а отрицательно заряженные — к положительному электроду, катоду. Химические реакции происходят на электродах. Фарадей провел фундаментальные исследования электролитов и создал законы, в которых говорится, что химические превращения связаны с потоком электронов (то есть электрическим током): чем больше электронов, тем больше химических превращений. 21-1. Компоненты - индивидуальные вещества, которые, будучи взяты в наименьшем числе, достаточны для построения всей системы, причем предполагается, что система находится в равновесном состоянии. Фаза совокупность однородных систем, находящихся между собой в термодинамическом равновесии. Равновесная гетерогенная система состоит из нескольких (минимум двух) фаз. Рассмотрим пример гомогенной химической реакции:2NO(г) + O2 (г) ® 2NO2 (г) V = k[NO]2[O2], моль / л . сВ гетерогенной системе "газ – твердое вещество" взаимодействие веществ возможно лишь на поверхности раздела фаз. В этом случае концентрация твердого вещества остается постоянной в единице поверхности и входит в кон-станту скорости реакции, а скорость реакции зависит лишь от концентрации газообразного вещества. Например |
