Ответы на 1 и 2 вопросы экзамена за 1 курс. Все билеты.. 1 Электролиз
 Скачать 323 Kb. Скачать 323 Kb.
|
|
орбиталью. Следовательно, орбиталь - это волновая функция, характеризующая состояние электрона. Поэтому для каждой заданной волновой функции существует граничная поверхность, внутри которой сосредоточена определенная доля электронного заряда. Максимальная электронная плотность отвечает наибольшей вероятности нахождения электрона. Следовательно, понятие "орбиталь" подразумевает форму электронного облака, которая меняется в зависимости от плотности отрицательного заряда. Орбитали могут отличаться одна от другой энергией, необходимой для удаления отрицательного заряда, формой электронного облака и ориентацией электронного облака относительно центра симметрии - ядра атома. Итак, каждая орбиталь и электрон, находящийся на этой орбитали, характеризуются тремя квантовыми числами: главным, побочным и магнитным. Главное квантовое число n характеризует энергию и размеры орбитали и электронного облака, принимает значения целых чисел – от 1 до бесконечности (n = 1, 2, 3, 4, 5, 6…). Орбитали, имеющие одинаковые значения n, близки между собой по энергии и по размерам, они образуют один энергетический уровень. Побочное (орбитальное) квантовое число l характеризует формы орбиталей и облаков, принимает значения целых чисел от 0 до n – 1. Магнитное квантовое число ml характеризует ориентацию орбиталей (электронных облаков) в пространстве и принимает значения целых чисел от –l через 0 до +l. Число значений ml определяет число орбиталей на подуровне, например: s-подуровень: l = 0, ml = 0 – одна орбиталь; p-подуровень: l = 1, ml = –1, 0, +1 – три орбитали; d-подуровень: l = 2, ml = –2, –1, 0, +1, +2 – пять орбиталей. Энергетический подуровень — совокупность орбиталей с одинаковыми значениями главного и орбитального квантовых чисел. Энергетический подуровень обозначается латинскими буквами: s, p, d, f .S-орбитали – круглые, p-гантелеобразные. Магнитное квантовое число – это целое число, обозначающее номер уровня и характеризующее расположение орбитали в пространстве. Количество орбиталей в s-0, в p-1, в d-2, в f-3. 27-2. . В основе термохимических расчетов лежит закон Гесса. Тепловой эффект (∆Н) химической реакции (при постоянных Р и Т) не зависит от пути ее протекания, а зависит от природы и физического состояния исходных веществ и продуктов реакции.Следствия из закона Гесса1.Тепловые эффекты прямой и обратной реакций равны по величине и противоположны по знаку.2.Тепловой эффект химической реакции (∆Н) равен разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ, взятых с учетом коэффициентов в уравнении реакции. ЭНТАЛЬПИЯ ОБРАЗОВАНИЯ СЛОЖНОГО ВЕЩЕСТВА равна энтальпии реакции образования одного моль этого вещества из простых веществ. стандартное давление для газов, жидкостей, и твёрдых тел, равное 105 Па стандартная температура для газов, равная 273,15 К (0°С) стандартная молярность для растворов, равная 1 моль•кг-1 . 28-1. Вода относится к очень слабым электролитам (Kдис. = 1,8 10-16). Произведение [Н+] [ОН-] = 10-14 при t= 22 oC постоянно для чистой воды и водных растворов различных веществ. Возможность и скорость протекания реакций в водных растворах в большей степени зависит от концентрации [Н+], поэтому эта величина имеет большое значение. Для удобства используют не величину [Н+], а водородный показатель рН = -lg[Н+].КH2O = 1.10-4 Данная константа для воды называется ионным произведением воды, которое зависит только от температуры.При диссоциации воды на каждый ион Н+ образуется один ион ОН-, следовательно, в чистой воде концентрации этих ионов одинаковы: [Н+] = [ОН-]. Кислотность растворов обычно выражают через концентрацию ионов Н+. В кислых растворах [Н+] > 10-7 моль/л, в нейтральных [Н+] = 10-7 моль/л, в щелочных [Н+] < 10-7 моль/л. Чтобы не писать числа с показателем степени, кислотность раствора часто выражают через отрицательный логарифм концентрации ионов водорода, называя эту величину водородным ателем и обозначая ее рН:pН = -lg[Н+]. Величина рН впервые была введена датским химиком С. Серенсоном. Буква “р” - начальная от датского слова potenz (степень), “Н” - символ водорода.В кислых растворах рН < 7, в нейтральных рН = 7, в щелочных pH > 7. 28-2. Дипольный момент связи (m) - векторная величина, характеризующая полярность связи: |m| = l·q, где l - длина связи, q - эффективный заряд, который приобретают атомы при смещении электронной плотности. Вектор дипольного момента направлен от положительного заряда к отрицательному. При векторном сложении дипольных моментов всех связей получают дипольный момент молекулы. Молекулы с отличным от нуля дипольным моментом называются полярными. Величина дипольного момента сильно влияет на свойства полярных молекул и веществ, построенных из таких молекул. Полярные молекулы поляризуются вэлектрическом поле, устанавливаясь по силовым линиям поля, ориентируются вэлектических полях, создаваемых ионами в растворах, взаимодействуют между собой, замыкая свои электрические поля. Дипольный момент образуется за счет смещения центров положительного и отрицательного зарядов на некоторую величину l, называемую длиной диполя. Чем более полярны молекулы, чем значительнее смещены валентные электронные пары к одному из атомов, тем больше ?. И наоборот, если электрическая ассиметрия молекул незначительна, то величина ? невлика ..Для системы из двух частиц дипольный момент ? равен: ? = el. Где e- величина заряда;l- расстояние между центрами. Однако, определяя разу величину дипольного момента, мы не знаем ни величины заряда e, локализованного в полярной молекуле, ни расстояния между центрами. Полярные: NH3, PCl3, HCl. Неполярные: BCl3,CH4. Ядро свободного атома водорода окружено сферически симметричным электронным облаком, образованным 1 s-электроном. При сближении атомов до определенного расстояния происходит частичное перекрывание их электронных облаков (орбиталей). В результате между центрами обоих ядер возникает молекулярное двухэлектронное облако, обладающее максимальной электронной плотностью в пространстве между ядрами; увеличение же плотности отрицательного заряда благоприятствует сильному возрастанию сил притяжения между ядрами и молекулярным облаком.Итак, ковалентная связь образуется в результате перекрывания электронных облаков атомов, сопровождающегося выделением энергии. Если у сблизившихся до касания атомов водорода расстояние между ядрами составляет 0,106 нм, то после перекрывания электронных облаков (образования молекулы Н2) это расстояние составляет 0,074 нм . Обычно наибольшее перекрывание электронных облаков осуществляется вдоль линии, соединяющей ядра двух атомов. Химическая связь тем прочнее, чем больше перекрывание электронных орбиталей. В результате возникновения химической связи между двумя атомами водорода каждый из них достигает электронной конфигурации атома благородного газа гелия. НАСЫЩАЕМОСТЬ — характерное свойство ковалентной связи. Она проявляется в способности атомов образовывать ограниченное число ковалентных связей. Это связано с тем, что одна орбиталь атома может принимать участие в образовании только одной ковалентной химической связи. Данное свойство определяет состав молекулярных химических соединений. Так, при взаимодействии атомов водорода образуется молекула Н2, а не Н3. С точки зрения МВС третий атом водорода не может присоединиться, так как спин его электрона окажется параллельным спину одного из спаренных электронов в молекуле. Способность к образованию того или иного числа ковалентных связей у атомов различных элементов ограничивается получением максимального числа неспаренных валентных электронов.НАПРАВЛЕННОСТЬ — свойство ковалентной связи, определяющее геометрическую структуру молекулы. Причина направленности связи заключается в том, что перекрывание электронных орбиталей возможно только при их определенной взаимной ориентации, обеспечивающей наибольшую электронную плотность в области их перекрывания. В этом случае образуется наиболее прочная химическая связь. 29-1. Влияние температуры на скорость химической реакции. Зависимость скорости реакции от температуры приближенно может быть выражена правилом Вант-Гоффа, согласно которому при увеличении температуры на каждые 10 градусов скорость химической реакции возрастает в 2-4 раза. Если известна скорость химической реакции v1 при температуре T1, то скорость этой реакции при температуре T2 может быть вычислена по формуле 29-2.Гидролиз – это ионно-обменная реакция между водой и растворенным в ней веществом. Гидролизу подвергаются соли, образованные сильным основанием и слабой кислотой; слабым основанием и сильной кислотой; слабой кислотой и слабым основанием. Соли, образованные многоосновными кислотами или многоатомными основаниями гидролизуются ступенчато, образуя на первой ступени кислые или основные соли. Вторая ступень идет в гораздо меньшей степени, чем первая. Гидролиз соли, образованной сильным основанием и слабой кислотой (I ступень): Na2CO3 + HOH ⇄ NaHCO3 + NaOH; 2Na+ + C C В результате гидролиза образуется избыток гидроксид-ионов, поэтому раствор карбоната натрия имеет щелочную реакцию со значением рН > 7. 2. Гидролиз соли, образованной слабым основанием и сильной кислотой (I ступень): ZnCL2 + HOH ⇄ ZnOHCl + HCl; Zn2+ + 2Cl- + HOH ⇄ ZnOH+ + 2Cl- + H+; Zn2+ + HOH ⇄ ZnOH+. В этом случае происходит гидролиз по катиону. В результате гидролиза образуется избыток ионов водорода, поэтому раствор соли имеет кислую реакцию со значением рН < 7. Гидролиз соли, образованной слабым основанием и слабой кислотой: CH3COONH4 + HOH ⇄ CH3COOH + NH4OH; CH3COO- + NH4+ + HOH ⇄ CH3COOH + NH4OH. Вэтом случае гидролиз происходт как по аниону,так и по катиону. Реакция раствора практически нейтральна и значение рН близко к 7. Количественной характеристикой протекания реакции гидролиза является константа равновесия (Кp). Для реакции гидролиза карбоната натрия по первой ступени можно написать выражение константы равновесия 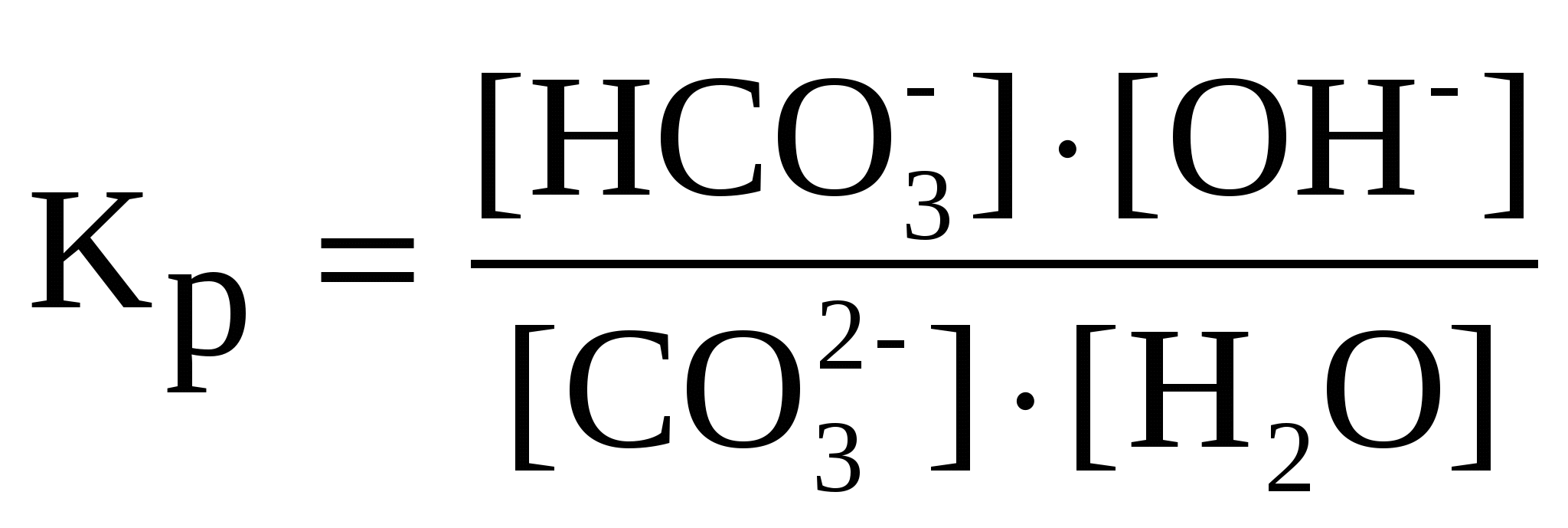 . Концентрация воды в разбавленных растворах представляет собой практически постоянную величину. Обозначая K·[H2O] = . Концентрация воды в разбавленных растворах представляет собой практически постоянную величину. Обозначая K·[H2O] = 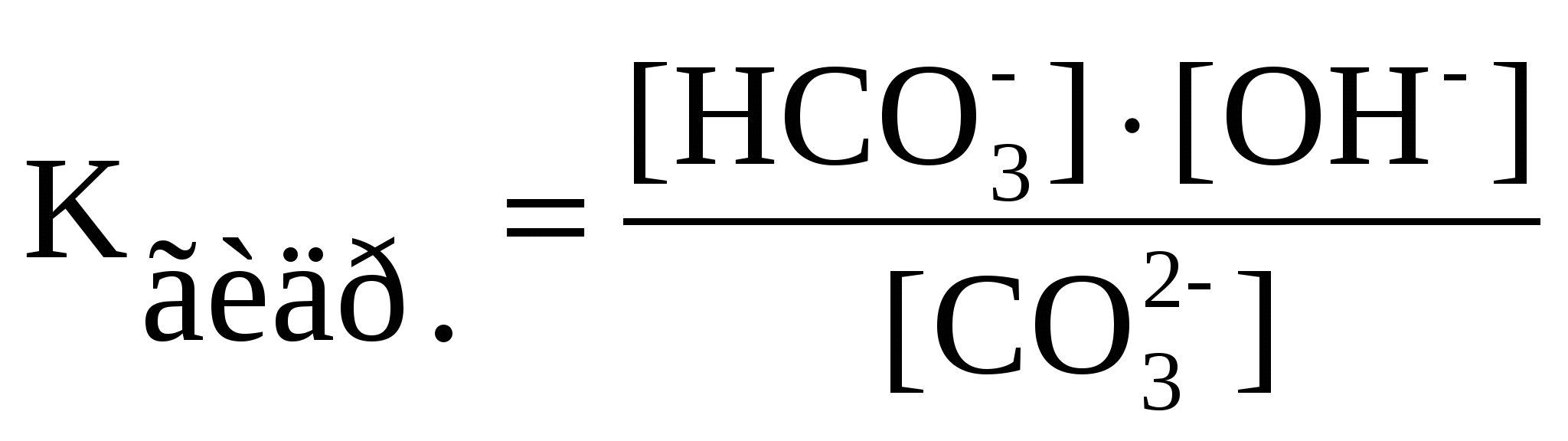 Степень гидролиза, т. е. отношение числа молекул, подвергшихся гидролизу, к общему числу молекул, как правило, невелика. Причиной этого является то, что вода – очень слабый электролит, поэтому равновесие реакции гидролиза смещено в сторону исходных веществ. В разбавленных растворах соли гидролизуются сильнее. При повышении температуры степень гидролиза увеличивается. Для подавления гидролиза нужно использовать концентрированные растворы при низких температурах, а также добавлять к раствору один из продуктов гидролиза: кислоту или щелочь. Степень гидролиза, т. е. отношение числа молекул, подвергшихся гидролизу, к общему числу молекул, как правило, невелика. Причиной этого является то, что вода – очень слабый электролит, поэтому равновесие реакции гидролиза смещено в сторону исходных веществ. В разбавленных растворах соли гидролизуются сильнее. При повышении температуры степень гидролиза увеличивается. Для подавления гидролиза нужно использовать концентрированные растворы при низких температурах, а также добавлять к раствору один из продуктов гидролиза: кислоту или щелочь. Соли, образованные слабой многоосновной кислотой и слабым многоатомным основанием, гидролизуются необратимо, например, Al2S3, Cr2S3:Al2S3 + 6HOH = 2Al(OH)3↓ + 3H2S↑.Эти и подобные им соли не существуют в растворах. 30-1. Направление смещения равновесия системы при изменении концентрации, температуры или давления определяется принципом Ле Шателье. Если на систему, находящуюся в равновесии, воздействовать извне, изменяя условия, определяющие положение равновесия, то оно сместится в таком направлении, что оказанное воздействие уменьшится.Влияние различных факторов на положение химического равновесия рассмотрим на примере равновесной системыN2(г) + 3H2(г) 2NH3(г); Hх.р.<0, в которой прямая реакция протекает с выделением тепла.В каком направлении будет смещаться равновесие в этой системе при увеличении давления и понижении температуры? Согласно принципу Ле Шателье, повышение давления смещает равновесие в направлении понижения давления т.е. в сторону химической реакции, идущей с уменьшением числа молей газообразных веществ. Объем исходных газов (N2 + 3H2) в два раза больше объема продукта 2NH3. Поэтому при увеличении давления в системе произойдет смещение равновесия в сторону прямой реакции, т.е. слева направо. Повышение температуры вызывает смещение равновесия в сторону химической реакции, протекающей с поглощением тепла, а понижение температуры - в сторону химической реакции, идущей с выделением тепла, т.е. слева направо. Смещение равновесия происходит также при изменении концентрации реагирующих веществ. Повышение концентрации какого-либо реагента смещает равновесие в сторону химической реакции, ведущей к уменьшению концентрации этого реагента.Поэтому для получения максимального выхода аммиака в данной реакции надо увеличить концентрации азота или водорода или уменьшить концентрацию конечного продукта – аммиака. 30-2. В соответствии с теорией электролитической диссоциации в растворах некоторых веществ происходит обратимый распад молекул на ионы. Поэтому в растворах таких веществ одновременно присутствуют молекулы и ионы. Количественно способность молекул вещества к электролитической диссоциации описывается степенью электролитической диссоциации ( % = 100 %) и константой электролитической диссоциации Kдис., т.е. константой равновесия, записанной для обратимого процесса электролитической диссоциации. Способность к электролитической диссоциации зависит от природы растворенного вещества, природы растворителя, от температуры, концентрации раствора и наличия в растворе одноименных ионов. Закон разбавления (разведения) Оствальда устанавливает взаимосвязь между , Kдис и молярной концентрацией растворенного вещества в растворе СМ Kдис. = CM 2. По величине степени диссоциации электролиты условно делят на слабые ( 3 %), сильные ( 30 %) и средней силы ( = 3-30 %). Вещества, распадающиеся на ионы в растворах или расплавах и потому проводящие электрический ток, называются электролитами. Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами. Степень диссоциации - это отношение числа распавшихся на ионы молекул N' к общему числу растворенных молекул N: Степень диссоциации электролита определяется опытным путем и выражается в долях единицы или в процентах. Если α = 0, то диссоциация отсутствует, а если α = 1 или 100%, то электролит полностью распадается на ионы. Если же α = 20%, то это означает, что из 100 молекул данного электролита 20 распалось на ионы.Различные электролиты имеют различную степень диссоциации. Опыт показывает, что она зависит от концентрации электролита и от температуры. С уменьшением концентрации электролита, т.е. при разбавлении его водой, степень диссоциации всегда увеличивается. Как правило, увеличивает степень диссоциации и повышение температуры. По степени диссоциации электролиты делят на сильные и слабые. |
