химическая технология. 1. Химическая технология научная основа химического производства
 Скачать 6.08 Mb. Скачать 6.08 Mb.
|
|
26.Реактор идеального вытеснения. Уравнение материального баланса РИВ. Реакторами идеального вытеснения называются реакторы непрерывного действия, в которых осуществляется ламинарный гидродинамический режим. В них поток реагентов движется в одном направлении по длине реактора без обратного или поперечного перемещения. В РИВ-Н параметры, движущая сила процесса и скорость процесса изменяются по длине реактора (во времени). Причем отклонение средней движущей силы от постоянного значения является максимальным. Поскольку в реакторе идеального вытеснения изменяется состав реагентов по длине, процесс в нем описывается дифференциальным уравнением материального баланса: 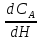 - разность между количеством вещества А, поступившего в бесконечно малый элемент реактора и выходящем из него в единицу времени; Н – высота (длина) реактора; - линейная скорость потока, UA – скорость расходования вещества А в ходе реакции. - разность между количеством вещества А, поступившего в бесконечно малый элемент реактора и выходящем из него в единицу времени; Н – высота (длина) реактора; - линейная скорость потока, UA – скорость расходования вещества А в ходе реакции.27.Реактор идеального смешения. Характеристическое уравнение РИС. Реакторами идеального (полного) смешения называются реакторы непрерывного действия, в которых осуществляется турбулентный гидродинамический режим. В них потоки реагентов смешиваются друг с другом и с продуктами химического превращения. В РИС-Н параметры, движущая сила процесса и скорость процесса постоянны по объему реактора (т.е. во времени), причем отклонение средней движущей силы от постоянного значения равно нулю. Характеристическое уравнение реактора полного смешения можно вывести на основе материального баланса. Поскольку в реакторе идеального смешения концентрации реагентов ожинаковы во всем объёме аппарата, материальный баланс составляют для всего объёма аппарата. При этом параметры процесса в объёме реактора в отводимом потоке одинаковы. Приход вещества равен: Gпр = Vc ·CA0 где Vc ·- объём исходной смеси, CA0 – начальная концентрация основного исходного реагента. 28.Каскад реакторов. Методы определения числа теоретических ступеней каскада. Более целесообразна установка последовательно соединённых реакторов полного смешения – каскада реакторов. В каскаде реакторов состав реакционной смеси изменяется при переходе из одного аппарата в другой. При этом в каждой ступени каскада, как это характерно для реакторов полного смешения, параметры процесса постоянны по всему объёму. Для определения числа теоретических ступеней каскада используют большей частью алгебраический и графический методы. Алгебраический метод расчета исходит из материального баланса для каждой ступени каскада. Для необратимой реакции первого порядка при отсутствии диффузионных торможений уравнение материального баланса первой ступени каскада будет: CA0· Vc = CA1· Vc + k ·CA1·v = CA1(Vc + kv) где Vc – объём исходной смеси, k - константа скорости реакции, v – единица объёма откуда: Уравнение материального баланса для второй ступени имеет вид: CA1· Vc = CA2· Vc + k ·CA2·v следовательно: Решая, таким образом, уравнения материального баланса для каждой ступени каскада при равенстве их реакционных объёмов и постоянной температуре, получаем: Это уравнение позволяет не только определить концентрацию реагентов на выходе из любого реактора каскада, но и найти, если известны концентрации или степени превращения во всем объёме каскада, число последовательно соединённых реакторов: 29.Устройство контактных аппаратов. Контактные аппараты с неподвижным слоем катализатора выполняются в виде реактора типа РИВ-Н. Контактная масса в них размещается в несколько слоев на полках (полочные аппараты) или в трубах (трубчатые аппараты). Многополочные контактные аппараты, содержащие несколько слоев катализатора, применяются в процессах с высоким положительным или отрицательным тепловым эффектом. Для процессов, протекающих с очень высокими скоростями, применяют конструкции, в которых контактные массы размещены в сетках, что обеспечивает лучший их контакт с реагентами. Недостатки данных аппаратов: низкая производительность катализатора вследствие затруднений использования внутренней поверхности его зерен, сложность конструкции, трудность поддержания оптимального теплового режима. Контактные аппараты с движущимся слоем катализатора работают в режиме реакторов РИС-Н и РПТ-Н (реактор промежуточного типа). В них катализатор распыляется в движущемся потоке газа или жидкости и переносится вместе с ним. При этом для обеспечения противотока газ поступает в аппарат снизу, а катализатор сверху. Контактные аппараты с псевдоожиженным слоем катализатора работают по принципу аппарата «кипящего слоя» в режиме реакторов РИС-Н и применяются, главным образом, в производствах органического синтеза, в которых катализатор быстро теряет активность и требует непрерывной регенерации. Поэтому, в этих установках, как и в установках с движущимся слоем катализатора, контактный аппарат сопряжен с регенератором катализатора. Преимущество данных аппаратов: легкость регенерации и замена катализатора, возможность подачи реагентов с температурой ниже температуры зажигания катализаторов, оптимальный температурный режим работы аппарата и т.п. Недостатки: быстрое истирания зерен катализатора и загрязнение продуктов реакции катализаторной пылью. 30.Характеристика гомогенных процессов. Для многих промышленных процессов воздух считается гомогенной средой, а для процесса окисления аммиака тот же воздух из-за наличия в нем пыли, влаги считается гетерогенной средой. Исходное сырье всегда имеет примеси. Поэтому лишь условно можно принять за гомогенные те производственные процессы, которые протекают в газовой или жидкой фазе. В гомогенных системах реакции проходят быстрее, чем в гетерогенных. Осуществление и управление гомогенными процессами, протекающими в гомогенной среде, значительно облегчается. Аппаратура тоже проще. Для гомогенизации системы при проведении химической реакции в однородной среде в промышленности используют разные способы: Поглощение газов, конденсация паров, растворение или плавление твердых материалов приводящей к получению жидкой среды, в которой быстрее протекают реакции. Испарение жидкостей или выделение из них в газовую фазу нужных компонентов и проведение реакции в газовой фазе. Рассмотрим характеристики некоторых реакций. Ассоциацией называется соединение некоторого числа одинаковых молекул в более крупные частицы. Ассоциация молекул происходит как в индивидуальных веществах в жидком и газообразном состоянии, так и в растворах. Уменьшение температуры и рост давления и концентрации увеличивают степень ассоциации и, наоборот, при повышении температуры и снижении давления и концентрации полученный компонент диссоциирует, т. е. процесс является обратимым. Полимеризацией называют процесс соединения большого числа молекул мономера в одну большую молекулу того же состава. Следовательно, при полимеризации не происходит выделения, каких- либо побочных продуктов. К полимеризации склонны ненасыщенные соединения, имеющие двойные и тройные связи, а также и насыщенные соединения циклического строения. Полимеризация непредельных углеводородов идет с выделением тепла и уменьшением общего числа молекул в системе, т.е. с уменьшением объема, например, nСН2=СН2 = (-СН2-СН2-)n Крекинг - метод деструктивной переработки, являющийся частным случаем пиролиза для жидкостей и газов. Пиролиз - это термическая переработка горючих материалов при температуре 400-15000 С без доступа воздуха. При пиролизе в результате воздействия высоких температур органические вещества расщепляются с образованием свободных радикалов, предельных и непредельных углеводородов меньшего молекулярного веса, чем исходные. 31.Гомогенные процессы в газовой и жидкой фазе. Гомогенные процессы в газовой фазе широко применяются в технологии органических веществ. Для осуществления этих процессов органическое вещество испаряется, и затем его пары обрабатываются тем или иным газообразным компонентом: хлором, окислами азота, сернистым ангидридом и т.п. Значительное применение получил парофазный пиролиз, в котором химические реакции разложения осуществляются в паровой фазе, хотя процесс в целом относится к гетерогенным, поскольку химическим реакциям в паровой фазе предшествует испарение углеводородов. Хлорирование углеводородов или их производных осуществляется при получении органических растворителей, ядохимикатов и разнообразных продуктов органического синтеза. В зависимости от применяемых средств инициирования различают следующие методы хлорирования: термическое, фотохимическое и каталитическое. Первые два метода - гомогенные. При хлорировании метана последовательным замещением его водородных атомов получается смесь четырех производных СН4 + CI2 = СН3Сl + НСl Хлористый метил СНзСl + Сl2 = СН2Сl2 + НСl Хлористый метилен СН2Сl2 + Сl2 = СНСlз + НСl Хлороформ СНСlз + Сl2 = ССl4 + НСl Четыреххлористый углерод Изменяя условия процесса, соотношение исходных продуктов, режим хлорирования, можно направить реакцию в сторону преимущественного образования того или иного хлорпроизводного. Сульфохлорирование, т.е. одновременное действие сернистого ангидрида и хлора на предельные углеводороды RН + SO2 + Сl2 = R-SO2Cl + НСl Гомогенные процессы в жидкой фазе Из большого числа процессов, идущих в жидкой фазе, можно отнести к гомогенным процессы нейтрализации щелочи в технологии минеральных солей без образования твердой соли. Например, получение сульфата аммония при взаимодействии аммиачной воды и серной кислоты. По такому принципу протекают и некоторые обменные реакции, идущие в растворах КСl +NaNO3 = NаСl + KNO3 В жидкой фазе получают простые и сложные эфиры из спиртов, так, например, этилсульфат взаимодействует с метанолом С2Н5OSO2OН + СНзОН = С2Н5OСН3 + H2SO4. В гомогенной среде идут и такие важные процессы, как получение адипиновой кислоты, синтез метилового спирта в присутствии серной кислоты. Жидкофазная полимеризация в растворах применяется в производстве лаков и некоторых смол. 32.Основные закономерности гомогенных процессов. С точки зрения кинетики, химические реакции можно классифицировать по молекулярности, т. е по числу молекул, принимающих одновременное участие в элементарном акте химического превращения, и по порядку реакции. Порядок реакции равен сумме показателей степеней при концентрациях реагирующих веществ в кинетическом уравнении реакции. Чаще всего порядок реакции не совпадает с ее молекулярностью. По молекулярности реакции подразделяются на моно -, би- и тримолекулярные. По порядку - первого, второго и дробного порядка. К одномолекулярным (мономолекулярным) реакциям относятся: реакции внутримолекулярных перегруппировок, например, изомеризация, инверсия; реакции разложения. Двумолекулярные (бимолекулярные), в которых элементарный акт осуществляется в результате встречи двух одноименных (А+А) или разноименных (А+В) молекул исходных веществ. Бимолекулярные реакции в свою очередь можно подразделить на: реакции присоединения А +А =АА, А +В = АВ и разложения 2А = D + D' реакции замещения или обмена А +ВВ' = АВ + В' реакции двойного обмена АА' + ВВ' = АВ + А'В' К бимолекулярным реакциям присоединения относятся присоединение атома или радикала к молекуле непредельного соединения и ассоциация насыщенных молекул. Трехмолекулярные, где встречаются и вступают в химическое взаимодействие три молекулы, могут быть реакции присоединения, обменного типа и реакции рекомбинации. Так протекает взаимодействие хлорного железа и хлористого олова в водном растворе 2FеСl3 +SnCl2 = 2FеСl2 + SnCl4 Зависимость скорости химической реакции от температуры сильно изменяется при возрастании порядка реакции. С ростом концентрации исходных веществ скорость реакции до достижения равновесного выхода увеличивается тем сильнее, чем выше порядок реакции. Для повышения концентраций реагентов в гомогенных системах применяются следующие методы: для газов: выделение из газовой смеси в более концентрированном виде, сжатие или сжижение, растворение газов для проведения реакции в растворе; для жидкостей: выпаривание, вымораживание, что позволяет получить раствор более насыщенный реагентами, или же дополнительный ввод реагента в раствор. Перемешивание ускоряет процессы, протекающие в диффузионной области вследствие замены медленной молекулярной диффузии быстрым конвективным переносом реагентов в зону реакции. 33.Гетерогенные процессы в системе газ-жидкость. Процессы, основанные на взаимодействии газообразных и жидких реагентов, широко используются в химической промышленности. К таким процессам относятся абсорбция и десорбция газов, испарение жидкостей, дистилляция и ректификация, пиролиз жидкостей с испарением продуктов пиролиза и т. п. Абсорбцией называется поглощение газа (или компонента газа) жидкостью с образованием раствора. Абсорбция происходит при непосредственном соприкосновении жидкости и газа, причем газовые молекулы проникают в жидкость. В ряде случаев абсорбция сопровождается химическими реакциями в жидкой фазе. Такие процессы называются хемосорбционными. Десорбция - процесс обратный абсорбции, заключается в выделении из жидкости растворенного в ней газа. В технике десорбция называется иногда отгонкой. При десорбции переход компонентов из раствора в газ происходит или вследствие нагревания жидкости, или в потоке инертного газа или водяного пара. Выделение компонента из жидкости в газ при нагревании происходит благодаря тому, что давление компонента над жидкостью становится выше, чем парциальное давление его в газе. Десорбция применяется в производстве соды, в органическом синтезе, при концентрировании газов. Испарение растворителя из растворов в химической технологии называется выпаркой. Этот же процесс называется концентрированием, например, концентрирование минеральных кислот и щелочей. Конденсация - процесс, обратный испарению, это переход пара или газа в жидкость при охлаждении или сжатии газа. Конденсацию газовых компонентов из газовой смеси при умеренном или глубоком охлаждении в технологии называют сжижением газов. Процессы конденсации паров и газов применяются при химической переработке твердого топлива, в производстве фосфора, спиртов, аммиака, при освобождении газов от паров воды и т. п. Перегонка жидких смесей - дистилляция и ректификация более сложные процессы и представляют собой различные сочетания испарения с конденсацией. Процессы пиролиза часто сочетаются с ректификацией продуктов. Как правило, пиролиз и крекинг жидкостей происходит с участием не только жидкой и газообразной, но также и твердой фазы, так как наряду с жидкими и газообразными продуктами образуется сажа или кокс. Полимеризация в газе с образованием относительно низкомолекулярных жидких полимеров применяется ограниченно. Так, например, получение жидких полупродуктов органического синтеза частичной (оборванной) полимеризацией газообразных олефинов. Полученные таким образом полупродукты применяются для производства синтетических смол и т. п. применяется ограничено При исследовании и описании абсорбционно-десорбционных процессов принято делить газы на: хорошо, средне и плохо растворимые. Эта классификация учитывает скорость растворения их в жидкостях и концентрацию насыщенных растворов. К хорошо растворимым газам относятся быстро взаимодействующие с жидкостью, образующие с ней соединения, быстро диффундирующие внутрь жидкости от поверхности раздела. 34.Гетерогенные процессы в системе жидкость-твердое. Процессы с участием жидких и твердых реагентов служат основой многих химических производств. К таким процессам относятся адсорбция растворенных в жидкости веществ и их десорбция, растворение твердых веществ и кристаллизация из растворов, экстрагирование и выщелачивание, плавление и кристаллизация из расплавов, полимеризация в среде жидких мономеров с образованием твердых полимеров и т. д. Растворение твердых веществ в жидкости можно ориентировочно разграничить на физическое и химическое. 1)Физическое растворение, при котором происходит лишь разрушение кристаллической решетки, обратимо, т.е. возможна обратная кристаллизация растворенного вещества. Этот тип растворения встречается в технологии минеральных удобрений и солей. 2)Химическое необратимое растворение сопровождается такого рода взаимодействиями растворенного вещества с растворителями или с химически активными веществами, присутствующими в растворе, при котором меняется природа растворенного вещества, и его кристаллизация в первоначальном виде невозможна. Экстрагированием или экстракцией называется разделение твердых или жидких смесей обработкой их растворителями, в которых компоненты смеси растворяются неодинаково. Экстрагирование из смеси твердых веществ производят различными растворителями: как органическими жидкостями (бензин, керосин, спирты, четыреххлористый углерод и т. д.), так и минеральными кислотами, щелочами и водой. Растворитель подбирается таким образом, чтобы в нем хорошо растворялся извлекаемый компонент, и слабо растворялись другие составные части смеси. Экстрагирование из смеси твердых веществ (выщелачивание) широко применяется в гидрометаллургии. Процессы растворения, экстрагирования, выщелачивания на практике чаще всего сопровождаются кристаллизацией из растворов, т.е. выделением из раствора в твердом состоянии растворенных твердых веществ, их гидратов или новых соединений, полученных в результате химической реакции в растворе. Политермическая кристаллизация осуществляется охлаждением насыщенных растворов и применяется для веществ, растворимость которых при повышенных температурах заметно выше, чем при низких. Изотермическая кристаллизация, производимая испарением воды из растворов при постоянной температуре, используется для солей, растворимость которых мало зависит от температуры. В ряде случаев кристаллизацию производят введением в раствор веществ, понижающих растворимость основной соли. Такой тип кристаллизации называется высаливанием. Разделение растворенных веществ проводят также осаждением из раствора основного компонента или примесей добавлением осаждающих реагентов. Осаждение реагентами также является кристаллизацией, поскольку оно связано с образованием пересыщенного раствора новой твердой фазы. Плавление и кристаллизация из расплавов - это процессы физико-химического характера, с которыми тесно связана металлургия, производство стекла, электролиз расплавов. Поликонденсация - это химический процесс получения высокомолекулярных соединений из различных низкомолекулярных исходных веществ (мономеров), который сопровождается отщеплением побочных низкомолекулярных продуктов: воды, двуокиси углерода, аммиака, хлористого водорода. Коагуляция (свертывание, сгущение) - это укрупнение частиц в коллоидных или дисперсных системах в результате слипания или слияния частиц под действием сил межмолекулярного взаимодействия. |
