1 колок Биохимия АГМУ. 1. Изобразите общую структурную формулу протеиногенной аминокислоты Объясните термин иминокислота
 Скачать 1.46 Mb. Скачать 1.46 Mb.
|
|
76. Приведите пример органоспецифического метаболического пути. Фермент аргиназа, участвующий в синтезе мочевины, находится только в клетках печени, а кислая фосфатаза, участвующая в гидролизе моноэфиров ортофосфорной кислоты, - в клетках простаты. 77. Объясните термин «компартментализация». Компартментализация – это сосредоточение ферментов и их субстратов в одном компартменте (одной органелле) – в эндоплазматическом ретикулуме, митохондриях, лизосомах, ядре, плазматической мембране и т.п. 78. Приведите пример компартментализации метаболического пути. Например, ферменты цикла трикарбоновых кислот и β-окисления жирных кислот расположены в митохондриях, ферменты синтеза белка – в рибосомах. 79. Опишите механизм регуляции количества молекул фермента в клетке. Количество молекул фермента в клетке определяется соотношением 2 процессов - синтеза и распада белковой молекулы фермента. 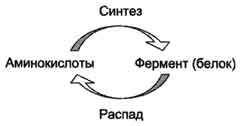 80. Приведите пример механизма регуляции количества молекул фермента в клетке. Регуляция количества молекул фермента в клетке может осуществляться путем изменения скорости его синтеза (индукция – увеличение скорости синтеза, репрессия – торможение) или путем изменения скорости его распада. 81. Опишите механизм регуляции скорости ферментативной реакции доступностью молекул субстратов и коферментов. Важный параметр, контролирующий протекание метаболического пути, - наличие субстратов, и главным образом - наличие первого субстрата. Чем больше концентрация исходного субстрата, тем выше скорость метаболического пути. 82. Приведите пример механизма регуляции скорости ферментативной реакции Другой параметр, лимитирующий протекание метаболического пути, - наличие регенерированных коферментов. Например, в реакциях дегидрирования коферментом дегидрогеназ служат окисленные формы NAD+, FAD, FMN, которые восстанавливаются в ходе реакции. Чтобы коферменты вновь участвовали в реакции, необходима их регенерация, т.е. превращение в окисленную форму. 83. Дайте определение термину «аллостерическая регуляция активности фермента». Аллостерическими ферментами называют ферменты, активность которых регулируется не только количеством молекул субстрата, но и другими веществами, называемыми эффекторами. Участвующие в аллостерической регуляции эффекторы - клеточные метаболиты часто именно того пути, регуляцию которого они осуществляют. 84. Назовите три-четыре наиболее характерных свойств аллостерических ферментов. Роль аллостерических ферментов в метаболизме клетки. Аллостерические ферменты играют важную роль в метаболизме, так как они чрезвычайно быстро реагируют на малейшие изменения внутреннего состояния клетки. Аллостерическая регуляция имеет большое значение в следующих ситуациях: при анаболических процессах. Ингибирование конечным продуктом метаболического пути и активация начальными метаболитами позволяют осуществлять регуляцию синтеза этих соединений; при катаболических процессах. В случае накопления АТФ в клетке происходит ингибирование метаболических путей, обеспечивающих синтез энергии. Субстраты при этом расходуются на реакции запасания резервных питательных веществ; для координации анаболических и катаболических путей. АТФ и АДФ - аллостерические эффекторы, действующие как антагонисты; для координации параллельно протекающих и взаимосвязанных метаболических путей (например, синтез пуриновых и пиримидиновых нуклеотидов, используемых для синтеза нуклеиновых кислот). Таким образом, конечные продукты одного метаболического пути могут быть аллостерическими эффекторами другого метаболического пути. 85. Опишите наиболее типичную локализацию аллостерического фермента в биохимическом процессе. Локализация аллостерических ферментов в метаболическом пути. Скорость метаболических процессов зависит от концентрации веществ, использующихся и образующихся в данной цепи реакций. Такая регуляция представляется 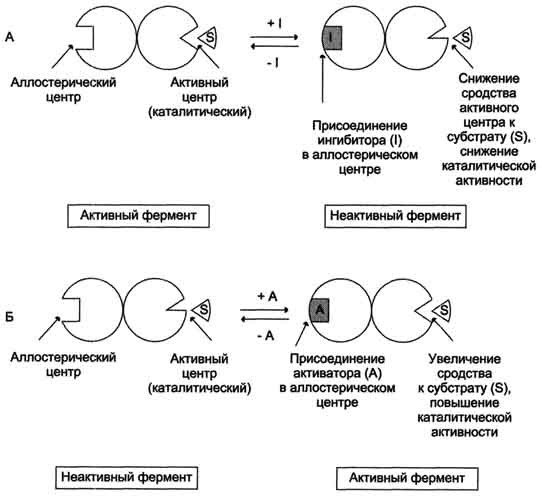 Рис. 2-30. Схема, поясняющая работу аллостерического фермента. А - действие отрицательного эффектора (ингибитора); Б - действие положительного эффектора (активатора). 113 логичной, так как при накоплении конечного продукта он (конечный продукт) может действовать как аллостерический ингибитор фермента, катализирующего чаще всего начальный этап данного метаболического пути:  Фермент, катализирующий превращение субстрата А в продукт В, имеет аллостерический центр для отрицательного эффектора, которым служит конечный продукт метаболического пути F. Если концентрация F увеличивается (т.е. вещество F синтезируется быстрее, чем расходуется), ингибируется активность одного из начальных ферментов. Такую регуляцию называют отрицательной обратной связью, или ретроингибировани-ем. Отрицательная обратная связь - часто встречающийся механизм регуляции метаболизма в клетке. В центральных метаболических путях исходные вещества могут быть активаторами ключевых ферментов метаболического пути. Как правило, при этом аллостерической активации подвергаются ферменты, катализирующие ключевые реакции заключительных этапов метаболического пути: 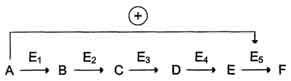 В качестве примера можно рассмотреть принципы регуляции гликолиза - специфического (начального) пути распада глюкозы (рис. 2-31). Один из конечных продуктов распада глюкозы - молекула АТФ. При избытке в клетке АТФ происходит ретро-ингибирование аллостерических ферментов фосфофруктокиназы и пируваткиназы. При образовании большого количества фруктозо-1,6-бисфосфата наблюдают аллостерическую активацию фермента пируваткиназы.  Рис. 2-31. Схема положительной и отрицательной регуляции катаболизма глюкозы. Молекула АТФ участвует в ретроингибировании аллостерических ферментов фосфофруктокиназы и пируваткиназы. Фруктозе-1,6-бисфосфат - активатор метаболического пути распада глюкозы. Плюсами отмечена активация, минусами - ингибирование ферментов. Благодаря такой регуляции осуществляется слаженность протекания метаболического пути распада глюкозы. Регуляция каталитической активности ферментов белок-белковыми взаимодействиями. Некоторые ферменты изме 86. Опишите регуляцию каталитической активности ферментов белок-белковыми взаимодействиями. Некоторые ферменты изменяют свою каталитическую активность в результате белок-белковых взаимодействий. Рассмотрим 2 механизма активации ферментов с помощью белок-белковых взаимодействий: активация ферментов в результате присоединения регуляторных белков; изменение каталитической активности ферментов вследствие ассоциации или диссоциации протомеров фермента. 87. Опишите регуляцию каталитической активности ферментов путем фосфорилирования / дефосфорилирования. В биологических системах часто встречается механизм регуляции активности ферментов с помощью ковалентной модификации аминокислотных остатков. Быстрый и широко распространённый способ химической модификации ферментов - фосфорилирование/дефосфорилирование. Модификации подвергаются ОН-группы фермента. Фос-форилирование осуществляется ферментами протеинкиназами, а дефосфорилирование - фосфопротеинфосфатазами. Присоединение остатка фосфорной кислоты приводит к изменению конформации активного центра и его каталитической активности. При этом результат может быть двояким: одни ферменты при фосфорилировании активируются, другие, напротив, становятся менее активными (р 88. Приведите пример регуляции каталитической активности ферментов путем фосфорилирования / дефосфорилирования . Например, под действием глюкагона (в период между приёмами пищи) в клетках происходит уменьшение синтеза энергетического материала - жира, гликогена и усиление его распада (мобилизация), вызванного фосфо-рилированием ключевых ферментов этих процессов. А под действием инсулина (во время пищеварения), наоборот, активируется синтез гликогена и ингибируется его распад, так как взаимодействие инсулина с рецептором активирует сигнальный путь, приводящий к дефосфорилированию тех же ключевых ферментов. 89. Опишите регуляцию каталитической активности ферментов частичным (ограниченным) протеолизом. Некоторые ферменты, функционирующие вне клеток (в ЖКТ или в плазме крови), синтезируются в виде неактивных предшественников и активируются только в результате гидролиза одной или нескольких определённых пептидных связей, что приводит к отщеплению части белковой молекулы предшественника. В результате в оставшейся части белковой молекулы происходит конформационная перестройка и формируется активный центр фермента 90. Приведите пример регуляции каталитической активности ферментов частичным (ограниченным) протеолизом. Рассмотрим механизм частичного протеолиза на примере активации протеолитического фермента трипсина (рис. 2-34). Трип-синоген, синтезируемый в поджелудочной железе, при пищеварении по протокам поджелудочной железы поступает в двенадцатиперстную кишку, где и активируется путём частичного протеолиза под действием фермента кишечника энтеропептидазы. В результате отщепления гексапептида с N-конца формируется активный центр в оставшейся части молекулы. Следует напомнить, 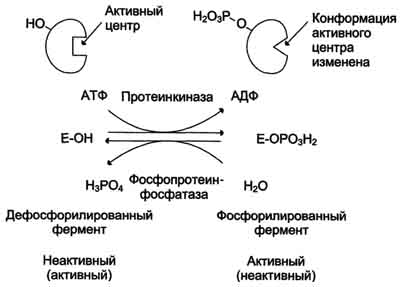 Рис. 2-33. Регуляция активности ферментов фосфорилированием/дефосфорилированием. 117 что трипсин относят к семейству "сериновых" протеаз - активный центр фермента содержит функционально важный остаток Сер 91. Назовите два известных вам способа регуляции активности ферментов при их ковалентной модификации. Фосфолирование, дефосфолирование. Не знаю тчно 92. Дайте определение термину «энзимопатия». В основе многих заболеваний лежат нарушения функционирования ферментов в клетке - энзимопатии. 93. Опишите сущность энзимопатии с нарушением образования конечных продуктов. Недостаток конечного продукта этого метаболического пути (Р) (при отсутствии альтернативных путей синтеза) может приводить к развитию клинических симптомов, характерных для данного заболевания: 94. Приведите пример энзимопатии с нарушением образования конечных продуктов. • Клинические проявления. В качестве примера можно рассмотреть альбинизм. При альбинизме нарушен синтез в меланоцитах пигментов - меланинов. Меланин находится в коже, волосах, радужке, пигментном эпителии сетчатки глаза и влияет на их окраску. При альбинизме наблюдают слабую пигментацию кожи, светлые волосы, красноватый цвет радужки глаза из-за просвечивающих капилляров. Проявление альбинизма связано с недостаточностью фермента тирозингидроксилазы (тирозиназы) - одного из ферментов, катализирующего метаболический путь образования меланинов 95. Опишите сущность энзимопатии с накоплением субстратов-предшественников. При недостаточности фермента Е3 будут накапливаться вещество С, а также во многих случаях и предшествующие соединения. Увеличение субстратов-предшественников дефектного фермента - ведущее звено развития многих заболеваний:  96. Приведите пример энзимопатии с накоплением субстратов-предшественников. Клинические проявления. Известно заболевание алкапгонурия, при котором нарушено окисление гомогентизиновой кислоты в тканях (гомогентизиновая кислота - промежуточный метаболит катаболизма тирозина). У таких больных наблюдают недостаточность фермента окисления гомогентизиновой кислоты - диоксигеназы гомогентизиновой кислоты, приводящей к развитию заболевания. В результате увеличиваются концентрация гомогентизиновой кислоты и выведение её с мочой. В присутствии кислорода гомогентизиновая кислота превращается в соединение чёрного цвета - алкаптон. Поэтому моча таких больных на воздухе окрашивается в чёрный цвет. Алкаптон также образуется и в биологических жидкостях, оседая в тканях, коже, сухожилиях, суставах. При значительных отложениях алкаптона в суставах нарушается их подвижность. 97. Опишите сущность энзимопатии с нарушением образования конечных продуктов и накоплением субстратов-предшественников. Нарушение образования конечных продуктов и накопление субстратов предшественников. Отмечают заболевания, когда одновременно недостаток продукта и накопление исходного субстрата вызывают клинические проявления.  98. Приведите пример энзимопатии с нарушением образования конечных продуктов и накоплением субстратов-предшественников Клинические проявления. Например, у людей с болезнью Гирке (гликогеноз I типа) наблюдают снижение концентрации глюкозы в крови (гипогликемия) в перерывах между приёмами пищи. Это связано с нарушением распада гликогена в печени и выходом из неё глюкозы вследствие дефекта фермента глюкозо-6-фосфатфосфатазы (см. раздел 7). Одновременно у таких людей увеличиваются размеры печени (гепатомегалия) вследствие накопления в ней не используемого гликогена. 1. Дайте определение термину «витамин». Витамины- органические низкомолекулярные вещества необходимые для метаболизма, большинство из них являются коферментами. 2. Назовите три-четыре причины гиповитаминозов. 1)Нерациональное питание. 2)нарушение всасывание витаминов. 3)гельминтозы 4)дисбактериоз кишечника 3. Назовите три-четыре водорастворимых витамина. Витамин В1(тиамин). Витамин В2(рибофлавин). Витамин В3(ниацин). Витамин С(аскорбиновая кислота) 4. Назовите три-четыре жирорастворимых витамина. Витамин А(ретинол). ВитаминD(кальциферол) Витамин К(нафтохиноны) 5. Как влияют гидрофильность и липофильность витаминов на накопление их в организме человека? Гидрофильность витаминов на накопление их в организме отрицательно не влияет, т.к. они являются водорастворимыми, могут растворятся в крови(жидкая среда), и далее через почки могут быстро выводится из организма с мочой. Накопление гидрофобных витаминов на организм может отрицательно влиять, т.к. они хорошо растворимы в жирахи легко накапливаются в организме, тем самым вызывая гипервитаминоз. 6. Что такое гиповитаминоз? Гиповитаминоз развивается при недостаточном поступлении витаминов. болезненное состояние, возникающее при нарушении соответствия между расходованием витаминов и поступлением их в организм; витаминная недостаточность. 7. Что такое гипервитаминоз ? Гипервитаминоз — это отравление организма при чрезмерном употреблении витаминов 8. Что такое авитаминоз? Авитамино́з — заболевание, возникающее при неполноценно питании, в котором отсутствуют какие-либо витамины. 9. Назовите два витамина-антиоксиданта. ВитаминС ВитаминE 10. Назовите три-четыре известных вам витамина, активные формы которых выполняют коферментную роль. ВитаминВ1.( входит в состав ТДФ, который является ферменто ПВТД комплекса и т.д.) ВитаминВ2.(является коферментом оксидоредуктаз) ВитаминВ3.(входит в состав НАД, НАДФ, которые являются коферментами многих дегидрогеназ) ВитаминВ6(является коферментом фосфорилазы гликогена) 11. Назовите два-три известных вам витамина, которых выполняют регуляторную функцию. ВитаминD. (уч-ет в регуляции обмена Са и фосфатов, стимулируя всасывание Са в кишечнике и т.д.) ВитаминА.( ретиноевая кислота, воздействует на ДНК----мРНК, с помощью которого регулирует синтез белков рецепторов к факторам роста, и тем самым влияет рост и дифференцировку клеток) 12. Назовите два витамина, активные формы которых функционируют в качестве переносчиков атомов водорода и электронов в окислительно-восстановительных реакциях. ВитаминВ2 ВитаминС 13. Назовите два витамина, дефицит которых вызывает анемию. ВитаминВ9.(фолиевая кислота) ВитаминВ12(кобаламин) |
