1 колок Биохимия АГМУ. 1. Изобразите общую структурную формулу протеиногенной аминокислоты Объясните термин иминокислота
 Скачать 1.46 Mb. Скачать 1.46 Mb.
|
|
1.Изобразите общую структурную формулу протеиногенной аминокислоты 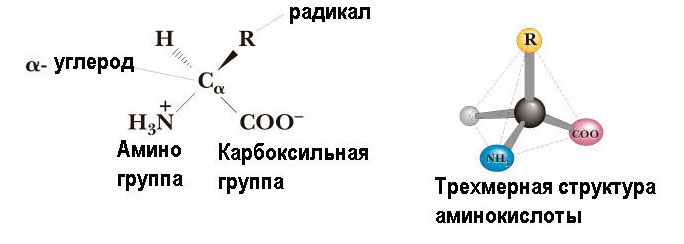 2.Объясните термин «иминокислота» и приведите пример иминокислоты Иминокислоты -карбоновые кислоты, содержащие иминогруппу (NH). В состав многих животных, растительных и микробных белков входят циклические И. — Пролин и Оксипролин. 3. «Объясните термин «рацемизация» Рацемизация — химический термин. Обозначает преобразование оптически активного вещества или смеси, где присутствует только один энантиомер, в смесь, содержащую более одного энантиомера. Если рацемизация приводит к созданию смеси, где энантиомеры присутствуют в одинаковом количестве, то смесь считается рацемической (Рацемат). 4.Изобразите структуру карбоксильной, амино, тиольной, амидной, гидроксильной и гуанидиновой групп  5.Приведите два-три примера трехбуквенного обозначения аминокислоты Glu, Asp, Leu 6. Назовите две-три аминокислоты с неполярными радикалами Аланин, валин, лейцин, изолейцин, пролин и метионин 7.Назовите две-три аминокислоты с полярными незаряженными радикалами К ним относят серии, треонин и тирозин, аспарагин и глутамин, цистеин 8.Назовите две аминокислоты с полярными отрицательно заряженными радикалами. К этой группе относятся аспарагиновая и глутаминовая кислоты 9.Назовите две аминокислоты с полярными положительно заряженными радикалами. Лизин и аргинин. 10.Как изменяется суммарный заряд аминокислот с недиссоциирующими радикалами в зависимости от pH среды? В нейтральной среде аминокислоты, содержащие недиссоциирующий радикал, имеют суммарный нулевой заряд. Аминокислоты, содержащие кислотные функциональные группы, имеют суммарный отрицательный заряд Аминокислоты, содержащие основные функциональные группы, - положительный заряд 11. Как изменяется суммарный заряд аминокислот с анионными группами в радикале в зависимости от pH среды? 12. Как изменяется суммарный заряд аминокислот с катионными группами в радикале в зависимости от pH среды?  13.Назовите две-три модифицированные аминокислоты, присутствующие в белках 5-гидроксилизин и 4-гидроксипролин. 14. Изобразите строение пептидной связи в составе трипептида. 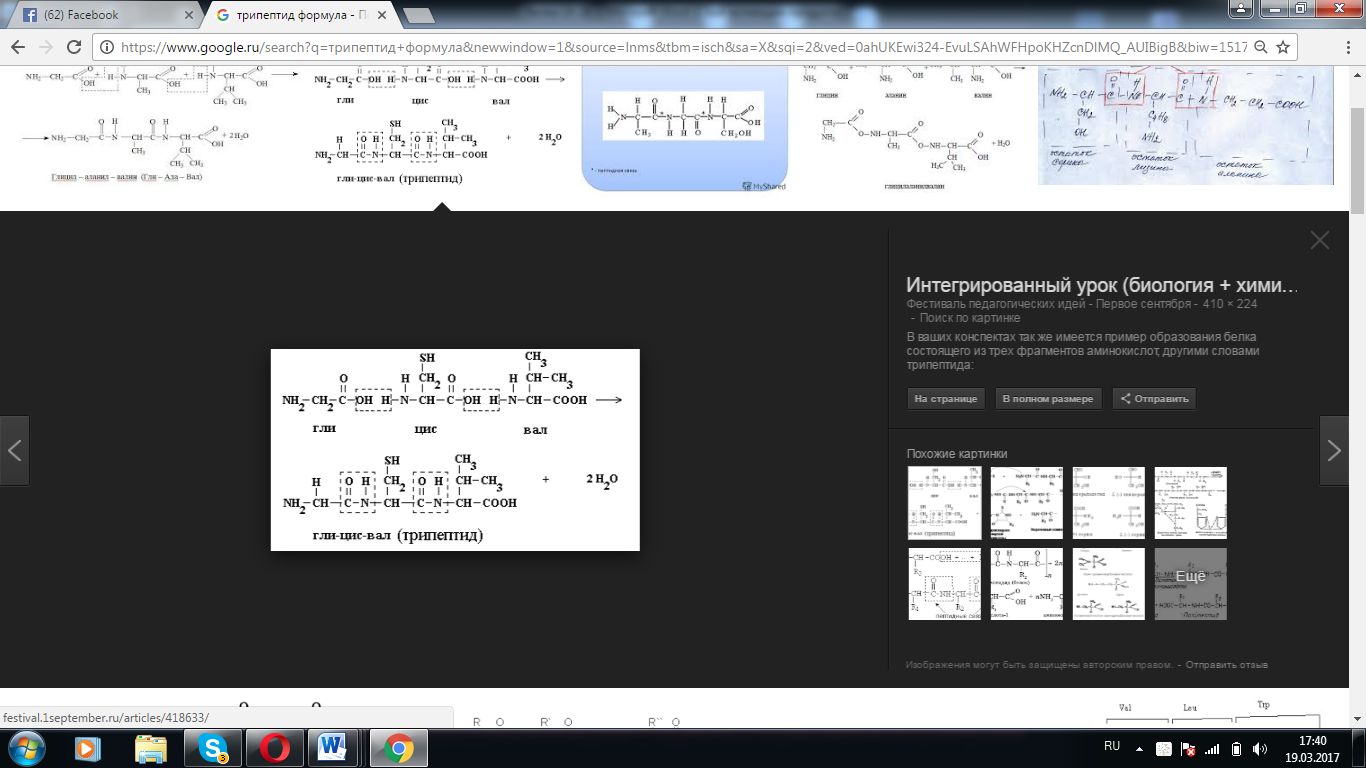 15. Приведите три-четыре примера биологически активных пептидов в организме человека. Глутатион. Ангиотензин2. Брадикинин. Луназин. 16. Изобразите структуру трипептида глутатиона. 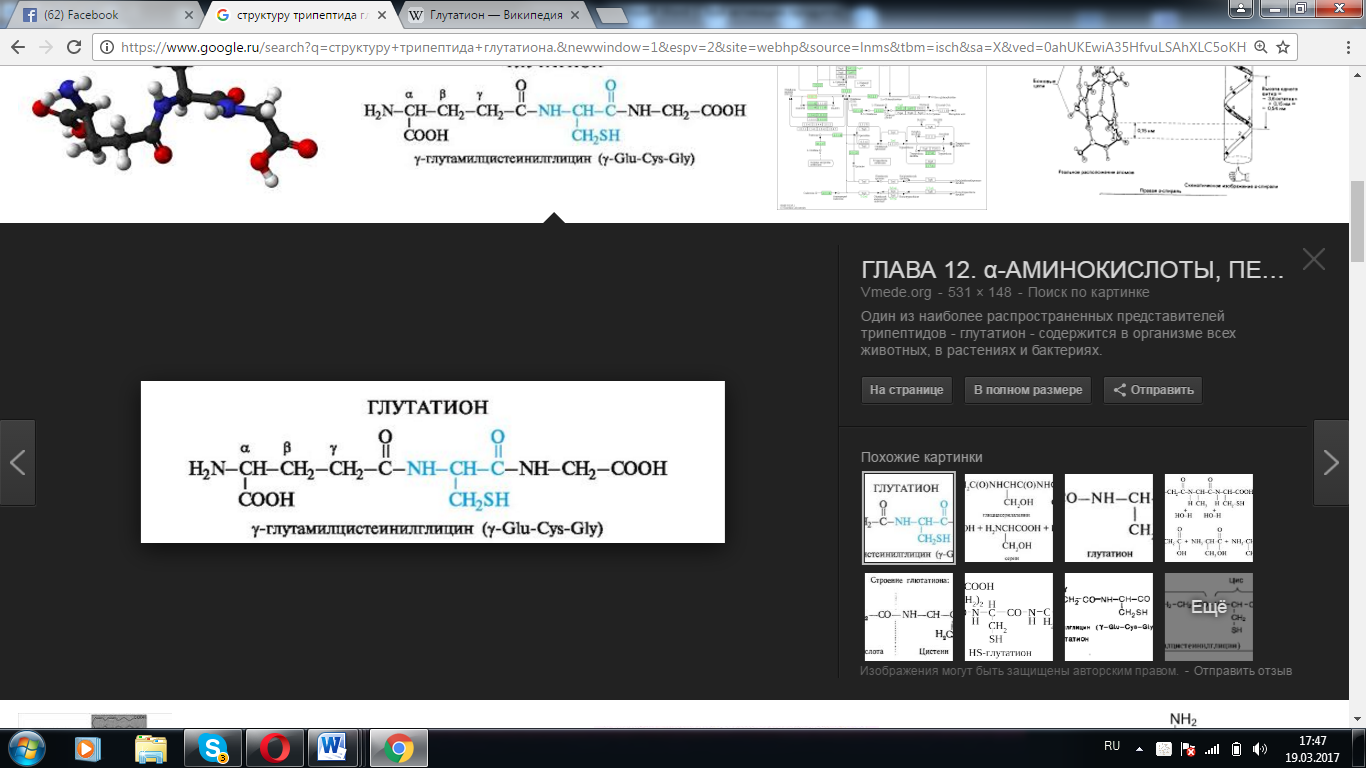 17. Назовите функцию ангиотензина II. Ангиотензин II обладает сосудосуживающей активностью и увеличивает синтез альдостерона. 18. Назовите функцию окситоцина. Основной биологический эффект окситоцина у млекопитающих связан со стимуляцией сокращения гладких мышц матки при родах и мышечных волокон вокруг альвеол молочных желез, что вызывает секрециюмолока 19. Назовите функцию вазопрессина. Вазопресси́н, или антидиурети́ческий гормо́н (АДГ) — пептидный гормон гипоталамуса Его основными функциями является сохранение воды в теле и сужение кровеносных сосудов. 20. Назовите функцию глутатиона. Глутатион участвует в синтезе лейкотриенов и является кофактором фермента глутатионпероксидазы. Он также выступает в качестве гидрофильной молекулы, которая присоединяется ферментами печени к гидрофобным токсичным веществам в процессе их биотрансформации с целью выведения из организма в составе желчи. Как часть глиоксалазной ферментативной системы глутатион участвует в реакции детоксификации метилглиоксаля, токсичного побочного продукта метаболизма. Глиоксалаза 21. Объясните термин «конформация белка». Функциональные свойства белков определяются их конформацией, т.е. расположением полипептидной цепи в пространстве. Уникальностьконформации для каждого белка определяется его первичной структурой. В белках различают два уровня конформации пептидной цепи - вторичную и третичную структуру. 22. Назовите известные вам четыре уровня структурной организации белков. Выделяют четыре уровня структурной организации белков: первичный, вторичный, третичный и четвертичный 23. Дайте определение термину «первичная структура белка». Линейную последовательность аминокислотных остатков в полипептидной цепи называют первичная структура белков. 24. Дайте определение термину «вторичная структура белка». Вторичная структура белков-пространственная структура, образующаяся в результате взаимодействий между функциональными группами, входящими в состав пептидного остова. 25. Дайте определение термину «третичная структура белка». Третичная структура белков-трехмерная пространственная структура, образующаяся за счет взаимодействий между радикалами аминокислот, которые могут располагаться на значительном расстоянии друг от друга в полипептидной цепи. 26. Дайте определение термину «четвертичная структура белка». Количество и взаиморасположение полипептидных цепей в пространстве называют четвертичная структура белков. 27. Опишите структуру α-спирали во вторичной структуре белка. Самая распространённая в белках вторичная структура. Данная спираль характеризуется плотными витками вокруг длинной оси молекулы, спираль стабилизирована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 звена. Спираль построена исключительно из одного типа стереоизомеров аминокислот (L). 28. Опишите структуру β-листка во вторичной структуре белка. Имеет слабо изогнутую конфигурацию полипептидной цепи и формируется с помощью межпептидных водородных связей в пределах отдельных участков одной полипептидной цепи или смежных полипептидных цепей. Ее называют также слоисто-складчатой структурой. 29. Приведите пример ионных связей в третичной структуре белка. Ионные связи могут возникать между противоположно заряженными радикалами например, радикалами глутамата и аргинина 30. Приведите пример водородных связей в третичной структуре белка. Водородные связи образуются между двумя полярными незаряженными радикалами или между незаряженным и заряженным радикалами, например, радикалами серина и глутамина 31. Приведите пример ковалентной связи в третичной структуре белка. Дисульфидные связи образуются между SH-группами двух радикалов цистеина, находящихся в разных участках полипептидной цепи. Инсулин и иммуноглобулин 32. Напишите реакцию образования дисульфидной связи в белке.  33. Дайте определение термину «нативная структура белка». Нативная структура – это функционально активная конформация белка. 34. Дайте определение термину «денатурация белка». Денатурация белка - это изменение нативных (природных) физико-химических и, главное, биологических свойств белка вследствие нарушения его четвертичной, третичной и даже вторичной структуры. 35. Назовите три-четыре фактора, вызывающих денатурацию белков. температура выше 60° С; ионизирующая радиация; концентрированные кислоты и щёлочи; соли тяжёлых металлов (ртути, свинца, кадмия); органические соединения (спирты, фенолы, кетоны) . 36. Назовите причину денатурации белков при действии на них высокой температуры. Высокая температура, увеличивающая тепловое движение атомов в молекуле и приводящая к разрыву слабых связей. 37. Назовите причину денатурации белков при интенсивном встряхивании Интенсивное встряхивание раствора, приводит к соприкосновению белковых молекул с воздушной средой на поверхности раздела фаз и изменению конформации этих молекул. 38. Назовите причину денатурации белков при действии на них высокой температуры. Высокая температура, увеличивающая тепловое движение атомов в молекуле и приводящая к разрыву слабых связей. 39. Назовите причину денатурации белков при действии на них органических растворителей. Органические вещества способны взаимодействовать с функциональными группами белков, что приводит к их конформационным изменениям. 40. Назовите причину денатурации белков при действии на них кислот и щелочей 1. Высокие температуры. Для разных белков характерна различная чувствительность к тепловому воздействию. Часть белков подвергается денатурации уже при 40-500С. Такие белки называют термолабильными. Другие белки денатурируют при гораздо более высоких температурах, они являются термостабильными. 2. Ультрафиолетовое облучение 3. Рентгеновское и радиоактивное облучение 4. Ультразвук 5. Механическое воздействие (например, вибрация). Хим ф-ры Концентрированные кислоты и щелочи. Например, трихлоруксусная кислота (органическая), азотная кислота (неорганическая). 41. Назовите причину денатурации белков при действии на них детергентов. Денатурированный под действием детергентов белок обычно остаѐтся в растворѐнном виде, так как гидрофильные части денатурирующего вещества удерживают его в растворе. К наиболее известным детергентам относят различные мыла. 42. Приведите два-три примера использования денатурирующих агентов в медицине В биохимических исследованиях перед определением в биологическом материале низкомолекулярных соединений обычно из раствора вначале удаляют белки. Для этой цели чаще всего используют трихлоруксусную кислоту (ТХУ). После добавления ТХУ в раствор денатурированные белки выпадают в осадок и легко удаляются фильтрованием В медицине денатурирующие агенты часто применяют для стерилизации медицинского инструмента и материала в автоклавах (денатурирующий агент - высокая температура) и в качестве антисептиков (спирт, фенол, хлорамин) для обработки загрязненных поверхностей, содержащих патогенную микрофлору 43. Дайте определение понятию «супервторичная структура белка» Она занимает промежуточное положение между вторичной и третичной структурами, поскольку это специфическое сочетание элементов вторичной структуры при формировании третичной структуры белка. Супервторичные структуры имеют специфические названия, такие как «α-спираль-поворот-а-спираль», «лейциновая застежка молния», «цинковые пальцы» и др. Такие супервторичные структуры характерны для ДНК-связывающих белков. 44. Приведите три-четыре примера супервторичной структуры белка 1. Супервторичная структура типа β-бочонка 2. Структурный мотив «α-спираль – поворот – α-спираль» 3. Супервторичная структура в виде «цинкового пальца» 4. Супервторичная структура в виде «лейциновой застежки-молнии» 45. Опишите строение супервторичной структуры типа β-бочонка Она действительно напоминает бочонок, где каждая β-структура расположена внутри и связана α-спиральным участком цепи, находящимся на поверхности. Характерна для некоторых ферментов – триозофосфатизомеразы, пируваткиназы. 46. Опишите строение супервторичной структуры типа «α-спираль — поворот — α-спираль» Обнаружен во многих ДНК-связывающих белках. . Супервторичная структура в виде «цинкового пальца». Характерна также для ДНК-связывающих белков. 47. Опишите строение супервторичной структуры типа «цинковый палец» «Цинковый палец» – фрагмент белка, содержащий около 20 аминокислот, в котором атом цинка связан с радикалами четырех аминокислот: обычно с двумя остатками цистеина и двумя – гистидина. 48. . Опишите строение супервторичной структуры типа «лейциновая застежка-молния» . Объединение протомеров или отдельных белков в комплексы иногда осуществляется с помощью структурных мотивов, называемых «лейциновая застежка-молния». Примером такого соединения белков могут служить гистоны. 49. Дайте определение термину «домен белка» лемент третичной структуры белка, представляющий собой достаточно стабильную и независимую подструктуру белка, фолдинг которой проходит независимо от остальных частей. В состав домена обычно входит несколько элементов вторичной структуры 50. Дайте определение термину «комплементарность» заимное соответствие в химическом строении двух макромолекул, обеспечивающее их взаимодействие - спаривание двух нитей ДНК, соединение фермента с субстратом, антигена с антителом. Комплементарные структуры подходят друг к другу как ключ к замку. 51. Дайте определение понятию «фолдинг белков» В биохимии и молекулярной биологии фо́лдингом белка называют процесс спонтанного сворачивания полипептидной цепи в уникальную нативную пространственную структуру (так называемая третичная структура). 52. Назовите основную функцию шаперонов. - обеспечение правильного фолдинга новообразованных белков. - контроль за рефолдингом. Имеется в виду, что под действием самых разных причин (перегрева, облучения, действия оксидантов и т. д.) белки, относительно давно синтезированные и до того успешно функционировавшие, могут терять свою нативную конформацию, частично или полностью денатурировать, что, сопровождается склонностью к агрегации. - Участие в некоторых видах виутриклеточного транспорта белков: в частности, в лизосомы (для белков, «отслуживших» свой срок и не поддающихся рефолдингу) и в митохондрии. 53. Дайте определение понятию «ренатурация белка» обратный переход молекулы биополимера, напр. белка или нуклеиновой к-ты, из денатурированного (неактивного) состояния в нативное (биологически активное). 54. Назовите основную функцию белков теплового шока. Препятсвуют денатурации 55. Назовите три-четыре причины накопления амилоидных белков в клетках. - в результате точечных реакции белка - при гиперпродукции белков и повышение их в концентрации клетки 56. Объясните феномен кооперативного эффекта протомеров белков. ************************************** 57. Приведите пример кооперативного эффекта в белке. Связывается с оксигемоглобином 58. Опишите строение миоглобина. Миоглобин содержит небелковую часть (гем) и белковую часть (апомиоглобин 59. Назовите основную функцию миоглобина Участвует в запасе мышц О2, и при инее достатке освобождает О2 60. Опишите строение гемоглобина. Гемоглобин – это сложный полимер белок, молекула которого состоит из белковой (глобин) и железосодержащей части 61. Назовите основную функцию гемоглобина. Основная функция перенос кислорода, выведение углекислого газа  62. Изобразите кривую насыщения миоглобина кислородом. 62. Изобразите кривую насыщения миоглобина кислородом.  6  3. Изобразите кривую насыщения гемоглобина кислородом. 3. Изобразите кривую насыщения гемоглобина кислородом.64. Опишите механизм взаимодействия гема с кислородом в составе гемоглобина. ??????????? 65. Назовите основную функцию 2,3-бисфосфоглицерата в эритроцитах. Регулирует транспорт кислорода эритроцитами, снижает родство гемма к кислороду 66. Объясните феномен эффекта Бора Объясняет степень зависимости диссоциации оксигемоглобина от парциального давления , при снижении которого средство кислорода к гемму повышается. что затрудняет переход кислорода из капилляров в ткани . 67. Перечислите классы белков по форме молекул. Глобулярные и фибриллярные 68. Опишите строение фибриллярных белков. Расположенные параллельно друг другу вытянутые полипептидные цепи, образующие длинные нити или слои 69. Опишите строение глобулярных белков. Белки, в молекулах которых полипептидные цепи плотно свёрнуты в глобулы (компактные шарообразные третичные структуры) 70. Перечислите классы белков по химическому строению. Простые и сложные 71. Опишите строение простых белков. Содержат в своём составе только полипептидные цепи, состоящие из аминокислотных остатков 72. Опишите строение сложных белков. Кроме полипептидных цепей, содержат в своём составе небелковую часть, присоединённую к белку слабыми или ковалентными связями. Небелковая часть может быть представлена ионами металлов, какими-либо органическими молекулами с низкой или высокой молекулярной массой. 73. Назовите четыре-пять функций белков. 1) Ферментативная 2) Регуляторная 3) Рецепторная 4) Транспортная 5) Структурная 74. Назовите функцию белков-ферментов. Ускоряют течение химических реакций 75. Приведите пример белка-фермента. Фермент трипсин 76. Опишите функцию регуляторных белков. Участвуют в поддержании постоянства внутренней среды организма, которые воздействуют на специфические клетки – мишени. 77. Приведите пример регуляторного белка. Инсулин 78. Опишите функцию рецепторных белков. Функция заключается в избирательном связывании гормонов, биологически активных веществ и медиаторов на поверхности мембран или внутри клеток. 79. Приведите пример рецепторного белка. Адренорецептор 80. Опишите функцию транспортных белков. Функция транспортных белков — участие белков в переносе веществ в клетки и из клеток, в их перемещениях внутри клеток, а также в их транспорте кровью и другими жидкостями по организму. 81. Приведите пример транспортного белка. - Гемоглобин – белок крови, участвует в переносе кислорода по организму - Калий-натриевая АТФ-аза – ионный канал мембраны клетки, выкачивает из клетки 3 натрия и закачивает 2 калия - Альбумин – переносит жирные кислоты и липиды - Трансферрин (является глобулином) – переносит ионы железа - Внутренний Фактора Касла (гастромукопротеид) – обеспечивает поглощение клетками витамина B12 82. Опишите функцию структурных белков. Структурные белки: - участвуют в образовании практически всех органоидов клеток, во многом определяя их структуру (форму); - образуют цитоскелет, придающий форму клеткам и многим органоидам и обеспечивающий механическую форму ряда тканей; - входят в состав межклеточного вещества, во многом определяющего структуру тканей и форму тела животных 83. Приведите пример структурного белка. Коллаген - cлужит компонентом соединительной ткани, костей, сухожилий, хрящей. Кератин - входит в состав волос, ногтей, рогов, перьев. Гистоны - участвуют в сборке и упаковке нитей ДНК в хромосомы. 84. Опишите функцию защитных белков. Защитные – группа белков, предохраняющих организм от вторжения других организмов и повреждений. 85. Приведите пример защитного белка. Иммуноглобулины, антигены, интерфероны - обеспечивают иммунные реакции организма. Фибриноген, фибрин, протромбин, тромбин - участвуют в процессах свертывания крови. 86. Опишите функцию сократительного белка. Сократительные (дигательные) – группа белков, ответственных за мышечное сокращение и другие формы биологической подвижности, т.е. белки, в результате деятельности которых, химическая энергия превращается в механическую работу. 87. Приведите пример сократительного белка. Миозин, актин - обеспечивают сокращение волокон мышц. 88. Приведите три-четыре примера суперсемейств белков. Суперсемейство белков — это наиболее крупная единица группировки белков, для которых может быть предположено наличие общего эволюционного предка. Обычно суперсемейство объединяется по принципу сходства вторичных и третичных структур белков, входящих в него и по принципу сходства механизма действия белков. Примеры: - Суперсемейство иммуноглобулинов - Суперсемейство щелочных фосфатаз. - Суперсемейство Ras-подобных белков. 89. Дайте определение термину «изофункциональные белки» Изофункциональные белки - семейства белков, выполняющих почти одинаковую или близкую функцию, но небольшие особенности строения и функционирования некоторых членов этого семейства могут иметь важное физиологическое значение. 90. Приведите пример изофункциональных белков Пример таких белков - изоформы гемоглобина человека: HbA, HbA2, HbF. 91. Дайте определение термину «гомологичные белки» Гомологичные белки - белки, имеющие сходную структуру, общее эволюционное происхождение и выполняющие одинаковую функцию у разных видов организмов 92. Дайте определение термину «изоэлектрическая точка» белка Изоэлектрическая точка (pI) — кислотность среды (pH), при которой определённая молекула или поверхность не несёт электрического заряда. 93. Назовите известные вам методы разрушения тканей, позволяющие экстракциюбелков - Гомогенизация биологического материала - Метод замораживания и оттаивания ткани - Экстракция белков, связанных с мембранами, и разрушение олигомерных белков на протомеры - Удаление из раствора небелковых веществ 94. Опишите метод гомогенизации биологического материала для экстракции белков Гомогенизация биологического материала Ткань, находящуюся в буферном растворе с определённым значением рН и концентрацией солей, помещают в стеклянный сосуд (гомогенизатор) с пестиком. Вращающийся пестик измельчает и растирает ткань о притёртые стенки сосуда. 95. Опишите метод замораживания и оттаивания ткани для экстракции белков Метод замораживания и оттаивания ткани В результате попеременного замораживания и оттаивания образующиеся кристаллы льда разрушают оболочки клеток. После разрушения ткани нерастворимые части осаждают центрифугированием. Последующее центрифугирование гомогената с разной скоростью позволяет получить отдельные фракции, содержащие клеточные ядра, митохондрии и другие органеллы, а также надосадочную жидкость, в которой находятся растворимые белки цитозоля клетки. Искомый белок будет содержаться в одной из этих фракций. 96. Опишите метод экстракции белков, связанных с мембранами Экстракция белков, связанных с мембранами Если искомый белок прочно связан с какими-либо структурами клетки, его необходимо перевести в раствор. Так, для разрушения гидрофобных взаимодействий между белками и липидами мембран в раствор добавляют детергенты; чаще всего используют тритон Х-100 или додецилсульфат натрия. 97. Опишите метод удаления из раствора липидов для экстракции белков Удаление из раствора небелковых веществ Нуклеиновые кислоты, липиды и другие небелковые вещества можно удалить из раствора, используя их особенные физико-химические свойства. Так, липиды легко удаляются из раствора добавлением органических растворителей, например ацетона. Однако воздействие должно быть кратковременным, так как ацетон вызывает денатурацию некоторых белков. Нуклеиновые кислоты осаждают добавлением в раствор стрептомицина. 98. Назовите три-четыре метода очистки белков. Высаливание, гель-фильтрация, ультрацентрифугирование, электрофорез 100. Опишите метод очистки белков высаливанием. Метод очистки белков, основанный на различиях в их растворимости при разной концентрации соли в растворе. Соли щелочных и щёлочно-земельных металлов вызывают обратимое осаждение белков, т.е. после их удаления белки вновь приобретают способность растворяться, сохраняя при этом свои нативные свойства. Чаще всего для разделения белков методом высаливания используют разные концентрации солей сульфата аммония - (NH4)2SO4. Чем выше растворимость белка, тем большая концентрация соли необходима для его высаливания. 101. Опишите метод очистки белков гель-фильтрацией. Метод разделения белков с помощью гель-фильтрационной хроматографии основан на том, что вещества, отличающиеся молекулярной массой, по-разному распределяются между неподвижной и подвижной фазами. Хроматографическая колонка заполняется гранулами пористого вещества (сефадекс, агароза и др.). В структуре полисахарида образуются поперечные связи и формируются гранулы с "порами", через которые легко проходят вода и низкомолекулярные вещества. В зависимости от условий можно формировать гранулы с разной величиной "пор". 102. Опишите метод очистки белков ультрацентрифугированием. Метод разделения также основан на различии в молекулярных массах белков. Скорость седиментации веществ в процессе вращения в ультрацентрифуге, где центробежное ускорение достигает, пропорционально их молекулярной массе. На поверхность буферного раствора, помещённого в кювету, наносят тонкий слой смеси белков. Кювету помещают в ротор ультрацентрифуги. При вращении ротора в течение 10-12 ч более крупные молекулы (с большей молекулярной массой) оседают в буферном растворе с большей скоростью. В результате в кювете происходит расслоение смеси белков на отдельные фракции с разной молекулярной массой. После расслоения белковых фракций дно кюветы прокаливают иглой и по каплям собирают содержимое небольшими порциями в пробирки. 103. Опишите методы очистки белков электрофорезом. Метод основан на том, что при определённом значении рН и ионной силы раствора белки двигаются в электрическом поле со скоростью, пропорциональной их суммарному заряду. Белки, имеющие суммарный отрицательный заряд, двигаются к аноду (+), а положительно заряженные белки - к катоду (-). 104. Опишите метод ионной хроматографии. Так же как и электрофорез, метод основан на разделении белков, различающихся суммарным зарядом при определённых значениях рН и ионной силы раствора. При пропускании раствора белков через хроматографическую колонку, заполненную твёрдым пористым заряженным материалом, часть белков задерживается на нём в результате электростатических взаимодействий. В качестве неподвижной фазы используют ионообменники - полимерные органические вещества, содержащие заряженные функциональные группы. 105. Опишите метод аффинной хроматографии. Это наиболее специфичный метод выделения индивидуальных белков, основанный на избирательном взаимодействии белков с лигандами, прикреплёнными (иммобилизированными) к твёрдому носителю. В качестве лиганда может быть использован субстрат или кофермент, если выделяют какой-либо фермент, антигены для выделения антител и т.д. Через колонку, заполненную иммобилизованным лигандом, пропускают раствор, содержащий смесь белков. К ли-ганду присоединяется только белок, специфично взаимодействующий с ним; все остальные белки выходят с элюатом. Белок, адсорбированный на колонке, можно снять, промыв её раствором с изменённым значением рН или изменённой ионной силой. В некоторых случаях используют раствор детергента, разрывающий гидрофобные связи между белком и лигандом. Аффинная хроматография отличается высокой избирательностью и помогает очистить выделяемый белок в тысячи раз. 106. Опишите метод диализа раствора белков Диализ — очистка коллоидных растворов и субстанций высокомолекулярных веществ от растворённых в них низкомолекулярных соединений при помощи полупроницаемой мембраны. При диализе молекулы растворенного низкомолекулярного вещества проходят через мембрану, а неспособные диализировать (проходить через мембрану) коллоидные частицы остаются за ней. |
