№1 РК билеты на каз Станд перечень (копия). 1 Жмса Д алуды технологиялы схемасын растыру. 2 Дз жне мб сапасын басару жйелері. Дз жне мб сапасын басару жйелері
 Скачать 293.14 Kb. Скачать 293.14 Kb.
|
|
ДӘРІЛІК ЗАТТАР МЕН МЕДИЦИНАЛЫҚ БҰЙЫМДАРДЫ ТАНДАРТТАУ ПӘНІНЕН № 1 АРАЛЫҚ БАҚЫЛАУ 1) Жұмсақ ДҚ алудың технологиялық схемасын құрастыру. 2) ДЗ және МБ сапасын басқару жүйелері. ДЗ және МБ сапасын басқару жүйелері. Дәрілік заттардың және басқа да фармацевтикалық тауарлардың сапасын бақылау жүйесі – дәрілік заттардың, медициналық бұйымдардың, медициналық техникалардың, биологиялық белсенді қоспалардың, емдік‑профилактикалық заттардың, косметикалық және стоматологиялық тауарлардың сапасыфн қамтамасыз ету шараларының кешенін құрайды. Дәрілік заттардың сапасын мемлекеттік бақылау келесі түрлерде жүргізіледі: ДЗ сапасын алдынала бақылау; ДЗ сапасын іріктеп бақылау; ДЗ сапасын қайталап іріктеп бақылау; ДЗ өндіруге арналған заттардың (субстанциялардың) және фармакологиялық белсенді өсімдік, жануарлар тектес немесе синтетикалық заттардың сапасын бақылау; Қазақсатан Республикасында азаматтарды тиімді және қауіпсіз және сапалы дәрі‑дәрмектік көмекпен қамтамасыз ету ҚР Денсаулық сақтау министрлігі жүесінің медициналық және фармацевтикалық қызметтерді бақылау Комитетіне, Дәрілік заттарды, медицина бұйымдарын және медициналық техникаларды сараптаудың Ұлттық орталығына жүктеледі. Дәрілік заттардың сапасын мемлекеттік бақылау органдары келесі негізгі қызметтерді атқарады Дәрілік заттарды, медицина бұйымдарын, медициналық техникаларды мемлекеттік тіркеуден өткізу және дәрілік заттардың сапасына мемлекеттік бақылау жүргізу; Дәрілік заттардың сапасын мемлекеттік бақылау жүйесінің ғылыми‑әдістемелік базасын дайындау және бекіту; Аймақтық дәрілік заттардың сапасын бақылау және сертификаттау органдарын аккредитациялау және жұмыстарын бақылау; Дәрілік заттардың, медицина бұйымдарының сәйкестіктерін растауды жүзеге асыру; Дәрілік заттар айналысы саласының кормативтік‑құқықтық актілерін жасап, сараптау жұмыстары жүргізу арқылы фальсифицирленген өнмдердің таралуына жол бермеу үшін фармацевтикалық қызметтерді қадағалау. 3) Таблеткалар өндірудің технологиялық схемасын құрастыру 4) Жұмсақ дәрілік түрлерді стандарттау (гельдер, кремдер, линименттер, майлар, пасталар). Жұмсақ дәрілік түрлерді стандарттау (гельдер,кремдер,линименттер,майлар,пасталар) Жергілікті қолданылатын жұмсақ дәрі-дәрмектер ай немесе күрделі негізден тұрады,онда бір немесе көп затар ерітілген немесе дисперстелген. Негіздер табиғи немесе синтетикалық заттардан тұруы мүмкін және бір немес көп фазалы болуы мүмкін.Негіздің табиғатына байланысты препараттың гидрофильді және гидрофобты қасиеттері болады. Жұмсақ дәрі-дәрмектер былай жіктеледі: Жақпамайлар Кремдер Гельдер Пасталар линименттер Жақпамайлар бір фазалы негізден тұрады, онда қатт немесе жұмсақ зат дисперстелу мүмкін Гидрофобты жақпамайларда аздаған мөлшерде су болуы мүмкін.Оларды дайындау үшін негіздері ретінде қатты ,сұйық ,жеңіл сұйық парафиндер ,өсімдік майлары,жануар тектес майлар,синтетикалық глицеидтер ,балауыздар болып табылады. Сулы эмульсиялы жақпамайларда көп мөлшерде су және эмульгатордың табиғатына байланысты судың майдағы типті эмульсиясы түрінде болуы мүмкін:собитан эфирлері,моноглицеридтер,полисобаттар пайдаланыллулы мүмкін. Гидрофильді жақпамайларды дайындау үшін сумен араласатын негіздер пайдаланылады. Кремдер эмульсиялық ақпамайға жатады.Олар липофильді фазадан және су фазасынан тұратын көп фазалы препараттар. Липофильді кремдерде тұрақты фаза ретінде липофильді фаза болады. Оларда жүн майы спирттері,собитан эфирлері ,моноглицеридтер сияқты судың майдағы типті эмульгаторлары болады. Гидрофильді кремдерде тұрақты фаза ретінде сулы фаза болады.Оларда натрий немесе троламин сабындаы ,сульфатталған май спирттері ,полисорбаттар ,майдың судағы типті эмульгаторлары қолданылады. Гельдер лайықты гель түзушілермен қоюлатылған сұйықтар.Олар жағылған жерде өз формасын жоғалтпай ұстап тұрады,көбіне мөлдір болып келеді. Липофильді гельдер(олеогельдер) негіздері,әдетте ,полиэтилені бар сұйық парафиннен немес коллоидтық кремний диоксидімен немесе аллюминий немесе мырыш сабындарымен өоюлатынған майлардан тұратын препараттар. Гидрофильді гельдер негіздері судан ,глицериннен немесе крахмал ,целлюлоза туындылары ,карбомерлер сияқты гель түзушілермен қоюлатынған препараттар. Пасталар –құрамында негізде майда дисперстелген көп қатты фазаның едәуір мөлшері бар жергілікті қолдануға арналған жұмсақ дәрі –дәрмектер.Пасталар-суспензиялық жақпа майға жатады. Линименттер дене температурасында еритін қоймалжың сұйық жағылмалар, құрамы бір немесе бірнеше дәрілік зат және негізден тұрады. Сапа көрсеткштері: Сипаттама Идентификация Номиналды масса Контейнер герметикалығы Біркелкілік РН Бөлшектедің мөлшері Қышқыл және пероксид саны Сандық анықтау Тектес қоспалар Микробиологиялық тазалық Орау,таңбалау ,тасымалдау,сақтау,негізгі фарм әсері 5) Дәрілік қалыптар мен дәрілік заттар туралы жалпы баптар (ҚР МФ I) 6) Фармацевтикалық қолдануға арналған субстанцияларды стандарттау Фармацевтикалық қолдануға арналған субстанцияларды стандарттау Субстанция-дайын дәрі-дәрмектер дайындау үшін пайдаланылатын стандартталған биологиялық белсенді зат(әдетте синтез жолымен алынған) немесе стандартталған биологиялық белсенді заттар қоспасы(әдетте, жануар немес өсімдік тектес нысандардан алынған).Субстанциялар дайын дәрі-дәрмектер ретінде пайдаланылмайды.Дайын дәрі-дәрмектер өндіруші –кәсіпорын дәрі жасау алдында субстанцияның сапасына бақылау жасайды.Барлық субстанциялар ҚР МФ монографиясының талапттарына сай болуы керек.Дайын дәрі-дәрмектер жасау үшін пайдаланылған субстанцияның барлық серияларының үлгілері дайын өнім шығарылғаннан кейін ,кем дегенде 2 жыл сақталады. Сапа көрсеткіштері: Сипаттама Идентификация Ерігіштік Балқу темп* Қайнау темп* Қатаю темп* Слыстырмалы тығыздық* Меншіті оптикалық айналу* Меншікті жұтылу көрсеткіші* Сыну көрсеткіші* Тұтқырлық* Ерітіндінің сапалық көрсеткіштері:-мөлдірлік,-түстілік,-қышқылдық немесе рН Механикалық қосылулар* Тектес қоспалар Органикалық еріткіштердің қалдық мөлшерлері Жеңіл көмірленетін заттар* Бейорг-қ катиондар* Кептіргендегі масса шығыны немесе су Жалпы күл немесе сульфат күлі Ауыр металдар Күшән* Микробиологиялық тазалық Пирогендер* Сандық анықтау Белсенділік* Орау,таңбалау,тасымалдау, сақтау,сақтау мерзімі,негізгі фармакологиялық әсері 7) ҚР ДМ фармакопеялық комитеті мен реттеуші органдардың API және жұмсақ дәрілік қалыптарды тексеруге қоятын талаптары. 8) ДЗ және МБ сапасын стандарттау әдістері ДЗ және МБ сапасын стандарттау әдістері ДЗ-тың сапасын бақылау тіркеу процедурасында міндетті кезеңдерінің бірі болып табылады. Әрбір қарастырылатын мемлекеттерде ДЗ-дың сапасын нормалатын регламенттер мен құжаттардың жинағы Фармакопея болып табылады. Стандарттау процесінде стандарттау нысанына қатысты нормалар, ережелер талаптар және сипаттамалар нормативтік құжат түрінде дайындалады. ХСҰ/МЭК басқармасы мыналарды ұсынады: стандарттар, техникалық жағдайдың құжаттары (ұйымның стандарттары), ережелер құрамы, регламенттер, қаулылар. Стандарттау мақсаты : - жоспарланған және орындалатын тапсырмаларды орындауда бекітілген ережелерді, талаптарды және нормаларды бір салада кең көлемде қолдану үшін жоғары дәреже реттеу; - өнімнің (қызметтің) талапқа сәйкестік дәрежесін жоғарылатуға, халықаралық тауар алмасудағы кедергілерді жоюға, ғылыми-техникалық прогреспен әртүрлі салалармен бірлесіп жұмыс жасауға бағытталған болу керек. Стандарттау — бұл сапалы өнімді тиімді бағаға бағалау, тұтыну құқықтарын қорғайтын, еңбек қауіпсіздігін қамтамасыз ететін орындалуы міндетті талаптар, ережелер, нормалар мен сипаттамалардан тұратын қызмет түрі. Мемлекеттік стандарттар сала аралық қажеттілігі бар өнімге, жұмысқа немесе қызметке арналып жасалады. Бұл стандарттары Қазақстанның Мемлекеттік Стандарт мекемесі қабылдайды. Аккредитация- заңды немесе жеке тұлғалардың ерекше міндеттерді нақты орындай алатынын мемлекеттің өкілетті ұйымның тануы. Тіркеу/Регистрация/ -өнімнің, процестің немесе қызметтің сапасы дәлелдегенде және тексеруден өткенде, аккредитацияланған тұлға ХСҰ-ның реестріне енізіліп, тіркеледі. -Халықаралық Стандарт Ұйымы /ХСҰ/ -Международная Организация Стандартизации /МОС/ -International Standardization Organization /ISO/ 9000 ХСҰ –өнім өндіретін ұйымның сапасын, менеджмент жоспарын жүзеге асыру және жобалау ұсыныстарын және талаптарын анықтайтын сапаны басқаратын халықаралық стандарттар құжаты Стандарт — бұл консенсус негізінде жасалған, нақты бір салада реттеудің жоғары деңгейіне жету мақсатында дайындалған, белгілі бір ұйыммен бекітілген нормативтік құжат болып табылады. Стандартта әртүрлі әрекеттер мен олардың нәтижелеріне тиісті жалпы немесе бірнеше рет қолданылатын принціптер, ережелер және сипаттамалар көрсетіледі. Стандарттаудың негізгі міндеттері: - өнімнің , адам және жануар өмірі мен денсаулығына, сонымен қатар қоршаған ортаға қауіпсіздігін қамтамасыз ету; - өнімдердің өзара алмасуы мен бірлесуі; -өнім, жұмыс және қызмет сапаларының ғылыми-техникалық прогрестің даму дәрежесіне сәйкес келу; - өлшем бірліктер біртұтастығы; - барлық ресурс түрлерінің үнемделуі; әр түрлі зақымданулар мен ластанулардың туындауына байланысты өнідірістік кәсіпордардың қауіпсіздігін қамтамасыз ету. Стандарттау - стандарттау нысаны және стандарттау саласы деген түсініктермен тығыз байланысты. Стандарттау нысаны (құралы) деп белгілі бір талаптарға, сипатамаларға, параметрлерге және ережелерге бағынатын өнімді, процесті немесе қызметті (мысалы, дәрі немесе оны дайындау технологиясы ) айтады. Стандарттау толық бір нысанға (дәрілік препаратқа) немесе оның құрамдас бір бөлігіне (әрекет етуші зат, шикізат, толықтырғыш) қатысты болуы мүмкін. Стандарттау саласы деп –стандарттау нысандарының өзара байланыс жиынтығын айтады. Мысалы, биотехнология стандарттау саласы, ал осы саланың нысандарына технологиялық процестер, аппарат түрлері, машиналардың экологиясы мен қауіпсіздігі (таблетка аппараты, автоклавтар, араластырғыштар, қайнату қазандары, реакторлар) жатады. Стандарттау дәрежесі географиялық, экономикалық және саяси аймақтағы қатысушы мемлекеттер қабылдаған стандарттарына байланысты болады. Халықаралық стандарттау дегеніміз мемлекеттегі стандарттау қызметіне басқа мемелекеттердегі сәйкес мекемелердің қатысуы. Аймақтық стандарттау — бір географиялық, саяси немесе экономикалық аймақтағы елдердің (мысалы, ТМД елдері) тиісті ұйымдарына қатысты қызмет түрі. Ұлттық стандарттау- тек қана нақты бір мемлекеттегі жүргізілетін стандарттау. Бұл жағдайда ұлттық стандарттау әртүрлі деңгейде: мемлекеттік, салалық, экономикалық (мысалы, министрліктер деңгейінде), бірлестік, өнідірістік кәсіпорындық (фабрика, завод) және ұйымдық дәрежеде қолданылуы мүмкін. Әкімшілік-аймақтық (провинциялық, өңірлік және т.б.) бірлікте жүргізілетін стандарттауды әкімшілік-аймақтық стандарттау деп атау қабылданған. Регламент — негізгі құқықтық нормалардан тұратын құжат түрі. Техникалық регламент —стандарттау нысанына арналған техникалық талаптардан тұрады. Басқа жағдайларда техникалық регламентке толығымен нормативтік құжаттар енгізіледі. Техникалық регламент ереже бойынша регламенттің талаптарына өнімнің (қызметтің, процестің) сәйкестігін тексеру немесе бақылау әдістерінің нұсқауынан тұрады, сонымен қатар әдістемелік құжаттармен толықтырылып отырады ҚР Стандарттау бойынша нормативтік құжаттары ҚР «Стандарттау туралы» Заңымен бекітіліген. Оларға мыналар жатады: • Қазақстан Республикасының Мемлекеттік стандарттары (СТ РК) халқаралық, аймақтық стандарттар, сонымен қатар стандарттау бойынша нормалар мен нұсқаулар қолданылады; • техниклық-экономикалық ақпараттардың жалпы қазақстандық классификаторлары; • салалық стандарттар; • кәсіпорынның стандарттары; • ғылыми-техникалық, инженерлік және басқа да қоғамдық бірлестіктердің стандарттары. Стандарттаудың негiзгi принциптерi: 1) келiсу; 2) бүкпесiздiк; 3) ерiктiлiк; 4) отандық және шетелдiк өндiрушiлер мен өнiм берушiлер үшiн стандарттау саласындағы бiрдей талаптар; 5) экономикалық қисындылық болып табылады. 9) ҚР МФ қызметінің жағдайы және механизмі. ҚР Мемлекеттік Фармакопеясының құрылымы ҚР Мемлекеттік Фармакопеясының құрылымы Мемлекеттік фармакопея (МФ) – бұл мемлекеттік бақылаудағы және заңды күші бар фармакопея. МФ талаптары дәрілік заттарды өндірумен, сақтаумен және қолданумен айналысатын белгілі бір мемлекеттің дәрілік заттар айналымының барлық субъектілері үшін міндетті болып табылады. ҚР МФ құру мемлекеттік қолдау арқылы 2005 жылдан бастап жүзеге асырылады. Фармакопеяның алғашқы басылымы үш томда мемлекеттік (қазақ) және орыс тілдерінде жарияланған [5-7]. I және II том 2008 жылы, III том 2015 жылы бекітілді және қолданысқа енгізілді. ҚР МФ заңнамалық мәртебесі "Халық денсаулығы және денсаулық сақтау жүйесі туралы"ҚР Кодексінде белгіленген. Бүкіл әлемде фармакопеяның жұмыс істеуі олардың миссиясымен айқындалады. Оның тұжырымдамаларының айырмашылығы барлық жағдайларда олардың қауіпсіздігін, тиімділігі мен сапасын қамтамасыз ететін дәрілік заттар сапасының мемлекеттік стандарттарын жасау жолымен, негізінен, қоғамның денсаулығын сақтауға түсетін мәнде көрсетілмейді. Сол мағына оның мақсаттарына шынайы ізгілікті сипат бере отырып, ҚР МФ миссиясына берілген.ҚР МФ талаптары әлемнің көптеген фармакопеяларымен қатар дәрілік заттарға ғана емес, медициналық мақсаттағы бұйымдарға да қолданылады. Осыған байланысты, ҚР МФ бастапқы анықтамасы медициналық практикада қолданылатын құралдардың көрсетілген санатын қамтитын өзгеріске ұшырады. Осылайша, ҚР МФ дәрілік заттар мен медициналық мақсаттағы бұйымдардың сапасын нормалайтын мемлекеттік стандарттар мен ережелердің жиынтығы болып табылады. ҚР МФ дәрілік заттарды стандарттау жүйесінде орталық орын алады. Фармакопея мемлекет кепілдік беретін дәрілік заттар сапасының шекті рұқсат етілген деңгейін белгілейді. Өндірушілердің ерекшеліктерімен регламенттелетін сапа деңгейі фармакопеялық талаптардан төмен болмауы керек. Өндірушінің ерекшелігі негізінде уәкілетті органмен келісім бойынша оның өмірлік циклінің барлық сатыларында сапаны бақылауға арналған дәрілік заттың сапасы бойынша нормативтік құжат жасалады. Осылайша, фармакопея талаптары дәрілік заттардың толық өмірлік циклін қамтиды. Жұмыс істеудің осындай тетігі дәрілік заттардың сапасын мемлекеттік реттеудің басты құралы ретінде ҚР МФ рөлін айқындайды 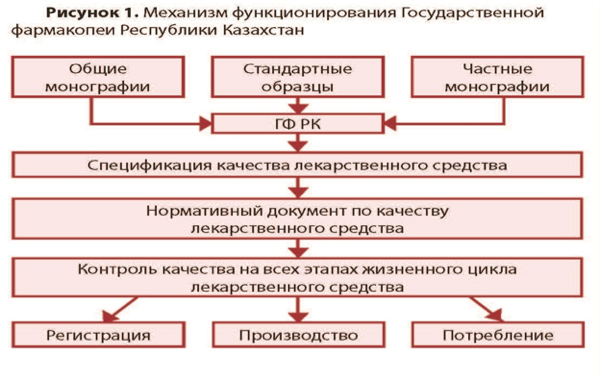 Қазіргі уақытта ҚР МФ 191 жалпы бөлім, 24 жалпы мәтін және 90 жалпы монографияны қамтиды (3-сурет). Оларда баяндалған жалпы талаптар мыналарға қолданылады:: сынау және сынау әдістері; - реактивтер;- сапа көрсеткіштері; - буып-түю материалдары мен контейнерлер; - фармацевтикалық қолдануға арналған субстанциялар; - дәрілік түрлер; - дәрілік препараттар, оның ішінде гомеопатиялық препараттар, радиофармацевтикалық препараттар; - биологиялық өнімдер; - дәрілік өсімдік заттары; - дәрілік өсімдік шикізатының морфологиялық топтары; - медициналық мақсаттағы бұйымдар (ыдыс ішіндегі катетерлер, тігіс материалдары). ҚР МФ жалпы монографияларымен қатар сапа көрсеткіштеріне, сынау әдістемелеріне және олардың қолайлылық өлшемдеріне қойылатын талаптарды регламенттейтін 646 жеке монография бар (4-сурет). Жеке монографиялар келесілерге таратылады:- фармацевтикалық қолдануға арналған субстанциялар, оның ішінде белсенді субстанциялар және қосалқы заттар;- әртүрлі дәрілік түрлердегі дәрілік препараттар;- дәрілік өсімдік шикізаты және дәрілік өсімдік препараттары;- - радиофармацевтикалық препараттар және радиофармацевтикалық препараттарға арналған шығыс материалдары;- медициналық иммунобиологиялық препараттар (вакциналар, иммуноглобулиндер).Фармакопеяның негізгі пайдаланушылары дәрілік заттарды әзірлеушілер, өндірушілер және дистрибьюторлар, дәріханалық ұйымдар, сапаны бақылау зертханалары, реттеуші және сараптамалық органдар, ғылыми және білім беру мекемелері болып табылады. 10) Фармацевтикалық қолдануға арналған субстанцияларды жіктеу және сапа спецификасын жасау. Фармацевтикалық қолдануға арналған субстанцияларды жіктеу және сапа спецификасын жасау. Субстанция : дайын дәрі дәрмектер дайындау үшін пайдаланылатын стандартталған биологиялық белсенді зат, (әдетте синтез жолымен алынған) немесе стандартталған биологиялық белсенді заттар қоспасы ( әдетте жануар немесе өсімдік тектес нысандардан алынған). Субстанциялар дайын дәрі дәрмек ретінде пайдаланылмайды. Дайын дәрі дәрмек өндіруші кәсіпорын , дайын дәрі дәрмек жасау алдында субстанциясының сапасына бақылау жүргізеді. Осы пайдаланылған субстанциялардың барлық серияларының үлгілері дайын өнім шығарылғаннан кейін, кем дегенде екі жыл кәсіпорында сақталады. |
