решение (1). 1. Кипение воды протекает без изменения химического состава веществ это фазовый переход воды из жидкого состояния в газообразное, т е.
 Скачать 1.96 Mb. Скачать 1.96 Mb.
|
|
Катализаторы используют для увеличения скорости реакции, повышения ее селективности, конверсии и выхода целевого продукта. ЕА1 = 200 кДж/моль, ЕА2 = 100 кДж/моль, Т=400 К. К1 = К0 * е -Е А1 / RT , К2 = К0 * е -Е А2 / RT , 331. С точки зрения химической термодинамики, химическое равновесие характеризуется постоянством концентраций веществ во времени. Согласно химической кинетике, равновесие определяется равенством скоростей прямой и обратной реакций. А) N2 (г) + 3H2 (г) = 2NH3 (г), 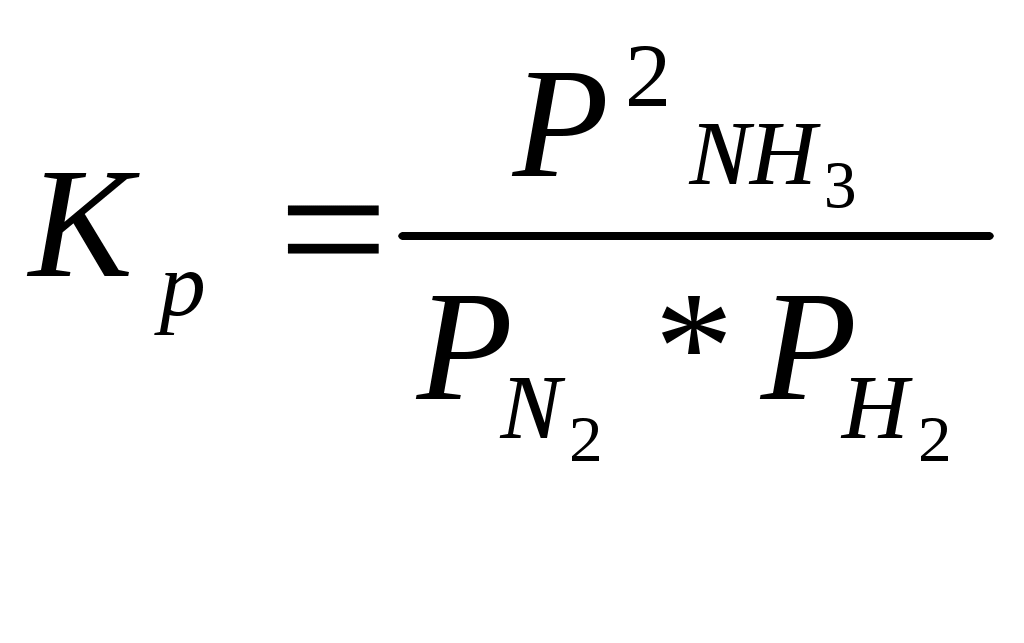 Б) Fe3O4 + 4CO (г) = 3Fe (к) + 4CO2 (г), 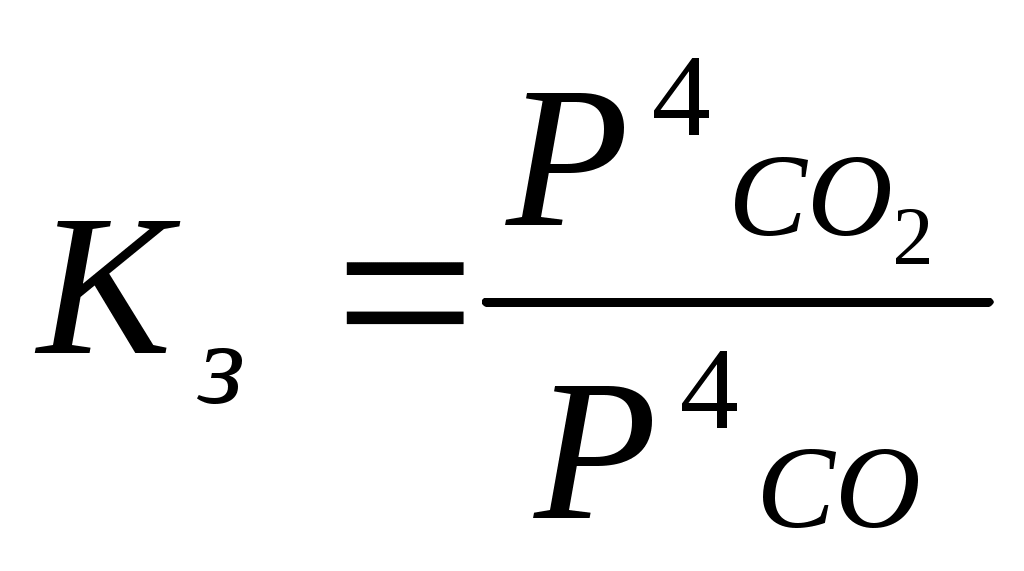 332. Константа химического равновесия - это отношение произведения концентраций продуктов химической реакции к произведению концентраций исходных веществ, взятых в степенях, равных их стехиометрическим коэффициентам. А) 4HCl + O2 (г)= 2Cl2(г) + 2H2O (г), 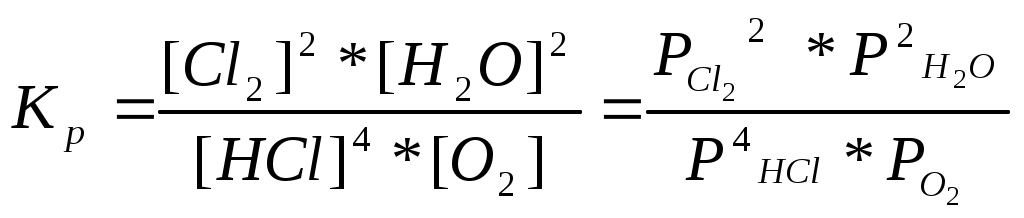 Б) CaO (k) + H2O (г) = Сa(OH)2 (к), 333. Состояние реакции, при котором концентрации веществ не изменяются во времени, называется равновесным. Основные признаки: если на реакцию, находящуюся в состоянии химического равновесия оказать воздействие, то система перейдет в новое равновесное состояние, уменьшающее это воздействие. Если воздействие снять, то реакция вернется к исходному состоянию. А) CO(г) + H2O(г) = CO2(г) + H2(г) Б) 2CuO(к) = 2Cu(к) + O2(г) 334. При истинном равновесии химическая реакция характеризуется постоянством концентраций всех веществ в течение сколь угодно долгого промежутка времени. При этом реакция подчиняется принципу Ле Шателье. При ложном химическом равновесии с течением времени концентрации веществ могут меняться, и реакция не подчиняется принципу Ле Шателье. А) 3O2(г) = 2О3 (г), 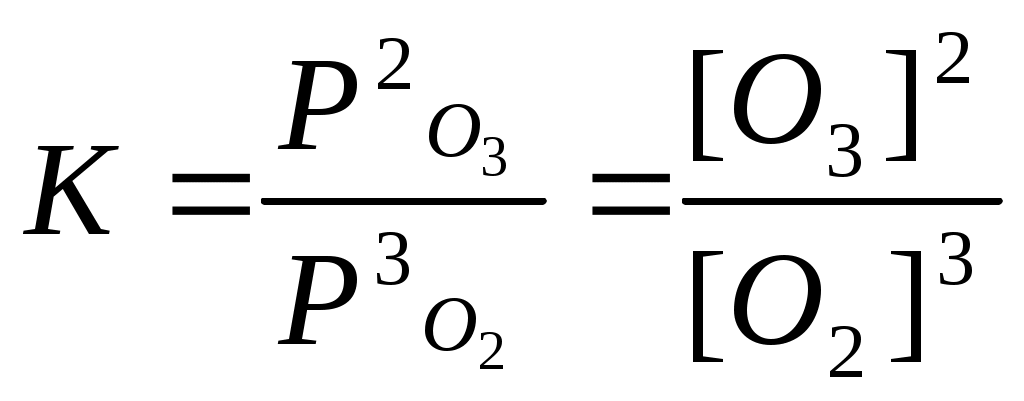 Б) Na2CO3 (к) + CO2(г) + H2O(г) = 2NaHCO3(к), 335. Закон действующих масс: константа равновесия химической реакции равна отношению произведения концентраций продуктов реакции к произведению концентраций исходных веществ, взятых в степенях, равных их стехиометрическим коэффициентам: аА + bB = cC + dD, А) N2 (г) + О2 (г) = 2NО(г), 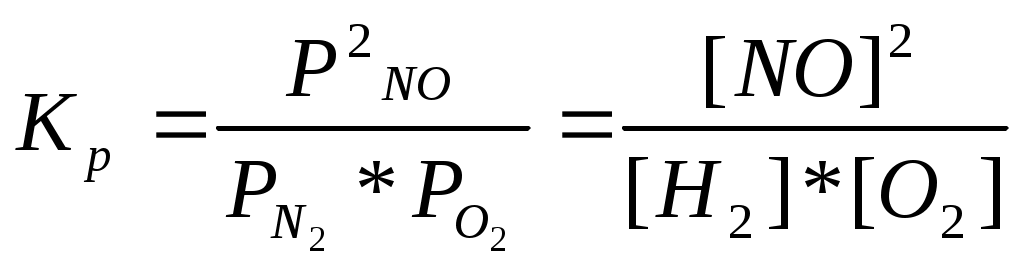 , ,Б) 3Fe(к) + 4H2O(г) = Fe3O4(к) + 4H2(г), 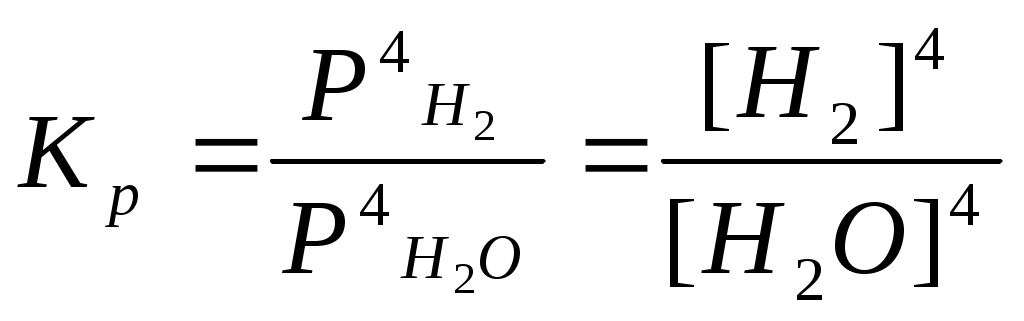 . .336. На величину константы химического равновесия влияют: природа реагирующих веществ, температура, давление. А) Y2 (г) + H2 (г) = 2HY (г), 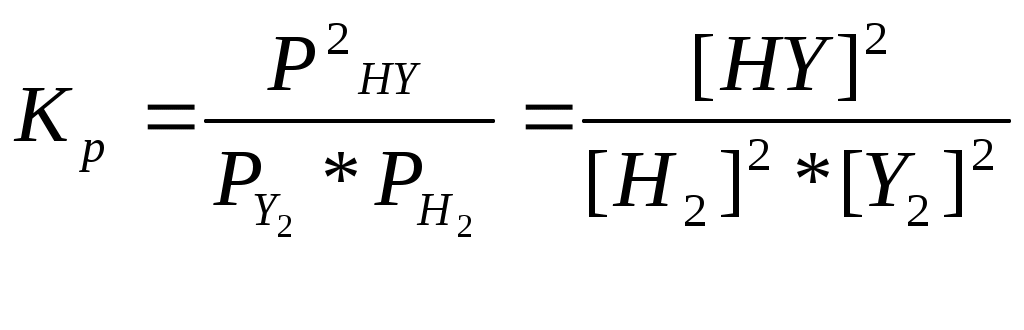 , ,Б) MgO(к) + CO2(г) = MgCO3(к), 337. N2 (г) + 3H2 (г) = 2NH3 (г),
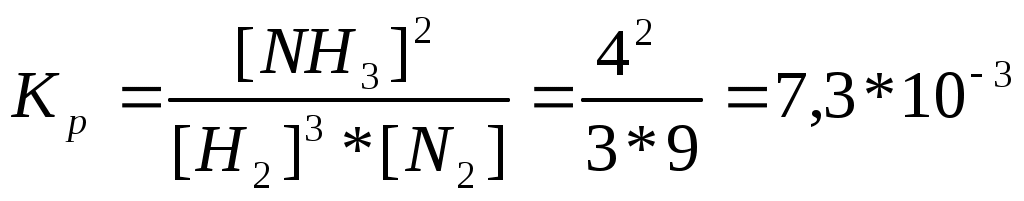 , Сисх. (N2) = [N2] + 0,5[NH3] = 3+ 0,5*4 = 5 моль/л. , Сисх. (N2) = [N2] + 0,5[NH3] = 3+ 0,5*4 = 5 моль/л. Сисх(Н2) = [Н2] + 1,5[NH3] = 9 + 1,5*4 = 15 моль/л. 338. CO + Cl2 = COCl2
Сисх(CO) = [CO] + [COCl2] = 0,2 + 1,2 = 1,4 моль/л. 339. CO + H2O = CO2 + H2
Согласно уравнению реакции, водорода образуется столько же, сколько и СО2: [CO2]=[H2]=0,01 моль/л. СО и Н2О израсходовалось 0,01 моль/л, следовательно [CO]=[H2O]=0,02 моль/л. 340. FeO(k) + CO = Fe(k) + CO2
341. Br2 (г) + H2 (г) = 2HBr (г),
[H2] = 3-0.54 = 2.46 моль/л, [Br2] = 1-0.54 = 0.46 моль/л, [HBr] = 2*0.54=1.08 моль/л. w(H2)=(2.46/4)*100 %=61.5%, w(Br2)=(0.46/4)*100%=11.5%, w(HBr)=(1.08/4)*100%=27%. 342. N2O4 (г) = 2NO2 (г),
Прореагировало 0.08*0.5 = 0.04 моль/л N2O4. Следовательно, образовалось 2*0.04 = 0.08 моль/л NO2 . 343. Y2 (г) + H2 (г) = 2HY (г),
К=40 В=(0.015*100)/(2*0.01)=76% 344. Y2 (г) + H2 (г) = 2HY (г),
К=50 345. 2HY (г) = Y2 (г) + H2 (г)
К = 2*10-2 346. Cl2 (г) = 2Cl(г)
К=4.2*10-4 347. CO + H2O = CO2 + H2
К=1. 348. PCl5 = PCl3 + Cl2
|
