решение (1). 1. Кипение воды протекает без изменения химического состава веществ это фазовый переход воды из жидкого состояния в газообразное, т е.
 Скачать 1.96 Mb. Скачать 1.96 Mb.
|
3.4. Межмолекулярное взаимодействие. Агрегатное состояние вещества.471. Водородная межмолекулярная связь образуется в том случае, когда молекула содержит водород, связанный с сильно электроотрицательным атомом (O, F, N, Cl). При этом электронная плотность оттягивается от водорода на соседний атом и образуется внутримолекулярный диполь. Две и более молекулы способны притягиваться друг к другу за счет взаимодействия разноименных полюсов этих диполей. Образование водородных связей возможно между HF. 472. Водородная межмолекулярная связь образуется в том случае, когда молекула содержит водород, связанный с сильно электроотрицательным атомом (O, F, N, Cl). При этом электронная плотность оттягивается от водорода на соседний атом и образуется внутримолекулярный диполь. Чем более электроотрицательный атом связан с водородом, тем сильнее водородная связь, поэтому наибольшая энергия водородных связей между HF, а наименьшая между NH3. 473. Аномально высокая температура кипения плавиковой кислоты объясняется наличием между ее молекулами водородных связей. Водородная межмолекулярная связь образуется в том случае, когда молекула содержит водород, связанный с сильно электроотрицательным атомом (O, F, N, Cl). При этом электронная плотность оттягивается от водорода на соседний атом и образуется внутримолекулярный диполь. Две и более молекулы способны притягиваться друг к другу за счет взаимодействия разноименных полюсов этих диполей. 474. Аномально высокая растворимость в воде плавиковой кислоты по сравнению с соляной кислотой объясняется наличием между молекулами HF водородных связей. Молекулы воды также притянуты друг к другу водородными связями. Между HF и H2O возможно сильное межмолекулярное взаимодействие, а между водой и HCl межмолекулярное взаимодействие гораздо слабее. В результате растворимость фтороводорода выше. 475. Аномально высокая растворимость в воде аммиака по сравнению с фосфином объясняется наличием между молекулами NH3 водородных связей. Молекулы воды также притянуты друг к другу водородными связями. Между NH3 и H2O возможно сильное межмолекулярное взаимодействие, а между водой и PH3 межмолекулярное взаимодействие гораздо слабее. В результате растворимость аммиака выше. 476. Аномально высокая растворимость в воде серной кислоты по сравнению с соляной кислотой объясняется наличием между молекулами H2SO4 водородных связей. Молекулы воды также притянуты друг к другу водородными связями. Между H2SO4 и H2O возможно сильное межмолекулярное взаимодействие, а между водой и HCl межмолекулярное взаимодействие гораздо слабее. В результате растворимость серной кислоты выше соляной. 477. Природа водородных связей электростатическая, а при образовании ковалентной связи взаимодействие настолько сильное, что электронные оболочки атомов перекрываются, поэтому длина ковалентной связи во много раз меньше водородной. Димер H2F2 представляет собой две молекулы плавиковой кислоты притянутые друг к другу водородной связью. Н-F---F-H. Водородная связь HF гораздо длиннее ковалентных связей HF. 478. С увеличением молекулярной массы температура кипения однотипных веществ увеличивается. Однако, в предложенном ряду температура кипения воды имеет аномально высокое значение из-за наличия между молекулами Н2О водородных связей. Дополнительное связывание между молекулами приводит к увеличению температуры кипения воды, поэтому ее температура кипения не укладывается в типичную закономерность. 479. Водородные связи между молекулами воды имеют крайне важное значение, поскольку, благодаря этому дополнительному взаимодействию, вода при н.у. жидкая, обладает упорядоченностью ближнего порядка и некоторыми другими полезными свойствами. Если бы водородные связи отсутствовали, вода при н.у. была газообразной, и жизнь в том виде, в котором она существует сейчас, вряд ли была. 480. Внутримолекулярная связь имеет место в соединении 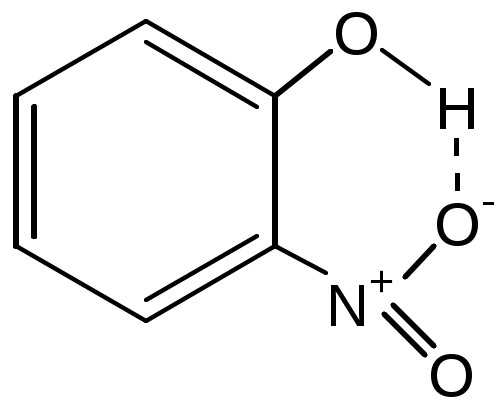 . Внутримолекулярная связь изменяет валентные углы, немного увеличивает температуру его кипения. . Внутримолекулярная связь изменяет валентные углы, немного увеличивает температуру его кипения.481. 1) Водородная связь не является разновидностью ковалентной, т.к. при ее образовании не происходит образования электронных пар, перекрывания электронных облаков и энергия водородной связи намного меньше энергии ковалентной связи. 2) Донорно-акцепторный механизм - это один из видов образования ковалентной связи, а водородная связь не является ковалентной. 3) Метод МО описывает образование молекул, а при образовании водородной связи новых молекул не образуется. 482. Вандерваальсовским взаимодействием называются такие взаимодействия, как дисперсионное, индукционное и ориентационное. Вандерваальсовское взаимодействие осуществляется за счет электростатических сил, в то время как химические связи образуются при взаимодействии электронов. Дисперсионное взаимодействие наблюдается, например, между молекулами хлора, атомами благородных газов. При увеличении размера атома увеличивается дисперсионное взаимодействие - увеличивается температура кипения вещества. Индукционное взаимодействие осуществляется, например, между полярными молекулами воды и неполярными молекулами спирта, что соответствует процессу растворения спирта в воде. Ориентационное взаимодействие осуществляется, например, между полярными молекулами аммиака. Данный вид взаимодействия ответственен за увеличение температуры кипения веществ. 483. Вандерваальсовским взаимодействием называется взаимодействие молекул, которое осуществляется за счет электростатических сил. Переход в конденсированное состояние Ne, N2, Cl2 обусловлен дисперсионным взаимодействием. Переход в конденсированное состояние HI, BF3, H2O обусловлен ориентационным взаимодействием. 484. Универсальным взаимодействием, действующим между всеми молекулами, является дисперсионное взаимодействие: образование между молекулами мгновенных микродиполей. 485. Вандерваальсовское взаимодействие делится на три вида. 1) Дисперсионное взаимодействие: образование между молекулами мгновенных микродиполей. Синхронное появление и исчезновение микродиполей разных молекул приводит к их взаимному притяжению. 2) Ориентационное взаимодействие проявляется между полярными молекулами. В результате беспорядочного теплового движения молекул при сближении их друг с другом одноименно заряженные концы диполей взаимно отталкиваются, а противоположные притягиваются. Чем более полярны молекулы, тем сильнее они притягиваются и тем самым больше ориентационное взаимодействие. 3) Индукционное взаимодействие молекул осуществляется за счет их индуцированных диполей. При сближении полярной и неполярной молекул неполярная молекула деформируется, и в ней наводится индуцированный дипольный момент, в результате молекулы притягиваются. Не способны к индукционному и ориентационному взаимодействию неполярные молекулы N2, Ar, He, Cl2. 486. Дисперсионное взаимодействие: H2 + O2, H2 + H2O, H2O + NH3, NH3 + NF3, NF3 + BF3, HCl + HCl, HF + HF. Индукционное взаимодействие: H2 + H2O, H2O + NH3, NH3 + NF3, NF3 + BF3, HCl + HCl, HF + HF. Ориентационное взаимодействие: H2O + NH3, NH3 + NF3, NF3 + BF3, HCl + HCl, HF + HF. 487. При повышении порядкового номера благородного газа возрастает размер атома - увеличивается дисперсионное взаимодействие между атомами - в результате увеличивается температура кипения. 488. Увеличение температуры кипения в ряду BF3, BCl3, BBr3, BI3, объясняется ростом вклада дисперсионного взаимодействия между молекулами при увеличении их размеров. Дисперсионное взаимодействие: образование между молекулами мгновенных микродиполей. Синхронное появление и исчезновение микродиполей разных молекул приводит к их взаимному притяжению. Ориентационное взаимодействие проявляется между полярными молекулами. В результате беспорядочного теплового движения молекул при сближении их друг с другом одноименно заряженные концы диполей взаимно отталкиваются, а противоположные притягиваются. Чем более полярны молекулы, тем сильнее они притягиваются и тем самым больше ориентационное взаимодействие. Индукционное взаимодействие молекул осуществляется за счет их индуцированных диполей. При сближении полярной и неполярной молекул неполярная молекула деформируется, и в ней наводится индуцированный дипольный момент, в результате молекулы притягиваются. Обсуждение таблицы: не способны к индукционному и ориентационному взаимодействию неполярные молекулы, поэтому между Ar и СО действует только дисперсионное взаимодействие. Молекула HCl мало полярная, поэтому вклад дисперсионного взаимодействия больше, чем ориентационного и индукционного, в то время как для полярных молекул воды и аммиака наблюдается обратная закономерность. 489. В методичке нет условия 490. Ион-дипольным взаимодействием называется индукционные силы Вандерваальса. Индукционное взаимодействие молекул осуществляется за счет их индуцированных диполей. При сближении полярной и неполярной молекул неполярная молекула деформируется, и в ней наводится индуцированный дипольный момент, в результате молекулы притягиваются. К+ + H2O, H2O + NH4+, NH3 + NF3, NF3 + BF3, H+ + HCl, HF + HF. Оно проявляется, например, при растворении спирта в воде. 491. Данный вид межмолекулярного взаимодействия описывает ориентационные силы Вандерваальса. Взаимодействие происходит при диссоциации сильного электролита (NaCl) в воде. 492. При образовании гидратов и клатратов между частицами и молекулами воды действуют силы Вандерваальса. При образовании связи между водой и полярной молекулой (NH3*H2O, H2SO4*H2O, H2SO4*2H2O, CuSO4*5H2O) действуют ориентационные силы, а между водой и неполярной молекулой (Ar*8H2O) - индукционное взаимодействие. 493. Уравнение Вандерваальса: 494. Агрегатные состояния: твердое (в свободном состоянии не твердое тело изменяет форму и объем) → жидкое (в свободном состоянии жидкое тело принимает форму сосуда, в котором находится, но не изменяет объем) → газообразное (в свободном состоянии принимает форму сосуда, в котором находится, может изменять объем). 495. Кристаллическое состояние характеризуется наличием дальнего порядка в решетке, в то время как аморфное состояние вещества определяется как отсутствие дальнего порядка в объеме. Аморфные вещества обладают значительной вязкостью, а кристаллические практически не вязкие. Кристаллические вещества классифицируются на ионные (ионная связь: решетка NaCl), ковалентные (ковалентная связь: решетка PbO), молекулярные (молекулярная связь, решетка СО2), металлические (металлическая связь: решетка Fe). 496. Поваренная соль: NaCl (ионная связь - ионная решетка), алмаз и графит: С (ковалентная связь, ковалентная кристаллическая решетка), кремнезем: SiO2 (ковалентная связь, ковалентная кристаллическая решетка), железо: Fe (металлическая связь - металлическая решетка), сухой лед: СО2 (молекулярная связь - молекулярная кристаллическая решетка). 497. Необходимо все три порошка разместить в разные сосуды с дистиллированной водой. Сразу идентифицировать не растворившийся песок. Затем в оставшиеся сосуды опустить разомкнутые концы электрической цепи, в которую включена лампочка. Т.к. раствор хлорида натрий проводит электрический ток, то в сосуде, содержащем NaCl цепь замкнется и лампочка загорится. Раствор с сахаром - это оставшийся третий сосуд. 498. Дальтониды - NaCl, CaF2, MgO. Бертоллиды - TiO0.8-1.7, CuxOy, MnS0.9-1.1. Бертоллиды имеют переменный состав, т.к. их кристаллические решетки имеют очень высокую дефектность - выпадение атомов из узлов решетки, либо, наоборот, внедрение атомов в решетку. В зависимости от степени и вида дефектности меняется состав бертоллида. 499. Полиморфизм - способность вещества при определенных температурах и давлениях образовывать в твердом состоянии различные типы кристаллических структур. Например, SiC имеет более сорока модификаций, у олова их две - белое и серое. Изоморфизм - сходство пространственной структуры и химической природы веществ. Например, медь и серебро имеют одинаковую структуру решетки - гцк. Полиморфные модификации: диоксид кремния - 3 (кварц, кристобаллит, тридимит), фторид кальция - 2, железо - 4 (α, β, δ, γ). 500. Идеальным называется кристалл, не имеющий дефектов. Реальные кристаллы содержат поверхностные (дислокации, гряды, ступеньки и т.д.) и объемные дефекты (внедрения, замещения, вычитания). Наличие дефектов сильно изменяет свойства кристаллов: меняется ковкость, пластичность, электро- и теплопроводность. Химическая активность дефектных структур обычно увеличивается. Блажен лишь тот, кто по утру Имеет стул без принужденья Тому и пища по нутру И прочие мирские наслажденья. |
