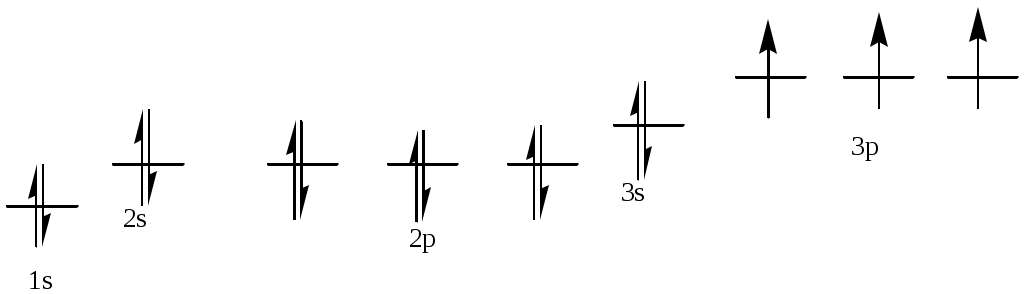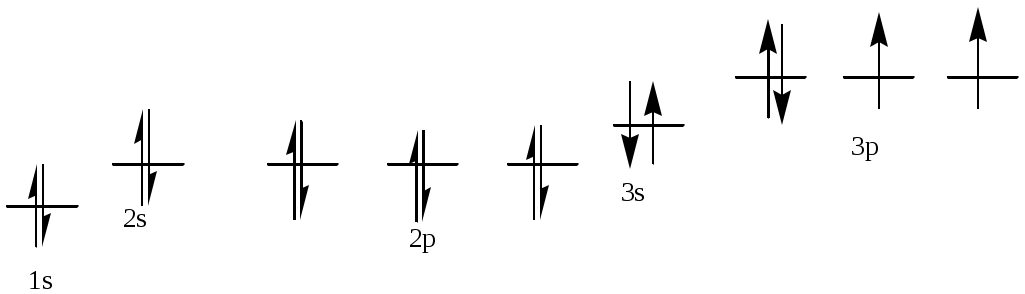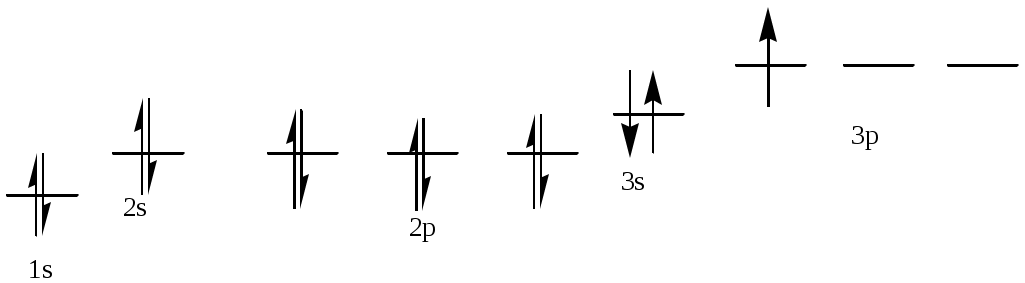решение (1). 1. Кипение воды протекает без изменения химического состава веществ это фазовый переход воды из жидкого состояния в газообразное, т е.
 Скачать 1.96 Mb. Скачать 1.96 Mb.
|
|
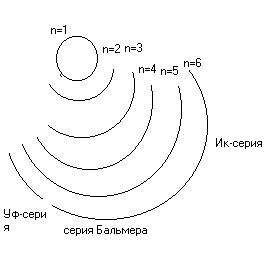
363. Согласно модели Резерфорда, атом состоит из ядра, в котором сосредоточена основная масса атома, и электронов, движущихся на относительно большом расстоянии от ядра. Однако эта модель противоречила факту устойчивого существования атомов: в результате движения электроны расходуют энергию притяжения с ядром, и через 10-8 секунды они должны упасть на ядро. Кроме того, электроны теряют энергию за счет излучения, образующего сплошной спектр, что также противоречило фактам: все атомные спектры имеют линейчатый характер. В 1913 г. Бор предложил теорию строения водородного атома. Основными отличиями от предыдущей теории были следующие: электроны двигаются по строго определенным орбитам, до тех пор пока электрон находится на этой орбите, он не излучает. При переходе электрона с одной орбиты на другую выделяется энергия, что объясняет происхождение атомных спектров. Однако, теория Бора не пригодна к описанию строения сложных атомов. Современная теория строения атома включает в себя квантово-механические представления: наличие у электрона свойств волны и частицы, невозможность одновременного определения координаты и импульса микрочастицы, применение волновой функции ψ для описания свойств электрона. 365. Атомная масса химического элемента рассчитывается как сумма вкладов атомных масс изотопов. Атомная масса хлора равна А(Cl) = 35*75.53%/100% + 37*24.47%/100% = 35.49 а.е.м. 366. Атомная масса химического элемента рассчитывается как сумма вкладов атомных масс изотопов. Атомная масса меди равна А(Cu) = 63*73%/100% + 65*27%/100% = 63.54 а.е.м. Результат не совпадает с табличным значением из-за т.н. «дефекта массы»: несовпадение значения суммы масс нуклонов и массы ядра, которое они составляют вследствие потери энергии. 367. Атомная масса химического элемента рассчитывается как сумма вкладов атомных масс изотопов. Атомная масса урана равна А(U) = 234*0.0058%/100% + 235*0.715%/100% + 238*99.28%/100% = 237.98 а.е.м. Результат не совпадает с табличным значением из-за т.н. «дефекта массы»: несовпадение значения суммы масс нуклонов и массы ядра, которое они составляют вследствие потери энергии. 368. Процессы взаимодействия ядер одних элементов с ядрами других элементов или с элементарными частицами, при которых образуются ядра новых элементов, получили название ядерных реакций. Ядерные реакции отличаются от химических тем, что в химических реакциях не происходит изменения ядерного состава. На Солнце протекает много ядерных реакций по суммарной схеме: 4р = α + 2е+ + 565 млн. ккал. Искусственно впервые осуществил ядерную реакцию Резерфорд (1919): 369. 370. 371. Спектры химических элементов получают путем сообщения атомам энергии, например в виде квантов света. При этом происходит возбуждение и переход электронов на более удаленные орбитали, возвращаясь с которых, они излучают. Таким образом получается линейчатый спектр испускания. Спектры имеют линейчатый вид, поскольку все переходы электронов дискретны, т.е. прерывисты. Спектр водорода состоит из трех серий: УФ - серии, серии Бальмера (видимый спектр) и ИК - серии. Перескокам с удаленных орбит на орбиту с n=1 соответствуют линии серии, лежащей в УФ-области, перескокам на орбиту с n=2 - линии серии Бальмера, перескокам на орбиты с n=3, 4, 5
372.
373. Для расчета энергии возбуждения электрона с одного уровня на другой используется уравнение: 374. а) Принцип квантования и дискретности энергии: электрон не изменяет энергию непрерывно, переходя с одной орбиты на другую, изменение энергии электрона происходит скачкообразно. Т.е. энергетические состояния электрона в атоме дискретны. б) Корпускулярно-волновая двойственность: электрон имеет свойства как частицы, так и волны. в) Принцип неопределенности: нельзя одновременно и точно определить скорость электрона и его координаты. Таким образом, электрон в атоме вращается по определенным орбитам с дискретной энергией. Поглощение или выделение энергии происходит только при переходе электрона с одной орбиты на другую. 375. Квантовая механика изучает движения и взаимодействия микрочастиц. Она основывается на представлении о квантовании энергии, волновом характере движения микрочастиц и вероятностном методе описания микрообъектов. Основным уравнением квантовой механики является волновое уравнение Шредингера, которое связывает волновую функцию с потенциальной полной энергией электрона. Волновые функции, получаемые решением этого уравнения, описывают орбитали. 376. Совокупность положений электрона в атоме, характеризуемых определенными значениями квантовых чисел называют атомной орбиталью.  377. а) Главное квантовое число (n) соответствует номеру энергетического слоя, в котором находится электрон. б) Орбитальное квантовое число (l) определяет форму орбитали, форму электронного облака. в) Магнитное квантовое число (m) определяет пространственную ориентацию орбиталей. г) Спиновое квантовое число (s) определяет направление собственного вращения электрона. 378. Энергию электрона определяют главное, спиновое и магнитное квантовые числа. Наиболее существенно зависит энергия электрона от главного квантового числа, наименее - от магнитного. Магнитное квантовое число влияет на энергию электронов в пределах одного подуровня. 379. Энергетический уровень - набор атомных орбиталей с одинаковым значением главного квантового числа (n). Энергетический подуровень - набор атомных орбиталей с одинаковым значением орбитального квантового числа (l) внутри данного энергетического уровня. Число энергетических подуровней для данного энергетического уровня равно 2n2. Если энергетический уровень расщеплен на 4 подуровня, то n=2. 380. Электронный слой - это совокупность электронов с одинаковым значением главного квантового числа n. В электронном слое с n = 1 наибольшее количество содержащихся электронов - 2, в n = 2 - 8 электронов, в n = 3 - 18 электронов, в n = 4 - 32 электрона, в n = 5 - 50, в n = 6 - 72, в n = 7 - 98. Максимально теоретически допустимое количество электронов в слое равно 2n2. 381. Форму орбитали в пространстве определяет побочное квантовое число L. L принимает значения от 0 до (n - 1). Значению L=0 отвечает сферическая форма орбитали: 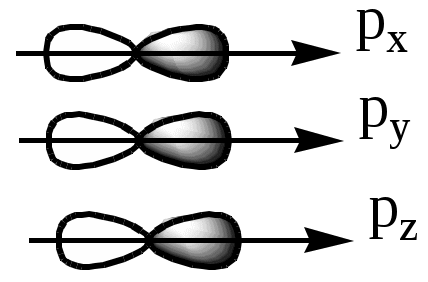 382. Число атомных орбиталей (AO) определяется магнитным квантовым числом ML., оно равно (2L + 1). Так, на s-подуровне количество AO равно 1, т.к. для s-подуровня L=0. на р-подуровне число AO равно 3, т.к. L=1. На d-подуровне число AO равно 5, т.к. L = 2. 383. S-электронное облако имеет форму шара. Оно обладает сферической симметрией. Р-облако имеет гантелеобразную форму и обладает осевой симметрией. D-облака имеют форму скрещенных гантелей и осевую симметрию. 384. Фосфор, № 15. 1s22s22p63s23p3. Атом фосфора имеет в нормальном состоянии 3 неспаренных электрона на 3р-подуровне. При возбуждении электроны с 3s-подуровня распариваются, и один из них переходит на вакантную орбиталь d-подуровня, образуя при этом 5 неспаренных электронов.
385. Сера, № 16. 1s22s22p63s23p4. Атом серы имеет в нормальном состоянии 2 неспаренных электрона на 3р-подуровне. При возбуждении электроны с 3s- и 3р-подуровней могут распариваться, и переходить на вакантные орбитали d-подуровня, образуя при этом 4 или 6 неспаренных электронов.
386. Алюминий, № 13. 1s22s22p63s23p1. Атом алюминия имеет в нормальном состоянии 1 неспаренный электрон на 3р-подуровне. При возбуждении электрон с 3s-подуровня может распариться, и перейти на вакантную орбиталь 3d-подуровня, образуя при этом 3 неспаренных электрона.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||