Тема 21. Фенолы и хиноны. 1. Классификация и номенклатура
 Скачать 294.18 Kb. Скачать 294.18 Kb.
|
1 2 ФЕНОЛЫ План
Фенолы – гидроксилпроизводные ароматических углеводородов, в которых группа ОН связана с атомом углерода ароматического ядра. 1. Классификация и номенклатура По количеству ароматических ядер в молекуле различают собственно фенолы, а также нафтолы, антролы, фенантролы и др. По числу гидроксильных групп различают одно-, двух-, трех-, многоатомные фенолы. Названия фенолов образуют от названий соответствующих аренов с добавлением суффикса –ол. Простейший фенол – гидроксибензол С6Н5ОН называют просто фенол. При наличии нескольких заместителей начало нумерации определяет гидроксильная группа и эти соединения рассматриваются как производные фенола. Иногда в соединениях сложного строения наличие гидроксильной группы обозначают префиксом гидрокси-. Многие фенолы имеют тривиальные названия. 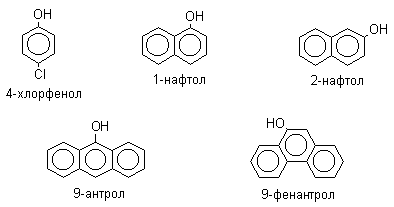 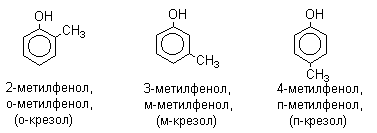 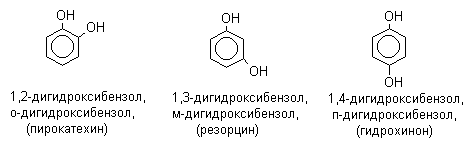 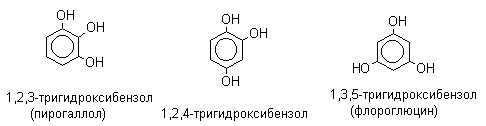 2. Методы получения Фенол выделяют из каменноугольной смолы. Существует многочисленные синтетические методы получения фенола, промышленные и лабораторные. 1) Замещение сульфогруппы на гидроксил Наиболее старый промышленный метод получения фенолов заключается в сплавлении щелочных арилсульфонатов с твердым гидроксидом натрия или калия или со сравнительно легкоплавкой смесью этих гидроксидов при 300-350оС. Хотя точный механизм реакции в расплаве двух ионных соединений неизвестен, ее следует отнести к процессам нуклеофильного ароматического замещения, где гидроксид-ион играет роль нуклеофильного агента, а сульфит-ион - уходящей группы. 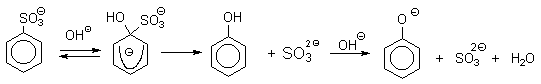 Для получениясамого фенола метод щелочного плавления в настоящее время неиспользуется, но он широко используется для получения 2-нафтола, резорцина, ализарина и других фенолов. 2).Замещение галогена на гидроксил Арилгалогениды, не содержащие активирующих электроноакцепторных заместителей, вступают в реакцию обмена в очень жестких условиях. Фенол получают нагреванием хлорбензола с 15-20%-ным водным раствором гидроксида натрия при 360-390оС и давлении 280-300 атм. C6H5Cl + 2NaOH ® C6H5O-Na+ + NaCl + H2O C6H5O-Na+ + HCl ® C6H5OH + NaCl В этих условиях реакция идет по ариновому механизму (см. лек.№24). В присутствии солей меди (II), играющих роль катализатора, ариновый механизм полностью подавляется из-за резкого ускорения прямого замещения галогена по SNAr-механизму. Применение солей меди (II) позволяет проводить региоселективное замещение галогена на гидроксил без примеси какого-либо другого изомерного фенола. Введение в молекулу арилгалогенида электроноакцепторных заместителей в орто- или пара-положения увеличивают скорость обмена галогена на гидроксил в некатализируемой реакции. Для таких реакций предложен SNAr-механизм замещения. 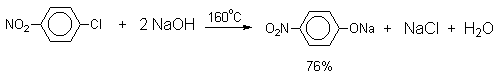 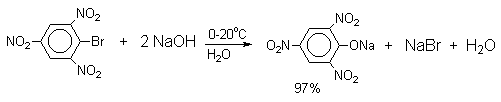 3) Замещение диазогруппы на гидроксил 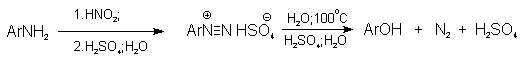 Метод включает диазотирование первичного амина с последующими разложением соли диазония в водном растворе серной кислоты. Замещение диазогруппы на гидроксил протекает по SN1-механизму. Так как промежуточно образующийся арилкатион может реагировать с любым нуклеофилом, имеющимся в реакционной среде, наиболее целесообразно использовать для гидролиза в фенолы гидросульфаты диазония. В качестве побочного продукта при этом образуется эфир ArOSO3H, который легко гидролизуется в фенол. См. также лек. №24 и 43. 4) Получение фенола из гидропероксида кумола Современный промышленный метод получения фенола заключается в кислотно-катализируемом разложении гидропероксида кумола. Исходное вещество для всего цикла превращений - кумол получают алкилированием бензола пропиленом по Фриделю-Крафтсу. 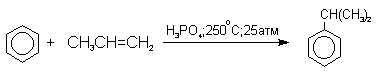 Далее кумол окисляют кислородом воздуха при 100-130оС до гидропероксида кумола. 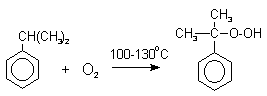 Эта реакция протекает по цепному радикальному механизму с участием кумильного радикала. 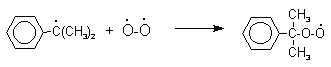 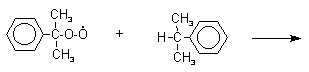 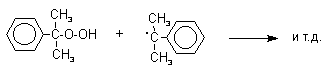 Разложение гидропероксида кумола до фенола и ацетона проводят в присутствии 1% водной серной кислоты при 50-90оС. 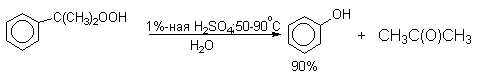 Процесс разложения гидропероксида по своему механизму напоминает перегруппировки карбкатионов. Различие заключается в том, что миграция фенила происходит к положительно заряженному атому кислорода. 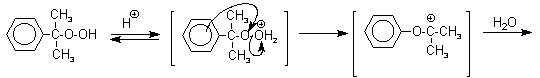 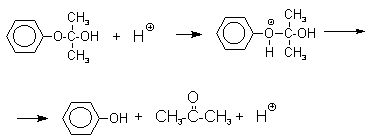 В целом это очень экономичный способ получения одновременно двух важнейших продуктов - ацетона и фенола. 3. Физические свойства и строение Фенолы – жидкие или кристаллические вещества с сильным характерным запахом. При хранении на воздухе быстро темнеют из-за окисления. Ограниченно растворимы в воде. 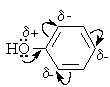 Гидроксигруппа и ароматическое кольцо образуют сопряженную систему. Гидроксигруппа проявляет электронодонорные свойства за счет +М-эффекта, который превышает по силе –I-эффект. Фенол и его гомологи – полярные соединения. Дипольный момент направлен в сторону бензольного кольца. Взаимодействии неподеленной пары электронов кислорода с p -системой кольца обусловливает электронодонорные свойства этих соединений. Энергия ионизации фенола составляет 8,5-8,6 эВ, что ниже, чем у бензола и спиртов. Спектральные характеристики. Введение гидроксильной группы в бензольное кольцо вызывает сдвиг полос поглощения в УФ-спектрах в длинноволновую область и усиливает их: 210 (e 6200) и 270 (e 1450) нм. В ИК-спектрах характеристические полосы поглощения валентных колебаний группы ОН лежат в области 3390-3600 см-1 и зависят от растворителя и концентрации. В спектрах ПМР сигнал протонов группы ОН находится в широком диапазоне и зависит от температуры, концентрации, рН и растворителя (в дейтерохлороформе d 4,5-7,5 м.д.) 4. Химические свойства Для фенолов характерны нуклеофильные свойства, которые усиливаются при превращении их в феноксид-анионы в результате ионизации полярной связи О-Н. При этом электрофилы могут реагировать как по атому кислорода, так и по атомам углерода ароматического кольца фенолов или феноксид-анионов. Кислотные свойства Фенолы являлются слабыми ОН-кислотами, но значительно превосходят по кислотности спирты. Например, фенол в 108 раз более сильная ОН-кислота по сравнению с циклогексанолом. 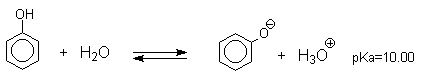 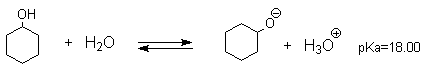 Причина более высокой кислотности фенолов состоит в стабилизации феноксид-аниона за счет делокализации отрицательного заряда с участием ароматического кольца. 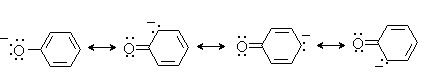 Влияние заместителя в бензольном кольце на кислотность фенолов согласуется с представлениями об их электронных эффектах. Электроноакцепторные заместители, особенно в орто- и пара-положениях, усиливают, а электронодонорные - понижают кислотные свойства фенолов. Величины рКа орто-, мета- и пара-замещенных фенолов в воде при 25оС
Большинство фенолов легко растворяется в водных растворах щелочей МОН с образованием фенолятов ArOM. Получение простых и сложных эфиров фенолов Нуклеофильные свойства атома кислорода фенолов понижены по сравнению со спиртами в результате сопряжения. Как следствие этого ариловые эфиры карбоновых кислот нельзя получать прямой этерификацией фенолов карбоновыми кислотами. Сложные эфиры получают ацилированием фенолов или их Na-и K-солей галогенангидридами или ангидридами кислот. ArOH + RCOX ® RCOOAr + HX ArO-Na+ + RCOX ® RCOOAr + NaX (X=Cl, OCOR) Феноляты легко алкилируются , алкилгалогенидами и диалкилсульфатами с образованием простых эфиров. ArO-Na+ + RX ® ArOR + NaX (X=Hal, ROSO3) Метиловые эфиры фенолов получают также действием диазометана в эфирном растворе. ArOH + CH2N2 ® AROCH3 + N2 В отличие от спиртов фенолы как более сильные кислоты метилируются диазометаном в отсутствие катализатора. Перегруппировка Кляйзена аллилариловых эфиров Аллиловый эфир фенола при нагревании до 200-220оС превращается в орто-аллилфенол, т.е. аллильная группа мигрирует в орто-положение бензольного кольца. 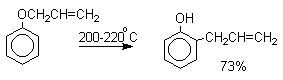 Если оба орто-положения заняты заместителями, то аллильная группа перемещается в пара-положение: 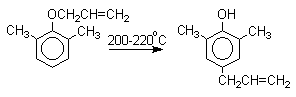 Установлено, что и орто- и пара-перегруппировки являются внутримолекулярными реакциями первого порядка. Миграция в орто-положение сопровождается инверсией аллильной группы, т.е. она присоединяется к бензольному кольцу g -углеродным атомом. 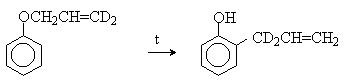 Из этого следует, что переходное состояние перегруппировки Кляйзена должно быть циклическим шестизвенным. Такое переходное состояние включает шесть p -электронов и является ароматическим, что составляет движущую силу этой термической перегруппировки. На последней стадии происходит изомеризация циклогексадиенона в о-аллилфенол. Эта стадия аналогична изомеризации кетона в енольную форму. 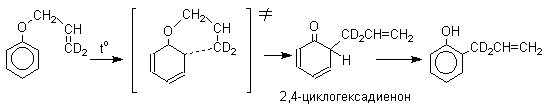 2,4-Циклогексадиенон является интермедиатом перегруппировки аллилариловых эфиров. Такой интермедиат может быть выделен при перегруппировке аллилового эфира 2,6-диметилфенола, когда аллильная группа мигрирует в пара-положение, поскольку енолизация кетона в фенол в этом случае не может происходить из орто-положения. Конечным результатом двух последовательных миграций аллильной группы является сохранение структуры мигрирующей группы. 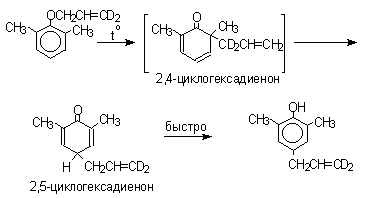 Кроме того, при проведении перегруппировки в присутствии малеинового ангидрида 2,4-циклогексадиенон улавливается в виде аддукта диенового синтеза. Реакции электрофильного замещения в ароматическом кольце Гидроксильная группа относится к числу групп, активирующих электрофильное замещение в ароматическом кольце и направляющих заместитель в орто- и пара-положения. Фенолы вступают практически во все типичные реакции электрофильного замещения как с сильными, так и со слабыми электрофильными агентами. Галогенирование Галогенирование фенолов не требует катализа кислотами Льюиса и легко осуществляется под действием молекулярного галогена. Галогенирование фенола молекулярным бромом или хлором в полярной среде практически невозможно остановить на стадии моногалогенирования, поскольку реагирующей частицей здесь является фенолят-ион, который содержит очень сильную активирующую группу –O-. Скорость галогенирования фенолят-иона по крайней мере в тысячу раз выше, чем фенола. Галогензамещенный фенол является более сильной кислотой, чем сам фенол, что облегчает введение второго и третьего атома галогена в орто- и пара-положения. 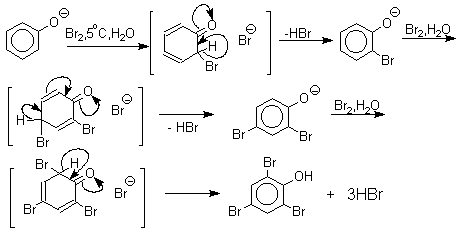 Бромирование фенола в воде приводит к образованию нерастворимого 2,4,6-трибромфенола. Эта реакция настолько чувствительна, что позволяет обнаружить фенол в концентрации 10-5М в водном растворе. 2,4,6-Трибромфенол взаимодействует еще с одним молем брома с образованием 2,4,4,6-тетрабромциклогекса-2,5-диенона, окрашенного в желтый цвет. 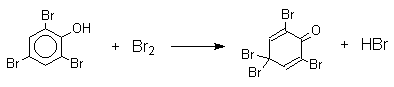 При обработке продукта этой реакции раствором гидросульфита натрия или другого слабого восстановителя он легко превращается в исходный 2,4,6-трибромфенол. При бромировании фенола в растворе бромистоводородной кислоты диссоциация полностью подавляется и галогенированию подвергается сам фенол. При этом в зависимости от условий и количества галогена может быть получен п-бромфенол или 2,4-дибромфенол. 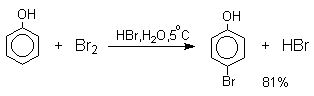 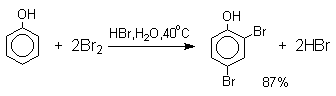 Аналогичным образом протекает хлорирование фенола хлором в соляной кислоте, но здесь получается значительное количество о-хлорфенола. Моногалогензамещенные производные фенолов удобно получать при галогенировании в неполярной среде, что также исключает диссоциацию фенолов. 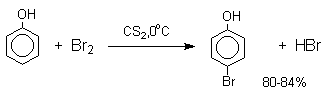 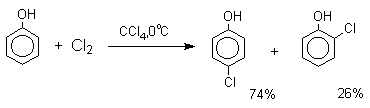 В качестве галогенирующего агента кроме самих галогенов можно использовать комплексы галогенов с диоксаном, ДМФА. 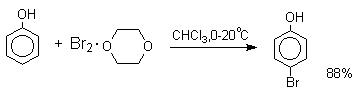 Во всех случаях соотношение пара/орто-изомеров при бромировании и иодировании значительно выше, чем при хлорировании. Нитрование Нитрование фенолов разбавленной 20-25%-ной азотной кислотой приводит к получению смеси орто- и пара-нитрофенолов. 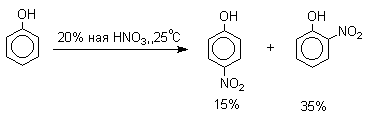 Даже в таких мягких условиях нитрование сопровождается окислением фенола и этот процесс становится доминирующим, если для нитрования использовать концентрированную азотную кислоту. Поэтому для получения 2,4,6-тринитрофенола (пикриновой кислоты) используют видоизмененный способ нитрования. Фенол первоначально сульфируют до 4-гидрокси-1,3-бензолдисульфокислоты, а затем нитруют азотной кислотой. 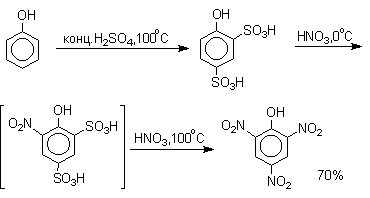 Вторая стадия по существу представляет собой электрофильное ипсо-замещение сульфогруппы на нитрогруппу. Для нитрования фенолов в качестве нитрующего агента кроме азотной кислоты можно использовать ацетилнитрат и N2O4. Эти реагенты способствуют преимущественному нитрованию в орто-положение к гидроксильной группе. 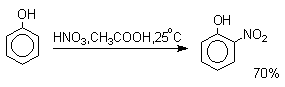 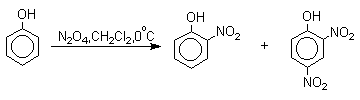 Сульфирование Моносульфирование фенола серной кислотой приводит к образованию смеси орто- и пара-изомеров гидроксибензолсульфоксилоты. При 20оС в реакционной смеси содержится 49% орто-изомера и 51% пара-изомера, тогда как при 120оС доля пара-изомера возрастает до 96%. 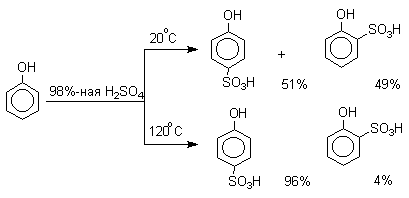 Изменение в соотношении продуктов сульфирования обусловлено обратимостью реакций, когда в равновесии преобладает термодинамически более стабильный пара-изомер. Сульфирование в орто-положение протекает с большей скоростью, но орто-гидроксибензолсульфокислота легко гидролизуется на исходные реагенты в отличие от пара-изомера, для которого скорость гидролиза мала. Нитрозирование Нитрозирование фенолов осуществляется с помощью азотистой кислоты в воде или уксусной кислоте. Эта реакция отличается очень высокой региоселективностью и замещение идет в пара-положение к гидроксильной группе. Типичное распределение орто- и пара-изомеров при нитрозировании можно проиллюстрировать на примере самого фенола. 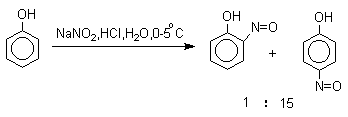 Алкилирование и ацилирование по Фриделю-Крафтсу Так как фенолы взаимодействуют с галогенидами алюминия и другими кислотами Льюиса с образованием солей типа ArOAlCl2, прямое их алкилирование в условиях реакции Фриделя-Крафтса провести не удается. Фенолы алкилируют алкенами и спиртами в условиях кислотного катализа. В качестве катализаторов предпочитают использовать серную, фтористоводородную, фосфорную кислоты или катиониты КУ-2 и другие катионообменные смолы. Таким образом, из крезола и изобутилена в промышленности получают пространственно затрудненный фенол - 2,6-ди-трет-бутил-4-метилфенол (ионол), который широко применяется для стабилизации полимеров. 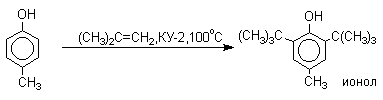 Аналогично из фенола и изопропилового спирта получается 2,4,6-триизопропилфенол. 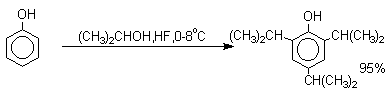 Ацилирование фенолов в классических условиях реакции Фриделя-Крафтса комплексом ацилгалогенида и хлорида алюминия приводит к неудовлетворительным результатам, так как ацилированию подвергается гидроксильная группа фенола. Более эффективна такая модификация этого метода, когда в качестве ацилирующего агента используется комплекс карбоновой кислоты и трехфтористого бора. Ацильная группа при этом вводится практически исключительно в пара-положение бензольного кольца. Так, например, фенол при взаимодействии с комплексом уксусной кислоты и BF3 дает пара-гидроксиацетофенон с 95%-ным выходом. 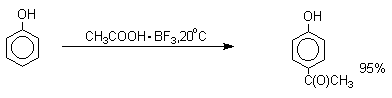 1 2 |
