РК № 2-1. 1 Классификация углеводов
 Скачать 1.85 Mb. Скачать 1.85 Mb.
|
ЖИРНЫЕ КИСЛОТЫЖирные кислоты входят в состав болышинства липидов организма человека. Они могут быть связаны как с глицерином (ТАГ и глицерофосфолипиды), так и с аминоспиртом сфингозином, образуя группу сфинголипидов. Жирные наряду с глюкозой являются важнейшим сом энергии («топливные молекулы»). Кислота называется жирной, если число углеродных атомов в ее молекуле больше четырех. Преобладают длинноцепочечные жирные кислоты (число атомов углерода 16 и выше.Жирные кислоты, входящие в состав организма человека, имеют общие черты строения: 1.Чётное число атомов углерода; 2. Линейная (неразветвлённая) углеродная цепь; 3. Полиненасыщенные жирные кислоты имеют только изолированные двойные связи (между соседними двойными связями не меньше двух одинарных); Двойные связи имеют только цис-конфигурацию.По количеству двойных связей жирные кислоты можно разделить на НАСЫЩЕННЫЕ (нет двойных связей), МОНОНЕНАСЫЩЕННЫЕ (есть одна двойная связь) и ПОЛИНЕНАСЫЩЕННЫЕ (две или более двойных связей).Свободные жирные кислоты встречаются в очень небольшом количестве. В основном они находятся в составе других липидов. При этом они связаны с другими компонентами липидов сложноэфирной связью (эстерифицированы). -18- Липопротеины . 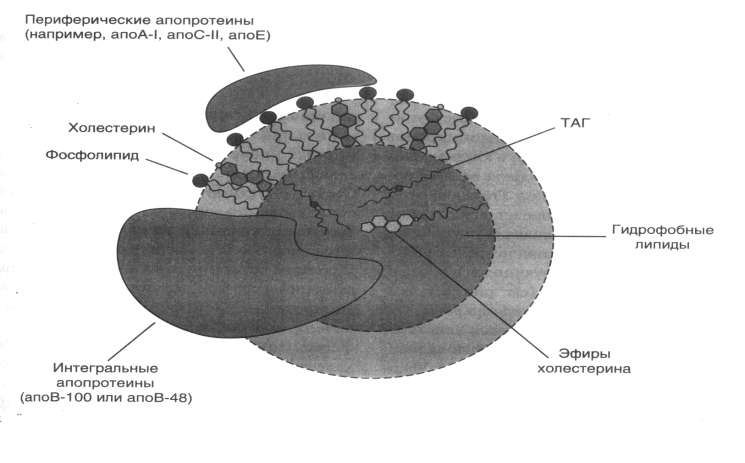 Рисунок 1 Все липопротеины имеют сходное строение: ядро состоит из гидрофобных молекул: ТАГ, эфиров холестерина, а на поверхности находится монослой фосфолипидов, полярные группы которых обращены к воде, а гидрофобные погружены гидрофобное ядро липопротеина. Кроме фосфолипидов, на поверхности находятся белки-апопротеины.Компоненты ядра связаны слабыми типами связей и находятся в состоянии постоянной диффузии – способны перемещаться друг относительно друга. Основная роль липопротеинов – транспорт липидов, поэтому обнаружить их можно в биологических жидкостях.Липопротеины разделяют по плотности методом ультрацентрифугирования, при этом они не осаждаются, а всплывают (флотируют). Мерой всплывания является константа флотации, обозначаемая Sf (сведберг флотации). В соответствии с этим показателем различают следующие группы липопротеинов:  Липопротеины можно разделить и методом электрофореза. При классическом щелочном электрофорезе разные липопротеины ведут себя по-разному. При помещении липопротеинов в электрическое поле хиломикроны остаются на старте. ЛОНП и ЛПП можно обнаружить во фракции пре-глобулинов, ЛНП - во фракции -глобулинов, а ЛВП - -глобулинов:  Липопротеины разделяются соответственно их плотности на четыре основных типа: хиломикроны - ХМ, липопротеины очень низкой плотности - ЛОНП, липопротеины низкой плотности - ЛНП, липопротеины высокой плотности - ЛВП. Существуют также промежуточные формы в метаболизме липопротеинов: хиломикроны остаточные (ХМост), ЛОНП остаточные (или липопротеины средней плотности - ЛСП). -19- Переваривание липидов в ЖКТ Переваривание липидов – это гидролиз жиров под действием фермента панкреатической липазы. У взрослых людей переваривание жира идет только в кишечнике по схеме: «выделение желчи эмульгирование жира действие панкреатической липазы». Для действия этого фермента необходимы следующие условия: значение рН, близкое к нейтральной среде, белок колипаза, синтезируемый в поджелудочной железе и секретируемый вместе с панкреатической липазой. Необходимое значение рН создается в результате нейтрализации кислого содержимого Расщепление липидов происходит в 12-перстной кишке, куда поступают липаза с соком поджелудочной железы и конъюгированные желчные кислоты в составе желчи. Желчь — это вязкая жидкость желто-зеленого цвета, содержащая мицеллы из компонентов, продуцируемых печеночными клетками; она накапливается в желчном пузыре. Важнейшие компоненты желчи: желчные кислоты — 6,2 %; желчные пигменты (продукты распада гема) — 3,2 %; холестерин — 0,5 %; фосфолипиды — 0,5%. Основная функция желчи — участие в переваривании и всасывании липидов. Эту функцию выполняют желчные кислоты, эмульгирующие жиры и таким образом обеспечивающие гидролиз жиров панкреатической липазой. Секреция желчи является также основным путем выведения избытка холестерина из организма. Он выводится как в виде желчных кислот, которые синтезируются в печени из холестерина, так и в свободном виде. Холестерин — гидрофобное вещество, поэтому в растворенном состоянии в виде мицелл желчи его удерживают желчные кислоты. : 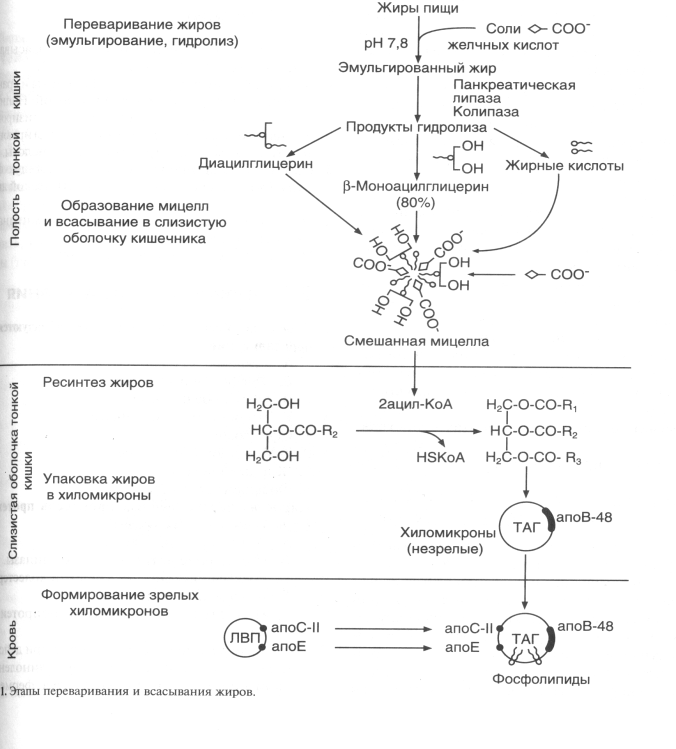 -20- Липогенез Липогенез обр-ся из глицерофасфата,,,А в печени глицерофосфат образуется двумя путями: Путем активации глицерина с помощью глицеринкиназы (глицеролкиназы). 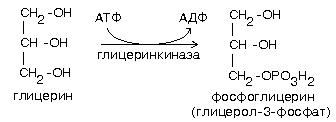 Эта реакция характерна для глицерина, попадающего в печень из крови . 2. Путем восстановления фосфодиоксиацетона, полученного при распаде глюкозы.  Кроме глицерина, для синтеза нейтрального жира необходимы жирные кислоты в активной форме. Активная форма любой жирной кислоты – Ацил-КоА. Образуется при участии фермента ацил-КоА-синтазы. 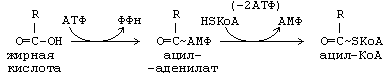 Существует реакция: АТФ + АМФ 2АДФ. Поэтому затраты на активацию молекулы жирной кислоты эквивалентны затрате двух АТФ. Следующим этапом на пути синтеза жира является реакция образования фосфатидной кислоты:  Завершающим реакция в синтезе триацилглицерина. 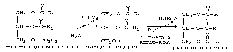 -21- Обмен ЖК.Бета-окисления. Жирные кислоты могут вступать в реакции только после активации. Активация жирных кислот происходит в цитоплазме. Для активной жирной кислоты, как и для глицерина, возможны два пути метаболических превращений: 1. Катаболизм до Ацетил-КоА. Этот процесс называют -ОКИСЛЕНИЕМ ЖИРНЫХ КИСЛОТ. 2. Синтез жира или других липидов. - ОКИСЛЕНИЕ ЖИРНЫХ КИСЛОТ. РЕГУЛЯЦИЯ -ОКИСЛЕНИЯ Жирные кислоты, проникающие из крови в клетку, сначала подвергаются реакции активации под действием фермента ацил-КоА-синтетазы: RCOOH+HSKoA+ATP R-CO-SKoA+AMP+PPi -окисление жирных кислот — это специфический путь распада жирных кислот, заканчивающие образованием ацетил-КоА. -окисление жирных кислот имеет такое название потому, что реакции окисления в радикале жирных кислот происходит по --углеродному атому. -окисление жирных кислот и последующее за ним окисление ацетил-КоА в ЦТК служат источником энергии для синтеза АТР. Процесс -окисления происходит в матриксе митохондрий и только в аэробных условиях, так как связан с ЦПЭ. | Внутренняя мембрана митохондрий непроницаема для ацил-КоА, поэтому существует система переноса жирных кислот через мембрану в комплексе с молекулой карнитина (рис.9) Во внешней мембране митохондрий находится фермент карнитинацилтрансфераза I, который катализирует перенос ацила с КоА на небольшую молекулу карнитина. Затем ацилкарнитин с помощью транслоказы переносится через внутреннюю мембрану митохондрий, где фермент карнитинацил-трансфераза II переносит ацил на внутримитохондрильный HSKoA. -22- Биосинтез ЖК Биосинтез жирных кислот является процессом, в котором повторяются одни и те же последовательности реакций, поэтому процесс называется циклическим, и в каждом цикле радикал жирной кислоты увеличивается на 2 атома углерода, источником которых является малонил-КоА. В каждом цикле происходят реакции восстановлении с использованием NADPH+Н+ одним из источников которого является пентозофосфатный пуп окисления глюкозы, другим — малик-фермент. Другие жирные кислоты в организме человека синтезируются из пальмитиновой кислоты, при эта происходят реакции удлинения углеродного скелета также с использованием малонил-КоА и реакции дегидрирования. В организме человека не синтезируются жирные кислоты с двойными связями, расположенными дистальнее С9-го атома углерода, поэтому человек должен получать незаменимые жирные кислоты с пищей. Синтезированные жирные кислоты не остаются |в свободном виде, а быстро используются для синтеза жиров и в меньшей степени фосфолипидов. Синтез жирной кислоты начинается с переноса ацетильного остатка, а затем малонильного с помощью ферментов ацетилтрансферазы и малонилтранс-феразы на синтазу жирных кислот. Далее карбоксильная группа малонила выделяется в виде СО2 и по освободившейся валентности присоединяется ацетил с образованием ацетоацетил-Е. Последующие реакции восстановления, дегидратации, восстановления приводят к образованию радикала бутирила, связанного с ферментом. Затем повторяется такой же цикл реакций и образуется радикал жирной кислоты с 6 углеродными атомами. Цикла повторяются вплоть до образования радикала пальмитиновой кислоты. Фермент тиоэстераза отщепляет от фермента жирную кислоту (рис.13). 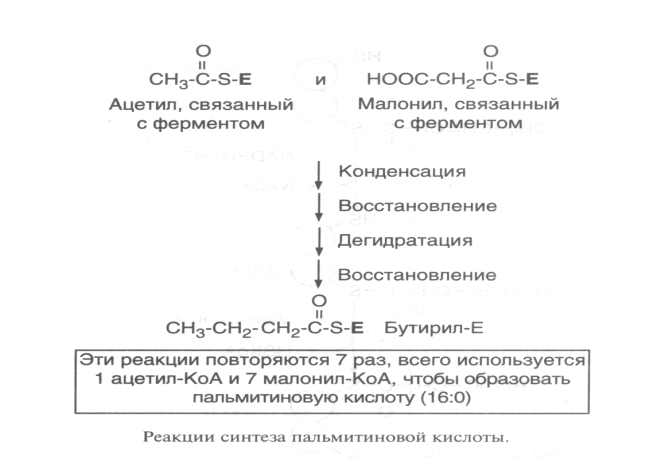 -23- Кетоновая тела Часть жирных кислот в печени перерабатываются в кетоновые тела. В норме их концентрация в крови невелика - 1-3 мг/дл. При ряде состояний синтез их увеличивается. Кетоновые тела – ацетоацетат и -гидроксибутират – служат источниками энергии в тех случаях, когда снижена возможность утилизировать глюкозу (голодание, постабсорбтивный период, при употреблении пищи, богатой жирами, но бедной углеводами, при длительной физической работе, сахарном диабете). Кетоновые тела могут проходить через гематоэнцефалический барьер, так как являются гидрофильными молекулами. Мышцы и почки используют кетоновые тела даже при низкой концентрации в крови. Синтез кетоновых тел происходит в митохондриях печени. Исходный субстрат синтеза – ацетил – КоА образуется в результате -окисления (рис 11). У человека основным кетоновым телом является -гидроксибутират, так как высокая концентрация NADH в митохондриях способствует быстрому восстановлению ацетоацетата. При длительном голодании и сахарном диабете в крови существенно возрастает концентрациям ацетоацетата 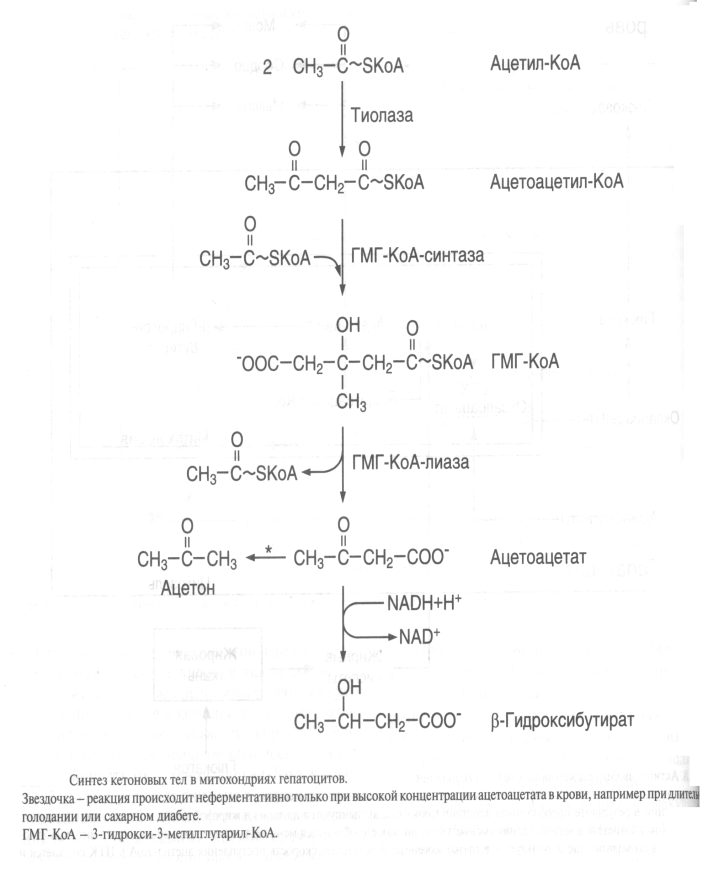 -24- Холестерин Холестерин — предшественник всех остальных стероидов в организме: кортикостероидов, андрогенов, эстроенов, желчных кислот, витамина Д. На синтез этих веществ ежесуточно тратиться 0.5 – 0.7 г холестерина. С фекалиями за сутки удаляется около 1.3 г холестерина в виде желчных кислот и холестерина, входящих в мицеллы желчи. Из пищи усваивается холестерин, поступающий только с продуктами животного происхождения. В желудочно-кишечном тракте человека -ситостерол - стероид, широко распространенный в растениях, практически не всасывается. Эфиры холестерина, поступающие в организм с пищей, гидролизуются холестеролэстеразой панкреатического или кишечного сока. Продукты гидролиза всасываются эпителием кишечника в виде смешанных мицелл. Экзогенный или синтезированный клетками кишечника холестерин частично превращается в эфиры. Этот процесс включает две стадии: 1. активацию жирной кислоты под действием ацил-КоА-синтетазы; 2. перенос ацильного остатка ацил-КоА на НО-группу холестерина, который катализирует ацилхолестеролацилтрансфераза (АХАТ). 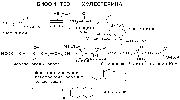 В кровотоке хиломикроны контактируют с ЛВП и получают от них белки: апоС-П и апоЕ. В обратном направлении из хиломикронов в ЛВП поступают апоА-1 и апоА-II. В результате этого обмена хиломикроны превращаются в зрелые частицы, способные связываться с липопротеинлипазой. Входящие в состав хиломикронов ТАГ расщепляются под действием липопротеинли-к, прикрепленной к стенкам капилляров, и из хиломикронов образуются остаточные хиломикроны. В кровотоке хиломикроны контактируют с ЛВП и получают от них белки: апоС-П и апоЕ. В обратном направлении из хиломикронов в ЛВП поступают апоА-1 и апоА-II. В результате этого обмена хиломикроны превращаются в зрелые частицы, способные связываться с липопротеинлипазой. Входящие в состав хиломикронов ТАГ расщепляются под действием липопротеинли-к, прикрепленной к стенкам капилляров, и из хиломикронов образуются остаточные хиломикроны.-25- Желчнокаменное болезнь Факторы, способствующие образованию желчных камней: инфекции. Ферменты микроорганизмов превращают конъюгированные желчные кислоты, обладающие большей поверхностной активностью, в неконъюгированные, активность которых ниже; следовательно, они хуже эмульгируют холестерин; снижение концентрации желчных кислот в желчном пузыре в результате снижения скорости их синтеза; в нарушение энтерогепатической циркуляции желчных кислот, например, в результате заболеваний кишечника. Обычно желчные камни состоят из смеси холестерина, желчных пигментов и кальция с примесями других веществ; они имеют темно-коричневую окраску. Чисто холестериновые камни встречаются реже и имеют форму тутовых ягод. Перемещение камней из желчного пузыря через желчный проток в кишечник проявляется «печеночной коликой» — сильной болью в правом подреберье в результате спастического сокращения гладких мышц. Если камень нарушает отток желчи из желчного пузыря, то развивается механическая желтуха. -26- Лептин адреналин и инсулин Все гормоны, влияющие на мобилизацию жира, можно разделить на 2 группы Гормоны прямого действия (адреналин, глюкагон, соматотропный гормон гипофиза, инсулин). Гормоны косвенного действия (глюкокортикостероиды, половые гормоны, лептин). ЛЕПТИН (от лат. Leptos – тонкий, худой). По химической природе – полипептид, синтезируется в адипоцитах. Лептин – гормон жировой ткани (поэтому жировую ткань можно отнести к эндокринным). Рецепторы к лептину расположены в гипоталамусе и в тканях репродуктивной системы. Лептин снижает выработку нейропептида Y, который вызывает повышение аппетита и усиливает синтез жира (точные механизмы воздействия пока неясны).Лептин также стимулирует выработку разобщающих белков бурого жира. Суммарный эффект лептина: снижение аппетита и усиление липолиза. Концентрация лептина в крови пропорциональна количеству жировых клеток. Поэтому, можно считать, что лептин передает в головной мозг информацию о количестве жира в организме. Лептин также усиливает репродуктивную функцию человека. В настоящее время ведутся работы над созданием рекомбинантного лептина для лечения ожирения. Мембраны адипоцитов содержат адренорецепторы двух типов ( и ). Взаимодействие адреналина с рецепторами обоих типов вызывает изменение концентрации цАМФ. Однако, это влияние разнонаправленное. -адренорецептор связан с ингибирующим G-белком (Gi), свызывающим понижение активности аденилатциклазы. Это приводит к уменьшению концентрации цАМФ, и, в конечном счете, торможению липолиза. -адренорецептор связан со стимулирующим G-белком (Gs) – эффектом будет стимуляция липолиза. Секреция адреналина увеличивается при физической работе, глюкагона – при голодании. Действие ИНСУЛИНА связано с повышением активности внутриклеточной фосфодиэстеразы, что приводит к снижению концентрации цАМФ и угнетению липолиза. Таким образом, инсулин усиливает синтез жира и уменьшает скорость его мобилизации. -27- Атеросклероз Наиболее частым нарушением липидного обмена является атеросклероз. Атеросклероз представляет собой патологическое утолщение внутренней, частично и средней оболочки артерий за счет формирования склерозированных бляшек, заполненных эфирами холестерина. В состав бляшек входят, кроме ЭХС, ТАГ, гликозаминогликаны, коллаген, эластин, кальций, макрофаги, погибшие клетки. В атеросклеротических бляшках с большой частотой обнаруживается ДНК герпесвирусов (цитомегаловируса и простого герпеса), а также хламидии. Роль этих микроорганизмов остается пока невыясненной. При разрыве фиброзной капсулы под действием механических и токсических факторов обнажается холестериновая кашица и такая «злокачественная» бляшка становится центром агрегации тромбоцитов, отложения сгустков фибрина и тромбообразования. Клиническими проявлениями атеросклероза являются различные широко распространенные сосудистые заболевания разных органов: сердца, аорты, головного мозга, почек, нижних конечностей. Атеросклеротическая бляшка затрудняет кровоток и вызывает ишемию и гипоксию органа, а при полной закупорке сосуда бляшкой или индуцированным ею тромбом возникают инфаркт миокарда, инсульт, гангрена конечностей. Повышение концентрации холестерина в крови является основным патогенетическим фактором в развитии атеросклероза, следствием которого может быть ишемическая болезнь сердца, инфаркт миокарда, инсульт, облитерация артерий конечностей и т.п. В развитии атеросклероза играет роль не только общее увеличение содержания холестерина в крови, но и изменение соотношения ЛНП и ЛВП. Развитие атеросклероза вызывает не простое увеличение фракции ЛНП, а повышение содержания в этой фракции множественно модифицированных ЛНП (ммЛНП). У этих частиц обнаруживаются нарушения в структуре белковых, углеводных и липидных компонентов, вызванные отщеплением концевой сиаловой кислоты от оли-госахаридных цепей (десиалированием) гликопротеинов, гликозилированием белковой части, перекисным окислением жирных кислот, частичным протеолизом и другими изменениями. -28- Жировой гепатоз Гепатоз жировой (жировая дистрофия печени) — хроническое заболевание печени, при котором происходит перерождение функциональных клеток печени (гепатоцитов) в жировую ткань. Вначале, это происходит безболезненно, без каких-либо неприятных симптомов, поэтому, врачи не бьют тревогу. Обычно, они назначают, что-нибудь типа эссенциале форте, или фосфоглиф и т. п. Толку от этого мало,— ниже вы поймете почему — и процесс развивается дальше. Но через некоторое время ситуация начинает развиваться лавинообразно: возникают проблемы с другими органами и системами организма, работа которых зависит от печени. Это бумерангом, опять же, бьет по печени: она хуже снабжается кровью, в нее больше поступает токсинов из кишечника и т. д. Основные симптомы жирового гепатоза: тошнота, тупые ноющие боли или тяжесть в правом подреберье и эпигастрии (под ложечкой), явления метеоризма.Но, если ничего не предпринимать, то развивается цирроз печени с нарушениями ее многих ее функций. Это вызывает целый ряд серьезных заболеваний. Нередко перерождение клеток переходит в онкологическую фазу, но летальный исход может наступить и раньше. Обратите внимание на стадии изменения печени при жировом гепатозе. Очень важно не допустить последней, когда еще есть возможность повернуть процесс вспять. -29- |
