РК № 2-1. 1 Классификация углеводов
 Скачать 1.85 Mb. Скачать 1.85 Mb.
|
|
Гиперхолестеринемия, причины ее возникновения. Внутрисосудистый липолиз У сравнительно небольшого числа людей обнаруживаются наследственные дефекты в метаболизме липопротеинов, приводящие к развитию дислипопротеинемий. Одним из наиболее серьезных видов патологии такого типа является семейная ги-перхолестеринемия, вызванная мутациями в ЛНП-рецепторе. Описано более 300 мутаций в структуре этого гена. Особенно тяжелые последствия вызывают крупные делеции в разных участках гена, нарушающие синтез и созревание белка рецептора и сопровождающиеся нарушением катаболизма ЛНП. Степень риска развития раннего атеросклероза у таких индивидуумов возрастает в 10—20 раз по сравнению со здоровыми лицами. Сходное течение болезни наблюдается у пациентов, имеющих мутантный белок апоВ-100 (табл. 2). Однако при множестве приобретенных заболеваний — сахарном диабете, гипотиреоидизме, болезнях почек — наблюдаются аномалии в составе липопротеинов, близкие к тем, что отмечаются при наследственной патологии. -30- Определение липопротеинового спектра плазмы крови применяется в медицине для диагностики атеросклероза. Все эти липопротеины отличаются по своей функции. 1. Хиломикроны (ХМ) - образуются в клетках кишечника, их функция: перенос экзогенного жира из кишечника в ткани (в основном - в жировую ткань), а также - транспорт экзогенного холестерина из кишечника в печень. 2. Липопротеины Очень Низкой Плотности (ЛОНП) - образуются в печени, их роль: транспорт эндогенного жира, синтезированного в печени из углеводов, в жировую ткань. 3. Липопротеины Низкой Плотности (ЛНП) - образуются в кровеносном русле из ЛОНП через стадию образования Липопротеинов Промежуточной Плотности (ЛПП). Их роль: транспорт эндогенного холестерина в ткани. 4. Липопротеины Высокой Плотности (ЛВП) - образуются в печени, основная роль - транспорт холестерина из тканей в печень, то есть удаление холестерина из тканей, а дальше холестерин выводится с желчью. Транспорт липопротеинов представлен на рисунке 2. Аполипопротеины - это белковая часть липопротеинов (апобелок). В состав липопротеина может входить один или несколько апобелков. Некоторые апобелки являются интегральной частью липопротеина, а другие могут перемещаться с одного липопротеина на другой. Апобелки обозначают буквами: А, В, С, Е. -31- Значения аминокислот Значение аминокислот для организма определяется прежде всего тем, что они используются для синтеза белков и пептидов. Кроме того, из аминокислот образуется большое количество веществ непептидной природы, выполняющих специальные функции. К ним относятся нуклеотиды, холин, таурин, амины, гем, тироксин и много других. Катаболизм аминокислот может служить источником энергии для синтеза АТФ. При обычном питании энергетическая роль аминокислот невелика, однако может быть существенной при преимущественно белковом питании, а также при голодании; в последнем случае используются аминокислоты, образующиеся при распаде собственных белков.Фонд свободных аминокислот организма составляет около 30 г. Содержание аминокислот в крови равно 35-65 мг/дл. Подавляющая часть аминокислот организма входит в состав белков: в организме взрослого человека содержится около 15 кг белков. Источниками свободных аминокислот организма служат пищевые белки, белки собственных тканей, а также синтез аминокислот из углеводов. В организме человека ежесуточно распадается на аминокислоты около 400 г белков. Однако столько же белков и синтезируется за сутки. Следовательно, тканевые белки не могут восполнять необратимые затраты аминокислот, которые происходят при их катаболизме или использовании для синтеза веществ неаминокислотной природы. -32- При переваривании происходит гидролиз пищевых белков до свободных аминокислот. Процесс переваривания начинается в желудке и продолжается в тонкой кишке под действием протеолитических ферментов, которые называются протеиназами или пептидазами. Существует много разных протеиназ. Они имеются не только в желудочно-кишечном тракте, но и в клетках. 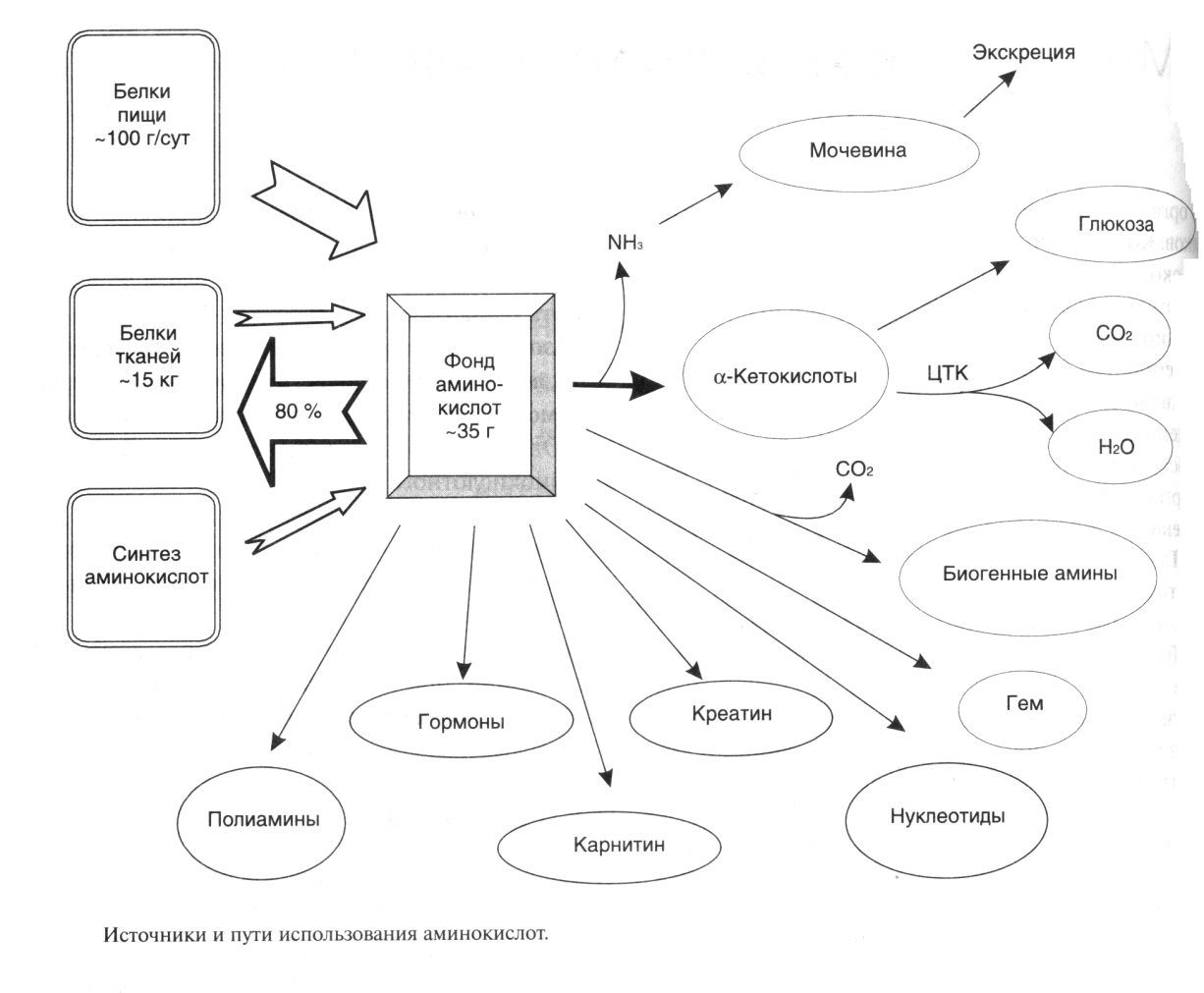 Пепсин Это фермент желудочного сока. Синтезируется в клетках слизистой оболочки желудка в форме неактивного предшественника - пепсиногена. Превращение неактивного пепсиногена в активный пепсин происходит в полости желудка. При активации отщепляется пептид, закрывающий активный центр фермента. Активация пепсина происходит под действием двух факторов: а) соляной кислоты (HCl); б) уже образовавшегося активного пепсина - это называется аутокатализомРеннинВ желудочном соке грудных детей переваривание белков осуществляет фермент РЕННИН, который расщепляет белок молока казеин. Реннин похож по строению на пепсин, но его рН-оптимум соответствует рН среды желудка грудного ребенка (рН=4.5). Реннин отличается от пепсина также механизмом и специфичностью действия. -33- перевариваниие амк в кишечнике-эндогенные и экзогенные пептидазы- особенности активации и механизм действия Каждые сутки в организм человека всасывается примерно 100 граммов аминокислот, которые поступают в кровь. Еще 400 граммов аминокислот поступает ежесуточно в кровь в результате распада собственных белков тела. Все эти 500 г аминокислот представляют собой метаболический пул аминокислот. При переваривании происходит гидролиз пищевых белков до свободных аминокислот. Процесс переваривания начинается в желудке и продолжается в тонкой кишке под действием протеолитических ферментов, которые называются протеиназами или пептидазами. Существует много разных протеиназ. Они имеются не только в желудочно-кишечном тракте, но и в клетках Ферменты, участвующие в переваривании белков, обладают относительной субстратной специфичностью, которая обусловлена тем, что пептидазы быстрее гидролизуют пептидные связи между определенными аминокислотами, что позволяет за более короткое время расщепить белковую молекулу. В толстом отделе кишечника не всосавшиеся по каким-либо причинам (недостаток или низкая активность протеолитических фрементов, нарушение процессов транспорта аминокислот) пептиды и аминокислот подвергаются процессам гниения. При этом образуются такие продукты как: фенол, крезол, сероводород, меркаптоэтанол, индол, скатол, а также группа соединений под общим названием «трупные яды» - кадаверин и путресцин. Эти вещества всасываются в кровь и поступают в печень, где подвергаются конъюгации с глюкуроновой кислотой и другим процессам обезвреживания. Затем они выводятся из организма с мочой. -34- МЕХАНИЗМЫ, ЗАЩИты от действия протеаз(4способа) 1. Защита типа "клетки" - пространственная изоляция протеиназ от тех белков, на которые они могут подействовать. Внутриклеточные протеиназы сосредоточены внутри лизосом и отделены от белков, которые они могут гидролизовать. 2. Защита типа "намордника". Заключается в том, что протеиназы вырабатываются в виде неактивных предшественников (проферментов): например, пепсиноген (в желудке) трипсиноген и химотрипсиноген (в pancreas) Во всех этих предшественниках активный центр фермента прикрыт фрагментом полипептидной цепи. После гидролиза определенной связи эта цепочка отрывается и фермент становится активным. 3. Защита типа “кольчуги“. Защита белка-субстрата путем включения в его молекулу каких-либо химических структур (защитные группы, прикрывающие пептидные связи). Протекает следующими способами: а) Гликозилирование белка. б) Ацетилирование аминогрупп. Присоединение остатков уксусной кислоты к свободным аминогруппам в молекуле белка. в) Амидирование карбоксильной группы. Защитный эффект аналогичен. г) Фосфорилирование радикалов серина или тирозина 4. Защита типа “сторожа“. Это защита белков с помощью эндогенных ингибиторов протеиназ. -35- ТРАНСАМИНИРОВАНИЕ, Эта реакция заключается в том, что аминокислота и кетокислота обмениваются друг с другом своими функциональными группами при альфа-углеродном атоме. В результате вступившая в реакцию аминокислота превращается в соответствующую альфа-кетокислоту, а кетокислота становится аминокислотой. Эту реакцию катализируют ферменты под названием ТРАНСАМИНАЗЫ (АМИНОТРАНСФЕРАЗЫ). Коферментом всех трансаминаз является активная форма витамина В6 - пиридоксальфосфат (фосфопиридоксаль). ГЛАВНЫЕ ОСОБЕННОСТИ РЕАКЦИИ ТРАНСАМИНИРОВАНИЯ: 1. Это циклический процесс, все стадии которого катализируются одним и тем же ферментом - трансаминазой данной пары кислот-2. Все стадии этого процесса обратимы. 3. Каждая трансаминаза обычно специфична для одной пары субстратов и соответствующей ей пары продуктов и все стадии реакции катализируются только одним ферментом. Фермент, который катализирует приведенную реакцию, можно назвать: Аланинаминотрансфераза (АлТ) (глутаминово-пировиноградная трансаминаза (ГПТ)). АсТ и АлТ являются внутриклеточными ферментами. Поэтому в норме их активность в крови очень мала. При вирусном гепатите или при инфаркте миокарда наблюдается разрушение клеток печени или миокарда соответственно. Поэтому в крови будет наблюдаться повышение активности и АлТ, и АсТ, но неодинаковое для каждого из ферментов. В клетках сердечной мышцы (миокарда) содержится гораздо больше АсТ, чем АлТ, а в клетках печени - наоборот: АлТ намного больше, чем АсТ. Поэтому ПРИ ИНФАРКТЕ МИОКАРДА АКТИВНОСТЬ АСТ в крови БУДЕТ ЗНАЧИТЕЛЬНО ВЫШЕ, ЧЕМ АЛТ, А ПРИ ВИРУСНОМ ГЕПАТИТЕ АКТИВНОСТЬ АЛТ БУДЕТ ВЫШЕ, ЧЕМ АСТ. Поэтому определение активности этих ферментов в крови помогает врачам в постановке правильного диагноза. БИОЛОГИЧЕСКАЯ РОЛЬ РЕАКЦИЙ ТРАНСАМИНИРОВАНИЯ. 1. ОБЕСПЕЧИВАЮТ СИНТЕЗ НОВЫХ АМИНОКИСЛОТ ИЗ ЧИСЛА ЗАМЕНИМЫХ. Из заменимых аминокислот также могут образоваться необходимые клетке кетокислоты. 2. ОБЕСПЕЧИВАЮТ ПРОТЕКАНИЕ РЕАКЦИЙ КОСВЕННОГО ДЕЗАМИНИРОВАНИЯ. 3. ОБЕСПЕЧИВАЮТ СИНТЕЗ МОЧЕВИНЫ -36- ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ У человека происходит в основном путем окислительного дезаминирования. Эти реакции протекают с помощью двух ферментов: - оксидаза Д-аминокислот - оксидаза L-аминокислот 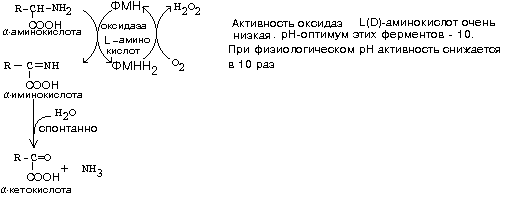 На первой стадии образуется иминокислота, а затем, после спонтанного гидролиза образуется альфа-кетокислота. Кроме оксидаз имеется еще один фермент, катализирующий окислительное дезаминирование глутаминовой кислоты - глутамат-дегидрогеназа (глутаматДГ). 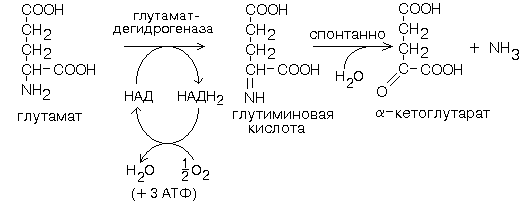 Глутамат-ДГ обладает высокой активностью и этим отличается от МАО и ДАО. Глутамат-ДГ является регуляторным ферментом - он ингибируется избытком АТФ, и активируется избытком АДФ. БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ РЕАКЦИЙ ДЕЗАМИНИРОВАНИЯ 1. Реакции дезаминирования необратимы, как и реакции декарбоксилирования - дезаминирование тоже может играть роль первого этапа на путях распада аминокислот. 2. Один из непосредственных продуктов дезаминирования -конечный продукт метаболизма аммиак. Это токсическое вещество. Поэтому клетки должны затрачивать энергию, чтобы обезвредить аммиак до безвредных продуктов, которые выводятся из организма. 3. Другой продукт реакции дезаминирования - альфа-кетокислота. -37- ДЕКАРБОКСИЛИРОВАНИЕ В организме человека происходит только окислительное декарбоксилирование. Ферменты - декарбоксилазы. Их простетическая группа представлена пиридоксальфосфатом - это активная форма витамина В6. Продукты реакции – биогенные амины и углекислый газ. БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ РЕАКЦИЙ ДЕКАРБОКСИЛИРОВАНИЯ АМИНОКИСЛОТ 1. Реакции необратимы - приводят к необратимому распаду аминокислот. 2. Образуется значительное количество СО2 - конечного продукта метаболизма, который выводится из организма. 3. Образуются амины, которые обладают высокой биологической активностью. 1. Глутаматдекарбоксилаза - высокоспецифичный фермент. Работает в клетках серого вещества головного мозга. Катализирует реакцию превращения глутаминовой кислоты в гамма-аминомасляную кислоту (ГАМК). ГАМК является медиатором тормозных импульсов в нервной системе. ГАМК и ее аналоги применяются в медицине как нейротропные средства для лечения эпилепсии и других заболеваний. 2. Орнитиндекарбоксилаза - высокоспецифичный фермент. Катализирует превращение орнитина в путресцин: 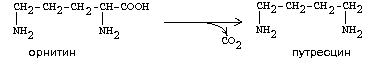 3. Гистидиндекарбоксилаза Этот фермент имеет абсолютную субстратную специфичность - превращает гистидин в гистамин: -38- ИНАКТИВАЦИЯ БИОГЕННЫХ АМИНОВ В организме имеются механизмы, позволяющие разрушать биогенные амины. 1. Метилирование по оксигруппам тех аминов, которые такие группы содержат, либо включают оксигруппы в свою молекулу после гидроксилирования. Источник метильного радикала: S-Аденозилметионин 2. Окисление амина по аминогруппе с целью дезаминирования.  Оксидазы биогенных аминов: моноаминооксидаза (МАО), диаминооксидаза (ДАО), полиаминооксидаза. Оксидазы отнимают два протона и два электрона и передают их сразу на кислород. Образуется перекись водорода, а амин превращается в ИМИН. Этот имин легко гидролизуется без участия фермента и превращается в альдегид. Простетической группой ферментов оксидаз является ФАД или ФМН, т.е. они являются флавопротеинами.Вторая реакция (гидролиз) необратима. Образовавшийся в итоге альдегид легко окисляется до карбоновой кислоты, которая распадается до СО2 и H2O. МАО в клетке больше, чем ДАО.Угнетение МАО приволит к замедлению распада биогенных аминов. Такие лекарства продлевают период существования биогенных аминов, что особенно важно при их недостатке. Эти вещества играют роль антидепрессантов и используются, в частности, при лечении шизофрении.Аминокислоты декарбоксилируются в цитоплазме, а окисление аминов происходит в наружной мембране митохондрий. -39-  Орнитиновый цикл в печени выполняет 2 функции: Орнитиновый цикл в печени выполняет 2 функции:• превращение азота аминокислот в мочевину, которая экскретируется и предотвращает накопление токсичных продуктов, главным образом аммиака; • синтез аргинина и пополнение его фонда в организме. В орнитиновом цикле расходуются 4 макроэргические связи 3 молекул АТР на каждый оборот цикла. Однако процесс превращения аминокислот в безазотистые остатки и мочевину обеспечивает сам себя энергией: - при регенерации аспартата из фумарата на стадии дегидрирования малата образуется NADH, который может обеспечить синтез 3 макроэргических связей (рис.7); - при окислительном дезаминироваиии глутамата в разных органах также образуется NADH, который может обеспечить образование 3 макроэргичес-ких связей. -40- Обмен фенилаланина и Тиразина. Фенилаланин является незаменимой аминокислотой, а тирозин - заменимая аминокислота.Фенилаланин вступает в незначительное количество превращений в тканях. Кроме включения этой аминокислоты в структуру молекул белка, единственным путем метаболизма фенилаланина у здорового человека является его окисление в тирозин с участием фермента микросомального окисления, специфической монооксигеназой - фенилаланингидроксилазой:  -41- Обмен Глицина и Серина. Это заменимые аинокислоты, которые превращаются друг в друга. Основным путем распада глицина является его распад на СО2, Н2О и метилен-ТГФК (активный С1): Из метилен-ТГФК могут образовываться все другие формы активного С1: формил-ТГФК, метил-ТГФК, метен-ТГФК, оксиметил-ТГФК в результате реакций окисления или восстановления метилен-ТГФК.Активный С1, образовавшийся из глицина участвует в синтезе пуриновых азотистых оснований. Кроме того, глицин всей своей молекулой участвует в синтезе гема гемоглобина и других гемопротеинов, в синтезе пуриновых азотистых оснований, в синтезе парных желчных кислот (гликохолевая кислота), в синтезе креатина, в синтезе трипептида глютатиона. Также глицин в печени участвует в обезвреживании бензойной кислоты, которая превращается в гиппуровую кислоту:  -42- Обмен метионина и цистеина. Метионин - это незаменимая аминокислота, а цистеин - заменимая.  Главной особенностью обмена метионина является то, что из него тоже образуется активный С1 в виде СН3-группы, которая участвует в различных синтезах. Однако, этот активный С1 образуется без участия ТГФК. Чтобы стать источником СН3- группы, метионин подвергается активации с участием АТФ. В результате этой реакции от АТФ отщепляются все три остатка фосфорной кислоты, а аденозин присоединяется к атому серы метионина. Так образуется активная форма метионина - S- аденозил-метионинОБМЕН ЦИСТЕИНА. Это заменимая аминокислота, она синтезируется из серина, гидроксильная группа которого замещается SН-группой, которую поставляет гомоцистеин. Цистеин в составе белков-ферментов своей -SН группой участвует в образовании каталитического центра (тиоловые протеазы), а также участвует в образовании дисульфидных связей, которые принимают участие в формировании третичной и четвертичной структуры белков. Также цистеин необходим для синтеза -43-  Печень является основным местом образования пуриновых нуклеотидов. Она снабжает пуринами ткани, не способные к их синтезу: эритроциты, полиморфно-ядерные лейкоциты и частично мозг.Катаболизм пуриновых нуклеотидов приводит к образованию мочевой кислоты. Мононуклеотиды теряют фосфатный остаток гидролитически под действием фосфатаз или нуклеотидаз с образованием нуклеозидов. -44- :  Синтез пиримидиновых оснований происходит во всех клетках организма. В реакциях синтеза участвует аспарагиновая кислота, глутамин, СО2, затрачивается 2 молекулы АТФ. В отличие от разветвленного синтеза пуринов этот синтез происходит линейно, т.е. пиримидиновые нуклеотиды образуются последовательно, друг за другом -45- Катаболизм пуриновых оснований  Мочевая кислота является одним из нормальных компонентов мочи. За сутки в организме образуется около 1 г мочевой кислоты. Мочевая кислота выводится из организма с мочой - это обычный ее компонент, но в почках организма человека происходит ее интенсивная реабсорбция. Концентрация мочевой кислоты в крови поддерживается на постоянном уровне 0,12-0,30 ммоль/л.В организме мочевая кислота существует, как правило, в лактимной форме. -46- Катаболизм пиримидиновых оснований  1 - дигидропиримидиндегидрогеназа; 2 - дигидропиримидинциклогидролаза; 3 - уреидопропионаза.Биол знач: аланин обычно разрушается до CO2, H2O и NH3, но иногда может использоваться для синтеза пептидов карнозина и ансерина в мышечной ткани. аминоизобутират выводится из организма и определение его количества в моче может использоваться для оценки катаболизма ДНК. |
