1. Медицинская микробиология. Предмет, задачи, методы, связь с другими науками. Значение медицинской микробиологии в практической деятельности врача
 Скачать 0.96 Mb. Скачать 0.96 Mb.
|
|
Токсическое действие препаратов. Как правило, развитие этого осложнения зависит от свойств самого препарата, его до зы, способа введения, состояния больного и проявляется только при длительном и систе матическом применении антимикробных химиотерапевтических препаратов, когда созда ются условия для их накопления в организме. Особенно часто такие осложнения бывают, когда мишенью действия препарата являются процессы или структуры, близкие по составу или строению к аналогичным структурам кле ток макроорганизма. Токсическому действию антимикробных препаратов особенно подвер жены дети, беременные, а также пациенты с нарушением функций печени, почек. Побочное токсическое влияние может прояв ляться как нейротоксическое (например, гликопептиды и аминогликозиды оказывают ототоксическое действие, вплоть до полной потери слуха за счет воздействия на слуховой нерв); нефротоксическое (полиены, полипептиды, аминогликозиды, макролиды, гликопептиды, сульфаниламиды); общетоксическое (противо грибковые препараты — полиены, имидазолы); угнетение кроветворения (тетрациклины, суль фаниламиды, левомицетин/хлорамфеникол, который содержит нитробензен — супрессор функции костного мозга); тератогенное [ами ногликозиды, тетрациклины нарушают развитие костей, хрящей у плода и детей, формирова ние зубной эмали (коричневая окраска зубов), левомицетин/хлорамфеникол токсичен для но ворожденных, у которых ферменты печени не полностью сформированы («синдром серого ребенка»), хинолоны — действуют на развива ющуюся хрящевую и соединительную ткани]. Предупреждение осложнений состоит в от казе от противопоказанных данному пациенту препаратов, контроле за состоянием функций печени, почек и т. п. Дисбиоз (дисбактериоз). Антимикробные химиопрепараты, особен но широкого спектра, могут воздействовать не только на возбудителей инфекций, но и на чувствительные микроорганизмы нормаль ной микрофлоры. В результате формируется дисбиоз, поэтому нарушаются функции ЖКТ, возникает авитаминоз и может развиться вто ричная инфекция (в том числе эндогенная, например кандидоз, псевдомембранозный ко лит). Предупреждение последствий такого рода осложнений состоит в назначении, по возможности, препаратов узкого спектра действия, сочетании лечения основного заболевания с противогрибковой терапией (например, назначением нистатина), витаминотерапей, применением эубиотиков и т. п. Отрицательное воздействие на иммунную систему. К этой группе осложнений отно сят прежде всего аллергические реакции. Причинами развития гиперчувствительности может быть сам препарат, продукты его распа да, а также комплекс препарата с сывороточ ными белками. Возникновение такого рода осложнений зависит от свойств самого пре парата, от способа и кратности его введения, индивидуальной чувствительности пациента к препарату. Аллергические реакции разви ваются примерно в 10 % случаев и проявля ются в виде сыпи, зуда, крапивницы, отека Квинке. Относительно редко встречается та кая тяжелая форма проявления аллергии, как анафилактический шок. Такое осложнение чаще дают бета-лактамы (пенициллины), рифамицины. Сульфаниламиды могут вызвать гиперчувствительность замедленного типа. Предупреждение осложнений состоит в тща тельном сборе аллергоанамнеза и назначении препаратов в соответствии с индивидуальной чувствительностью пациента. Кроме того, антибиотики обладают некоторым иммунодепрессивным действием и могут способство вать развитию вторичного иммунодефицита и ослаблению напряженности иммунитета. Эндотоксический шок (терапевтический). Это явление, которое возникает при лече нии инфекций, вызванных грамотрицательными бактериями. Введение антибиотиков вызывает гибель и разрушение клеток и вы свобождение больших количеств эндотокси на. Это закономерное явление, которое со провождается временным ухудшением кли нического состояния больного. Взаимодействие с другими препаратами. Антибиотики могут способствовать потен цированию действия или инактивации других препаратов (например, эритромицин стиму лирует выработку ферментов печени, которые начинают ускоренно метаболизировать ле карственные средства разного назначения). Побочное воздействие на микроорганизмы. Применение антимикробных химиопрепа-ратов оказывает на микробы не только прямое угнетающее или губительное воздействие, но также может привести к формированию ати пичных форм микробов (например, к обра зованию L-форм бактерий или изменению других свойств микробов, что значительно затрудняет диагностику инфекционных забо леваний) и персистирующих форм микробов. Широкое использование антимикробных ле карственных средств ведет также к форми рованию антибиотикозависимости (редко) и лекарственной устойчивости — антибиотикорезистентности (достаточно часто). Антибиотики — химиотерапевтические вещества, продуцируемые микроорганизмами, животными клетками, растениями, а также их производные и синтетические продукты, которые обладают избирательной спо собностью угнетать и задерживать рост микроорганизмов, а также подавлять развитие злокачественных новообразований. За тот период, который прошел со времени открытия П.Эрлиха, было получено более 10 000 различных антибиотиков, по этому важной проблемой являлась систематизация этих препа ратов. В настоящее время существуют различные классификации антибиотиков, однако ни одна из них не является общеприня той. В основу главной классификации антибиотиков положено их химическое строение. 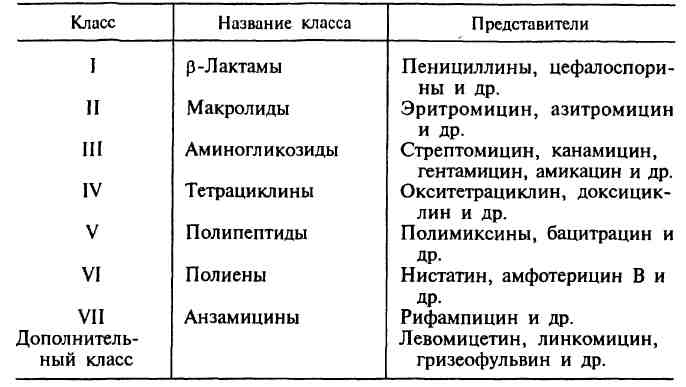 Наиболее важными классами синтетических антибиотиков яв ляются хинолоны и фторхинолоны (например, ципрофлоксацин), сульфаниламиды (сульфадиметоксин), имидазолы (метронидазол), нитрофураны (фурадонин, фурагин). По спектру действия антибиотики делят на пять групп в зави симости от того, на какие микроорганизмы они оказывают воз действие. Кроме того, существуют противоопухолевые антибио тики, продуцентами которых также являются актиномицеты. Каж дая из этих групп включает две подгруппы: антибиотики широ кого и узкого спектра действия. Антибактериальные антибиотики составляют самую многочисленную группу препаратов. Преобладают в ней антиби отики широкого спектра действия, оказывающие влияние на представителей всех трех отделов бактерий. К антибиотикам широкого спектра действия относятся аминогликозиды, тетрациклины и др. Антибиотики узкого спектра действия эффектив ны в отношении небольшого круга бактерий, например полет-миксины действуют на грациликутные, ванкомицин влияет на грамположительные бактерии. В отдельные группы выделяют противотуберкулезные, противолепрозные, противосифилитические препараты. Противогрибковые антибиотики включают значитель но меньшее число препаратов. Широким спектром действия об ладает, например, амфотерицин В, эффективный при кандидозах, бластомикозах, аспергиллезах; в то же время нистатин, дей ствующий на грибы рода Candida, является антибиотиком узко го спектра действия. Антипротозойные и антивирусные антибиотики на считывают небольшое число препаратов. Противоопухолевые антибиотики представлены препара тами, обладающими цитотоксическим действием. Большинство из них применяют при многих видах опухолей, например митоми-цин С. Действие антибиотиков на микроорганизмы связано с их спо собностью подавлять те или иные биохимические реакции, про исходящие в микробной клетке. В зависимости от механизма дей ствия различают пять групп антибиотиков: 1. антибиотики, нарушающие синтез клеточной стенки. К этой группе относятся, например, β-лактамы. Препараты этой груп пы характеризуются самой высокой избирательностью дей ствия: они убивают бактерии и не оказывают влияния на клет ки микроорганизма, так как последние не имеют главного компонента клеточной стенки бактерий — пептидогликана. В связи с этим β -лактамные антибиотики являются наименее токсичными для макроорганизма; 2. антибиотики, нарушающие молекулярную организацию и синтез клеточных мембран. Примерами подоб ных препаратов являются полимиксины, полиены; 3. антибиотики, нарушающие синтез белка; это наиболее многочисленная группа препаратов. Представителями этой группы являются аминогликозиды, тетрациклины, макроли-ды, левомицетин, вызывающие нарушение синтеза белка на разных уровнях; 4. антибиотики — ингибиторы синтеза нуклеиновых кислот. Например, хинолоны нарушают синтез ДНК, рифампицин — синтез РНК; 5. антибиотики, подавляющие синтез пуринов и аминокислот. К этой группе относятся, например, сульфаниламиды. Источники антибиотиков. Основными продуцентами природных ан тибиотиков являются микроорганизмы, ко торые, находясь в своей естественной среде (в основном, в почве), синтезируют антибио тики в качестве средства выживания в борьбе за существование. Животные и растительные клетки также могут вырабатывать некото рые вещества с селективным антимикробным действием (например, фитонциды), однако широкого применения в медицине в качестве продуцентов антибиотиков они не получили. Таким образом, основными источниками получения природных и полусинтетических антибиотиков стали: • Актиномицеты (особенно стрептомицеты) — ветвящиеся бактерии. Они синтезиру ют большинство природных антибиотиков (80 %). • Плесневые грибы — синтезируют природ ные бета-лактамы (грибы рода Cephalosporiumи Penicillium)Hфузидиевую кислоту. • Типичные бактерии — например, эубактерии, бациллы, псевдомонады — продуцируют бацитрацин, полимиксины и другие вещества, обладающие антибактериальным действием. Способы получения. Существует три основных способа получе ния антибиотиков: • биологический синтез (так получают при родные антибиотики — натуральные продук ты ферментации, когда в оптимальных ус ловиях культивируют микробы-продуценты, которые выделяют антибиотики в процессе своей жизнедеятельности); • биосинтез с последующими химическими модификациями (так создают полусинтетичес кие антибиотики). Сначала путем биосинтеза получают природный антибиотик, а затем его первоначальную молекулу видоизменяют путем химических модификаций, например присо единяют определенные радикалы, в результате чего улучшаются противомикробные и фарма кологические характеристики препарата; • химический синтез (так получают синте тические аналоги природных антибиотиков, например хлорамфеникол/левомицетин). Это вещества, которые имеют такую же структуру, 71. Лекарственная устойчивость микроорганизмов и механизм ее возникновения. Понятие о госпитальных штаммах микроорганизмов. Пути преодоления лекарственной устойчивости. Антибиотикорезистентность — это устойчи вость микробов к антимикробным химиопрепаратам. Бактерии следует считать резистент ными, если они не обезвреживаются такими концентрациями препарата, которые реально создаются в макроорганизме. Резистентность может быть природной и приобретенной. Природная устойчивость. Некоторые виды микробов природно ус тойчивы к определенным семействам антиби отиков или в результате отсутствия соответс твующей мишени (например, микоплазмы не имеют клеточной стенки, поэтому не чувстви тельны ко всем препаратам, действующим на этом уровне), или в результате бактериальной непроницаемости для данного препарата (на пример, грамотрицательные микробы менее проницаемы для крупномолекулярных соеди нений, чем грамположительные бактерии, так как их наружная мембрана имеет «маленькие» поры). Приобретенная устойчивость. Приобретение резистентности — это биологическая закономерность, связанная с адаптацией микроорганизмов к условиям внешней среды. Она, хотя и в разной степени, справедлива для всех бактерий и всех анти биотиков. К химиопрепаратам адаптируются не только бактерии, но и остальные микро бы — от эукариотических форм (простейшие, грибы) до вирусов. Проблема формирования и распространения лекарственной резистен тности микробов особенно значима для внутрибольничных инфекций, вызываемых так называемыми «госпитальными штаммами», у которых, как правило, наблюдается множес твенная устойчивость к антибиотикам (так называемая полирезистентность). Генетические основы приобретенной резис тентности. Устойчивость к антибиотикам определяется и поддерживается генами резистентности (r-генами) и условиями, способствующими их распространению в микробных популяциях. Приобретенная лекарственная устойчивость может возникать и распространяться в попу ляции бактерий в результате: • мутаций в хромосоме бактериальной клетки с последующей селекцией (т. е. отбором) му тантов. Особенно легко селекция происходит в присутствии антибиотиков, так как в этих условиях мутанты получают преимущество перед остальными клетками популяции, ко торые чувствительны к препарату. Мутации возникают независимо от применения анти биотика, т. е. сам препарат не влияет на час тоту мутаций и не является их причиной, но служит фактором отбора. Далее резистентные клетки дают потомство и могут передаваться в организм следующего хозяина (человека или животного), формируя и распространяя ре зистентные штаммы. Мутации могут быть: 1) единичные (если мутация произошла в одной клетке, в результате чего в ней синтезируются измененные белки) и 2) множественные (се рия мутаций, в результате чего изменяется не один, а целый набор белков, например пени-циллинсвязывающих белков у пенициллин-резистентного пневмококка); • переноса трансмиссивных плазмид резис тентности (R-плазмид). Плазмиды резистен тности (трансмиссивные) обычно кодируют перекрестную устойчивость к нескольким семействам антибиотиков. Впервые такая множественная резистентность была описа на японскими исследователями в отношении кишечных бактерий. Сейчас показано, что она встречается и у других групп бактерий. Некоторые плазмиды могут передаваться меж ду бактериями разных видов, поэтому один и тот же ген резистентности можно встретить у бактерий, таксономически далеких друг от друга. Например, бета-лактамаза, кодируемая плазмидой ТЕМ-1, широко распространена у грамотрицательных бактерий и встречается у кишечной палочки и других кишечных бак терий, а также у гонококка, резистентного к пенициллину, и гемофильной палочки, резис тентной к ампициллину; • переноса транспозонов, несущих r-гены (или мигрирующих генетических последова тельностей). Транспозоны могут мигрировать с хромосомы на плазмиду и обратно, а также с плазмиды на другую плазмиду. Таким образом гены резистентности могут передаваться да лее дочерним клеткам или при рекомбинации другим бактериям-реципиентам. Реализация приобретенной устойчивости. Изменения в геноме бактерий приводят к тому, что меняются и некоторые свойства бактериальной клетки, в результате чего она становится устойчивой к антибактериальным препаратам. Обычно антимикробный эффект препарата осуществляется таким образом: агент должен связаться с бактерией и прой ти сквозь ее оболочку, затем он должен быть доставлен к месту действия, после чего пре парат взаимодействует с внутриклеточными мишенями. Реализация приобретенной ле карственной устойчивости возможна на каж дом из следующих этапов: • модификация мишени. Фермент-мишень может быть так изменен, что его функции не нарушаются, но способность связываться с химиопрепаратом (аффинность) резко сни жается или может быть включен «обходной путь» метаболизма, т. е. в клетке активируется другой фермент, который не подвержен дейс твию данного препарата. • «недоступность» мишени за счет сниже ния проницаемости клеточной стенки и кле точных мембран или «эффлюко-механизма, когда клетка как бы «выталкивает» из себя антибиотик. • инактивация препарата бактериальными ферментами. Некоторые бактерии способны продуцировать особые ферменты, которые де лают препараты неактивными (например, бета-лактамазы, аминогликозид-модифицирующие ферменты, хлорамфениколацетилтрансфераза). Бета-лактамазы — это ферменты, разруша ющие бета-лактамное кольцо с образованием неактивных соединений. Гены, кодирующие эти ферменты, широко распространены среди бактерий и могут быть как в составе хромосо мы, так и в составе плазмиды. Для борьбы с инактивирующим действием бета-лактамаз используют вещества — ин гибиторы (например, клавулановую кисло ту, сульбактам, тазобактам). Эти вещества содержат в своем составе бета-лактамное кольцо и способны связываться с бета-лактамазами, предотвращая их разрушитель ное действие на бета-лактамы. При этом собственная антибактериальная активность таких ингибиторов низкая. Клавулановая кислота ингибирует большинство известныхбета-лактамаз. Ее комбинируют с пеницил-линами: амоксициллином, тикарциллином, пиперациллином. Предупредить развитие антибиотикорезистентности у бактерий практически не возможно, но необходимо использовать антимикробные препараты таким образом, чтобы не способствовать развитию и рас пространению устойчивости (в частности, применять антибиотики строго по показа ниям, избегать их использования с профи лактической целью, через 10—15 дней ан-тибиотикотерапии менять препарат, по воз можности использовать препараты узкого спектра действия, ограниченно применять антибиотики в ветеринарии и не использо вать их как фактор роста). 72. Методы микробиологической диагностики инфекционных болезней. Микробиологические (бактериологические, микологические, вирусологические) методы основаны на выделении чистой куль туры возбудителя и ее последующей идентификации на основа нии морфологических, культуральных, биохимических, антиген ных (серологических) и других признаков. Располагая чистой культурой бактерий, можно определить их родовую и видовую принадлежность, факторы патогенности, а также чувствитель ность к антибиотикам и химиотерапевтическим препаратам. Микологические исследования осуществляются реже, чем бактериологические, поскольку микроскопическая диагностика микозов достаточно надежна. Микологические исследования про водят при диагностике кандидозов путем определения нараста ния количества клеток дрожжеподобных грибов рода Candida, а также глубоких микозов. Вирусологический метод является наиболее достоверным в диагностике вирусных инфекций. Однако его трудоемкость, связанная с приготовлением культуры клеток, обработкой иссле дуемого материала, а также со сравнительно частым получе нием отрицательных результатов, ограничивают применение дан ного метода. Кроме того, он требует затраты сравнительно боль шого времени, особенно при проведении «слепых» пассажей. Во многих случаях вирусологический метод используют для ретроспективной диагностики вирусных инфекций. Все микробиологические методы имеют определяющее значе ние в лабораторной диагностике, являются наиболее информа тивными и достоверными, особенно если они подтверждены до полнительными серологическими данными. 73. Возбудители брюшного тифа и паратифов. Таксономия. Характеристика. Микробиологическая диагностика. Специфическая профилактика и лечение. |
