1. Определение понятия фермент
 Скачать 0.71 Mb. Скачать 0.71 Mb.
|
являются амфотерными соединениями; вступают в те же качественные реакции, что и белки (биуретовую, ксантопротеиновую, фолина и др.); подобно белкам растворяются в воде с образованием коллоидных растворов; обладают электрофоретической активностью; гидролизуются до аминокислот; склонны к денатурации под влиянием тех же факторов: температуры, изменениях рН, действием солей тяжелых металлов, действием физических факторов (ультразвук, ионизирующее излучение и др.); имеют несколько уровней организации макромолекул, что подтверждено данными рентгеноструктурного анализа, ЯМР, ЭПР.
4.Строение простых, сложных ферментов: активный и аллостерический центры. Определение понятий: холофермент, апофермент, кофермент, кофактор, субстрат, метаболит, продукт.Метаболит - вещество, которое участвует в метаболических процессах. Субстрат – вещество, которое вступает в химическую реакцию. Продукт – вещество, которое образуется в ходе химической реакции. Ферменты характеризуются наличием специфических центров катализа. Активный центр (Ац) – это часть молекулы фермента, которая специфически взаимодействует с субстратом и принимает непосредственное участие в катализе. Ац, как правило, находиться в нише (кармане). В Ац можно выделить два участка: участок связывания субстрата – субстратный участок (контактная площадка) и собственно каталитический центр. Большинство субстратов образует, по меньшей мере, три связи с ферментом, благодаря чему молекула субстрата присоединяется к активному центру единственно возможным способом, что обеспечивает субстратную специфичность фермента. Каталитический центр обеспечивает выбор пути химического превращения и каталитическую специфичность фермента. У группы регуляторных ферментов есть аллостерические центры, которые находятся за пределами активного центра. К аллостерическому центру могут присоединяться “+” или “–“ модуляторы, регулирующие активность ферментов. Различают ферменты простые, состоят только из аминокислот, и сложные, включают также низкомолекулярные органические соединения небелковой природы (коферменты) и (или) ионы металлов (кофакторы). Коферменты – это органические вещества небелковой природы, принимающие участие в катализе в составе каталитического участка активного центра. В этом случае белковую составляющую называют апоферментом, а каталитически активную форму сложного белка – холоферментом. Таким образом: холофермент = апофермент + кофермент. В качестве коферментов функционируют:
Кофермент, который присоединен к белковой части ковалентными связями называется простетической группой. Это, например, FAD, FMN, биотин, липоевая кислота. Простетическая группа не отделяется от белковой части. Кофермент, который присоединен к белковой части нековалентными связями называется косубстрат. Это, например, НАД+, НАДФ+. Косубстрат присоединяется к ферменту в момент реакции. Кофакторы ферментов – это ионы металлов, необходимые для проявления каталитической активности многих ферментов. В качестве кофакторов выступают ионы калия, магния, кальция, цинка, меди, железа и т.д. Их роль разнообразна, они стабилизируют молекулы субстрата, активный центр фермента, его третичную и четвертичную структуру, обеспечивают связывание субстрата и катализ. Например, АТФ присоединяется к киназам только вместе с Mg2+. 5. Изоферменты. Строение, биологическую роль, диагностическое значение определения. Изоферменты лактатдегидрогеназы (ЛДГ), креатинкиназы (КК) Изоферменты – это множественные формы одного фермента, катализирующие одну и ту же реакцию, но отличающие по физическим и химическим свойствам (сродству к субстрату, максимальной скорости катализируемой реакции, электрофоретической подвижности, разной чувствительности к ингибиторам и активаторам, оптимуму рН и термостабильности). Изоферменты имеют четвертичную структуру, которая образована четным количеством субъединиц (2, 4, 6 и т.д.). Изоформы фермента образуются в результате различных комбинаций субъединиц. В качестве примера можно рассмотреть лактатдегидрогеназу (ЛДГ), фермент, который катализирует обратимую реакцию: НАДН2 НАД+ пируват ←ЛДГ→ лактат ЛДГ существует в виде 5 изоформ, каждая из которых состоит из 4-х протомеров (субъединиц) 2 типов М (muscle) и Н (heart). Синтез протомеров М и Н типа кодируется двумя разными генетическими локусами. Изоферменты ЛДГ различаются на уровне четвертичной структуры: ЛДГ1 (НННН), ЛДГ2 (НННМ), ЛДГ3 (ННММ), ЛДГ4 (НМММ), ЛДГ5 (ММММ). Полипептидные цепи Н и М типа имеют одинаковую молекулярную массу, но в составе первых преобладают карбоновые аминокислоты, последних – диаминокислоты, поэтому они несут разный заряд и могут быть разделены методом электрофореза. Кислородный обмен в тканях влияет на изоферментный состав ЛДГ. Где доминирует аэробный обмен, там преобладают ЛДГ1, ЛДГ2 (миокард, надпочечники), где анаэробный обмен - ЛДГ4, ЛДГ5 (скелетная мускулатура, печень). В процессе индивидуального развития организма в тканях происходит изменение содержания кислорода и изоформ ЛДГ. У зародыша преобладают ЛДГ4, ЛДГ5. После рождения в некоторых тканях происходит увеличение содержания ЛДГ1, ЛДГ2. Существование изоформ повышает адаптационную возможность тканей, органов, организма в целом к меняющимся условиям. По изменению изоферментного состава оценивают метаболическое состояние органов и тканей. Изоформы креатинкиназы. Креатинкиназа (КК) катализирует реакцию образования креатинфосфата: 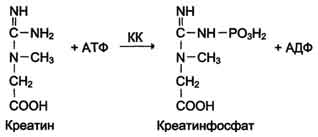 Молекула КК - димер, состоящий из субъединиц двух типов: М (от англ, muscle - мышца) и В (от англ, brain - мозг). Из этих субъединиц образуются 3 изофермента - ВВ, MB, MM. Изофермент ВВ находится преимущественно в головном мозге, ММ - в скелетных мышцах и MB - в сердечной мышце. Изоформы КК имеют разную электрофоретическую подвижность (рис. 2-36). Активность КК в норме не должна превышать 90 МЕ/л. Определение активности КК в плазме крови имеет диагностическое значение при инфаркте миокарда (происходит повышение уровня МВ-изоформы). Количество изоформы ММ может повышаться при травмах и повреждениях скелетных мышц. Изоформа ВВ не может проникнуть через гематоэнцефалический барьер, поэтому в крови практически не определяется даже при инсультах и диагностического значения не имеет. 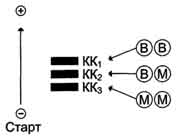 6. Локализация и компартментализация ферментов в клетке и тканях: ферменты общего назначения, органоспецифические и органеллоспецифические (маркерные) ферменты. Ферменты по локализации делят на 3 группы: I – общие ферменты (универсальные) II - органоспецифические III - органеллоспецифические Общие ферменты обнаруживаются практически во всех клетках, обеспечивают жизнедеятельность клетки, катализируя реакции биосинтеза белка и нуклеиновых кислот, образование биомембран и основных клеточных органелл, энергообмен. Общие ферменты разных тканей и органов, тем не менее, отличаются по активности. Органоспецифичные ферменты свойственны только определенному органу или ткани. Например: Для печени – аргиназа. Для почек и костной ткани – щелочная фосфатаза. Для предстательной железы – КФ (кислая фосфатаза). Для поджелудочной железы – α-амилаза, липаза. Для миокарда – КФК (креатинфосфокиназа), ЛДГ, АсТ и т.д. Внутри клеток ферменты также распределены неравномерно. Одни ферменты находятся в коллоидно-растворенном состоянии в цитозоле, другие вмонтированы в клеточных органеллах (структурированное состояние). Органеллоспецифические ферменты. Разным органеллам присущ специфический набор ферментов, который определяет их функции. Органеллоспецифические ферменты это маркеры внутриклеточных образований, органелл:
В результате в клетке образуются отсеки (компартменты), которые отличаются набором ферментов и метаболизмом (компартментализация метаболизма). Среди ферментов выделяется немногочисленная группа регуляторных ферментов, которые способны отвечать на специфические регуляторные воздействия изменением активности. Эти ферменты имеются во всех органах и тканях и локализуются в начале или в местах разветвления метаболических путей. Строгая локализация всех ферментов закодирована в генах. Определение в плазме или сыворотке крови активности органо- органеллоспецифических ферментов широко используется в клинической диагностике. |
