1. Определение понятия фермент
 Скачать 0.71 Mb. Скачать 0.71 Mb.
|
|
13.Энзимопатии: понятие, классификация, молекулярные причины возникновения и механизмы развития, последствия, биохимическая диагностика. I. Энзимопатология Энзимопатология – это наука, которая изучает энзимопатии. Энзимопатии – это группа заболеваний, которые вызваны различными дефектами ферментов. Энзимопатий делятся на: наследственные (первичные) и приобретенные (вторичные). 1. Наследственные энзимопатии Наследственные энзимопатии – это заболевания, вызванные наследственными нарушениями биосинтеза ферментов или их структуры и функции. В норме: 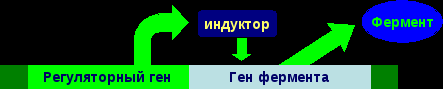 Полное или частичное нарушения биосинтеза ферментов вызывают дефекты генов регуляторных белков, которые контролируют синтез ферментов: 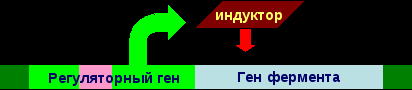 Нарушение структуры и функции ферментов вызывают дефекты генов этих ферментов: 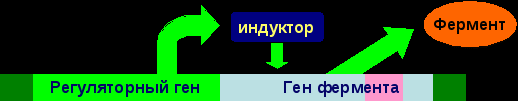 У образовавшегося фермента наблюдаются структурные изменения, которые проявляются в изменении его каталитической активности (как правило, она исчезает), чувствительности к активаторам и ингибиторам, сродству к субстратам, оптимумам рН, температуры. В связи с этим изучением констант фермента является решающим в постановке диагноза врожденных энзимопатий. Наследственные энзимопатии по типу нарушений метаболизма делят на:
В норме метаболический путь протекает следующим образом:  Из-за дефекта в метаболическом пути (цикле, шунте) одного из ферментов в организме происходит накопление промежуточных продуктов (часто токсичных в высоких концентрациях) и дефицит жизненно необходимых конечных продуктов, что приводит к клиническим проявлениям: 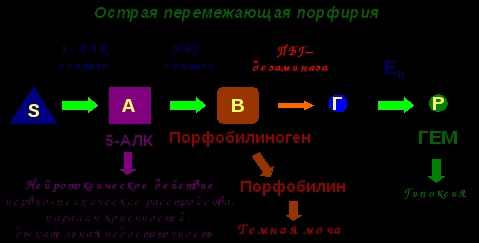 Пример: фенилпировиноградная олигофрения – наследственное заболевание, приводящее в раннем детстве к гибели ребенка или к развитию у него тяжелой умственной отсталости. Причиной заболевания является отсутствие в печени фермента фен-4-монооксигеназы, которая обеспечивает превращение незаменимой аминокислоты Фен в Тир: 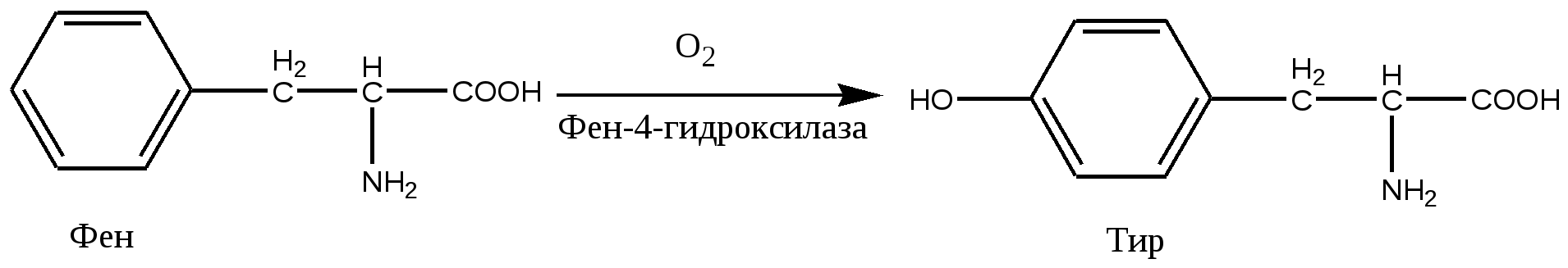 Эта реакция необходима для катаболизма Фен, т.е. удаления его излишков. При отсутствии фен-4-монооксигеназы в организме происходит накопление Фен и превращение его в различные производные: фенилпировиноградную, фенилмолочную и фенилуксусную кислоты. Фен и его производные в высоких концентрациях токсичны, накапливаясь в тканях, они оказывают на них повреждающее действие. Самой чувствительной к Фен и его производным оказывается нервная ткань детей, она поражается в первую очередь. Диагноз фенилкетонурия ставят на основании обнаружения Фен в крови или фенилпировиноградной кислоты на пеленках детей. Лечение в основном сводится к исключению из питания ребенка Фен. Для такого ребенка Тир оказывается незаменимой аминокислотой. Другое тяжелое наследственное заболевание – галактеземия (непереносимость молочного сахара), связано с отсутствием синтеза в печени ферментов, катализирующих превращение галактозы в глюкозу. В результате в раннем возврате происходит накопление в тканях галактозы, приводящее к развитию катаракты, поражению печени, мозга, нередко вызывающее гибель ребенка. Лечение в данном случае сводиться к исключению из диеты молочного сахара. 2. Приобретенные энзимопатии Приобретенные энзимопатии делятся на: алиментарные, токсические и вызванные различными патологическими состояниями организма. А). Алиментарные энзимопатии – это заболевания, вызванные изменением количества и активности ферментов вследствие нарушения характера питания. Алиментарные энзимопатии вызываются дефицитом или дисбалансом в пище:
Например, алиментарная энзимопатия, вызванная недостаточностью витамина А, проявляется нарушением сумеречного зрения (куриная слепота), воспалением слизистых глаз, ЖКТ, кожи. Б). Токсические энзимопатии – это заболевания, вызванные нарушением активности ферментов вследствие действия токсических веществ. Токсическим веществами являются многие ксенобиотики (соли тяжелых металлов, пестициды, гербециды и т.д.), а также некоторые метаболиты в высоких концентрациях (алкоголь). Токсические вещества могут либо избирательно угнетать активность (через денатурацию или ингибирование) или синтез отдельных ферментов, либо угнетать весь биосинтез белка (и соответственно всех ферментов). Примеры:
В). Энзимопатии, вызванные различными патологическими состояниями организма. Так как ферменты имеют оптимумы t, рН и давления, практически любое заболевание, вызывающее нарушения КОС, изменение температуры тела, концентрации активаторов и ингибиторов, меняет активность ферментов организма. Например, при ацидозе и повышении температуры возрастает активность катаболических (лизосом) и падает активность анаболических ферментов. Ферменты в медицинской практике находят применение в качестве диагностических (энзимодиагностика) и терапевтических (энзимотерапия) средств. 14.Принципы, направления и объекты энзимодиагностики: а) энзимологическое определение количества метаболитов, б) определение активности ферментов. Причины и механизмы развития ферментемий. Энзимодиагностика (энзим[ы] + греч. diagnostikos способный распознавать) – методы диагностики болезней, патологических состояний и процессов, основанные на определении активности ферментов в биологических жидкостях. Направления энзимодиагностики: 1) Определение активности органо-, органеллоспецифических ферментов и их изоферментов. Определение в биологических жидкостях активности ферментов и их изоферментов позволяет установить локализацию патологического процесса, его стадию, выраженность, а также эффективность его лечения. Ферменты плазмы крови по происхождению можно разделить на 3 группы: 1) секреторные ферменты - секретируются определенными органами в плазму крови, где и выполняют свою функцию. Например: ЛПЛ, ЛХАТ, ферменты свертывающей и противосвертывающей системы крови; 2) экскреторные ферменты - синтезируются в железах ЖКТ, выделяются в просвет ЖКТ, где обеспечивают процесс пищеварения. В кровь эти ферменты попадают при повреждении желез. Например, при панкреатите в крови обнаруживается панкреатическая липаза, амилаза, трипсин и т.д., при воспалении слюнных желез - амилаза слюны. 3) клеточные ферменты - функционируют только внутри клеток, в плазму крови они попадают во время повреждения (под действием медиаторов воспаления и т.д.) и гибели клеток (при некрозе). К ним относятся общие, органо- и органеллоспецифические ферменты. За счет естественной гибели клеток клеточные ферменты имеют в плазме крови постоянно низкую активность. При поражении органа происходит значительный выход ферментов из его клеток и многократное увеличение активности этих ферментов в плазме крови. Например: Аминотрансферазы. Локализуются в митохондриях, обеспечивают взаимопревращения аминокислот и кетокислот: АК1 + КК2 ↔ КК1 + АК2. АСТ: асп+α-КГ↔ЩУК+глу. АСТ много в миокарде, по убыванию меньше в печени, скелетной мускулатуре, ЦНС, почках, семенниках. Активность в сыворотке крови 6-25МЕ/л. АЛТ: ала+α-КГ↔ПВК+глу. АЛТ много в печени, поджелудочной железе, миокарде, скелетной мускулатуре. Активность в сыворотке крови 6-26МЕ/л. Активность обеих трансаминаз в сыворотке крови возрастает в десятки раз при инфаркте миокарда (АСТ>АЛТ), при остром инфекционном гепатите (АЛТ>АСТ), а также при циррозе печени и мышечной дистрофии. Информативными пробами являются креатинфосфокиназный и лактатдегидрогеназный тесты, относящиеся к некротическим ферментным методам. Их диагностическая ценность повысилась после внедрения в клиническую практику методов определения их изоферментов. ЛДГ. Локализуется в цитозоле, обеспечивает взаимопревращения ПВК и лактата. ЛДГ: ПВК+ НАДН2 ↔ лактат + НАД+. ЛДГ1 и ЛДГ2 наиболее активны в сердечной мышце и почках, ЛДГ4 ЛДГ5 - в скелетных мышцах и печени. Активность в сыворотке крови 55-140МЕ/л. При инфаркте миокарда в сыворотке крови резко повышается активность ЛДГ1 и ЛДГ2, а при поражениях скелетной мускулатуры и печени (гепатит, отравления хлорорганическими соединениями) повышается активность ЛДГ4 ЛДГ5. Креатинкиназа (КК). Локализуется в цитозоле, митохондриях, миофибриллах. КК: Креатин + АТФ ↔ креатинфосфат + АДФ. Изофермент КК-ВВ находиться преимущественно в головном мозге, МВ – в миокарде, ММ – в скелетных мышцах. Активность в сыворотке крови КК в норме до 90МЕ/л. В сыворотке крови КК-ММ повышается при повреждении скелетных мышц (при прогрессирующей мышечной дистрофии в 50 раз), КК-МВ - при инфаркте миокарда. КК-ВВ не проходит гематоэнцефалический барьер и не имеет значения для диагностики патологий ЦНС. В сыворотке крови повышена активность амилазы при остром панкреатите, кисте поджелудочной железы; γ-глутамилтранспептидазы - при остром инфекционном или токсическом гепатите, хроническом гепатите, циррозе печени; кислой фосфатазы - при карциноме простаты; щелочной фосфатазы - при заболеваниях костей, закупорке желчных протоков, при беременности и у детей. Определение активности ферментов с диагностической целью проводят также в моче, слюне, ликворе и биоптатах органов и тканей. 2) Определение активности ферментов и их констант (Km, t, pH). Это направление используют для диагностики наследственных патологий и выявления механизмов патогенеза ряда заболеваний. 3) Определение концентрации органических веществ с помощью ферментов. Использование ферментов в качестве реактивов позволяет определять концентрацию органических веществ с высокой точностью, так как ферменты обладают высокой чувствительностью и избирательностью к своим субстратам.  15. Основные принципы и методы энзимотерапии. Биохимические основы энзимотерапии: особенности применения, пути введения. Энзимотерапия – применение ферментов животного, бактериального или растительного происхождения и регуляторов активности ферментов с лечебной целью. Внедрению ферментных препаратов в современную клиническую практику способствовало развитие технологий получения обогащенных ферментами препаратов и очищенных ферментов. В энзимотерапии существует насколько направлений: 1. Лекарственные препараты на основе ферментов. В качестве лекарственных препаратов наиболее широко используются гидролитические ферменты. 1) Протеолитические ферменты применяются при нарушении пищеварения. Например: а) Экстракты слизистой оболочки желудка, основным действующим веществом которых является пепсин. Это препараты абомин и ацидинпепсин, их в основном используют для коррекции секреторной дисфункции желудка. б) Панкреатические энзимы, представленные амилазой, липазой, трипсином и химотрипсином. Это препараты панкреатин, мезим-форте, панцитрат, креон, их используются для коррекции нарушений процесса пищеварения, а также для регуляции функций поджелудочной железы. в) Комбинированные ферменты, содержащие панкреатин в комбинации с компонентами желчи, гемицеллюлозой. Это препараты дигестал, фестал, панзинорм-форте, энзистал. Их назначают при недостаточной внешнесекреторной функции поджелудочной железы в сочетании с патологией печени, желчевыводящей системы, при нарушении жевательной функции, малоподвижном образе жизни, кратковременных погрешностях в еде. г) Растительные энзимы, представленные папаином, грибковой амилазой, протеазой, липазой и др. ферментами. Препараты пепфиз и ораза. Папаин и протеазы гидролизируют белки, грибковая амилаза - углеводы, липаза - жиры. д) Дисахаридазы. Например, тилактаза - пищеварительный фермент представляющий собой лактазу, которая находится в щеточной кайме слизистой оболочки тощей кишки и проксимального отдела подвздошной кишки. Расщепляет лактозу на простые сахара. 2) Протеолитические препараты применяют местно, в виде аппликаций или орошений, при первичной обработке ран и ожогов. Гидролизуя белки некротизированных тканей, ферменты способствуют очищению раны, уменьшению воспаления и ускорению заживления. Например, коллагеназа вызывает деструкцию коллагена при этом жизнеспособные мышцы, грануляционная ткань и эпителий остаются интактными. При гнойных ранах коллагеназа способствует быстрому очищению от нежизнеспособных тканей и экссудата, более раннему появлению грануляционной ткани и эпителизации, предупреждает развитие грубых (типа келоидных) рубцов, способствует сохранению функции суставов. 3) Гиалуронидазы– (лидаза, ронидаза) – ферменты, специфическим субстратом которых является гиалуронованная кислота, основа межклеточного матрикса соединительной ткани. Показателями к их применению являются рубцы после ожогов и операций, гематомы, контрактуры суставов и т.д. Лечебный эффект проявляется размягчением рубцов, рассасыванием гематом, появлением подвижности в суставах. 4) Протеолитические ферменты стрептокиназу, урокиназу применяют для предотвращения и лечения тромбозов, эмболии, инфаркта миокарда, закупорки сосудов сетчатки глаза. Стрептокиназа и урокиназа способствует превращению плазминогена в плазмин, который лизирует тромб. 5) Нуклеазы (ДНК-аза, РНК-аза) используют при лечении некоторых вирусных заболеваний (герпес, аденовирусный конъюктивит, вирусный менингит, ОРВИ и др.). Фермент разрушает ДНК вируса, не повреждая вместе с тем ДНК клеток макроорганизма. α-ДНКаза в препарате пульмозим используется как муколитик, она расщепляет внеклеточную ДНК, содержащуюся в большом количестве в вязком бронхиальном секрете. 6) Бактериолитическиеферменты. Препарат «лизоамидаза» содержит комплекс ферментов: мурамидазу, амидазу, пептидазу и высокомолекулярный полисахарид. Препарат обладает наибольшей бактерицидной активностью по отношению к грамположительным бактериям: стафилакоккам, стрептококкам, а также менингококкам, гонококкам. Особенность, препарат показывает высокую бактерицидную эффективность вне зависимости от устойчивости бактерий к действию антибиотиков. Системная энзимотерапия – использование полиферментных препаратов широкого спектра действия. Полиферментные препараты представляют собой эффективное противовоспалительное, противоотечное, фибринолитическое, иммуномодулирующее и вторично анальгетическое средство широкого спектра показаний. Препараты вобэнзим, вобэмугос, флогэнзим применяются в области травматологии, хирургии, спортивной медицины, ревматологии, ангиологии и гинекологии. Препарат вобэнзим кроме панкреатина содержит папаин (из растения Carica Papaya), бромелаин (из ананаса обыкновенного) и рутозид (группа витамина Р). Наряду с выраженными ферментативными свойствами обладает противовоспалительным, противоотечным, фибринолитическим и вторичноанальгезирующим действием. Используется при панкреатите, язвенном колите, болезни Крона, травмах, аутоиммунных онкологических, урологических, гинекологических заболеваниях. Флогэнзим представляет собой комбинацию ферментов (бромелаин и трипсин) и рутина. Бромелаин и трипсин способствуют быстрому расщеплению клеточных фрагментов и метаболических продуктов воспалительного процесса, рутин восстанавливает проницаемость стенок сосудов, что приводит к уменьшению отеков и гематом. Флогэнзим оказывает противовоспалительное, фибринолитическое, антиагрегантное и противоотечное действие. Применение ферментов в терапии ограничивается их лабильностью, нежелательными антигенными свойствами, трудностями адресной доставки к пораженным органам и тканям. Этих недостатков лишены иммобилизированные ферменты – энзимные препараты, соединенные с полимерной матрицей, либо включенные в липосомы или тени эритроцитов. Например, прозефим (комплекс бактериальных протеаз, иммобилизированных на аминоцеллюлозе), применяемый при гнойно-некротических процессах, обладает пролонгированным лечебным эффектом. Он способен гидролизовать денатурированный белок непрерывно свыше 10 суток, сохраняя по истечении этого срока до 90% исходной активности. Иммобилизированные ферменты применяют для экстракорпоральной перфузии крови типа «искусственная почка». Такое лечение полностью исключает нежелательные воздействия на организм чужеродного белка и может проводиться в течение длительного времени. |
