Биохимия белков и аминокислот. Вводная информация
 Скачать 306.6 Kb. Скачать 306.6 Kb.
|
|
Вводная информация Белки, поступившие в организм с пищей, в желудочно-кишечном тракте (ЖКТ) расщепляются до аминокислот при действии группы протеолитических ферментов — пептидгидролаз( то же самое что и протеазы) по современной номенклатуре. Эти ферменты катализируют гидролитическое расщепление пептидной связи в белках, представляющее собой экзэргоничсский( самопроизвольный процесс, начинается без притока энергии согласно второму началу термодинамики) процесс. Их активация происходит путём ограниченного протеолиза – избирательного гидролиза определённых пептидных связей, протекающего либо автокаталитически, либо под действием др. протеиназ, и обычно сопровождается отщеплением пептидов. Из тонкого отдела кишечника в кровь всасываются преимущественно аминокислоты и в небольших количествах низкомолекулярные пептиды. Переваривание белков и связанное с ним всасывание преимущественно аминокислот играют важнейшую защитную роль против поступления в организм чужеродных (неспецифичных) белков. Механизм всасывания аминокислот – сложный биологический процесс, объединяющий фильтрацию, диффузию, осмос и активную всасывающую деятельность ворсинок. После всасывания в кровь аминокислоты поступают к органам и тканям, в первую очередь – в печень. Интенсивность всасывания отдельных аминокислот не зависит от молекулярной массы, но их структура, очевидно, играет роль в этом процессе. Неодинаковая скорость всасывания аминокислот из кишечника в кровь лежит в основе нормирования их в рационе по взаимному соотношению или к какой-либо одной аминокислоте (лизин). Ферменты, расщепляющие белки, обладают относительной субстратной специфичностью, которая определяется: Длина полипептидной цепи Структурой радикалов аминокислотных остатков, образующих гидролизуемую пептидную связь Положением связи в полипептиде Внутренние пептидные связи расщепляются эндопептидазами, концевые — экзопептидазами( карбоксипептидазы – с С конца, аминопептидазы – с N конца): 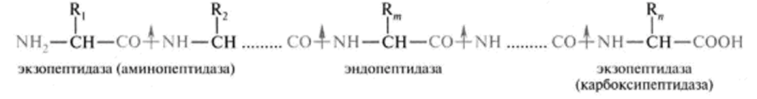 Все протеолитические ферменты синтезируются в виде неактивных предшественников, называемых зимогенами или проферментами, и таким образом клетки защищены от контакта с активной формой фермента и автолиза. В желудке пища подвергается воздействию желудочного сока, включающего соляную кислоту и ферменты. К ферментам желудка относятся две группы протеаз с разным оптимумом рН, которые упрощенно называют пепсин и гастриксин. У грудных детей основным ферментом является реннин. Функции соляной кислоты Денатурация белков пищи. Бактерицидное действие. Высвобождение железа из комплекса с белками, что необходимо для его всасывания. Аналогично высвобождаются и другие металлы. Высвобождение различных органических молекул, прочно связанных с белковой частью (гем, коферменты - тиаминдифосфат, ФАД, ФМН, пиридоксальфосфат, кобаламин, биотин), что позволяет витаминам впоследствии всасываться. Превращение неактивного пепсиногена в активный пепсин. Снижение рН желудочного содержимого до 1,5-2,5 и создание оптимума рН для работы пепсина. После перехода в 12-перстную кишку – стимуляция секреции кишечных гормонов и, следовательно, выделения панкреатического сока и желчи. Пепсин обладает невысокой специфичностью: В основном он гидролизует пептидные связи, образованные аминогруппами ароматических аминокислот (тирозина, фенилаланина, триптофана) Меньше и медленнее – аминогруппами и карбоксигруппами лейцина, глутаминовой кислоты  Азотистый баланс Во всех клетках организма постоянно идут процессы анаболизма и катаболизма. Также как и любые другие молекулы, белковые молекулы в организме непрерывно распадаются и синтезируются, идет процесс самообновления белков. Если скорость синтеза белков равна скорости их распада, наступает азотистое равновесие, или, по другому, это состояние, когда количество выводимого азота равно количеству получаемого. Если синтез белков превышает скорость их распада, то количество выводимого азота снижается и разность между поступающим азотом и выводимым становится положительной. Положительный азотистый баланс наблюдается у здоровых детей, при нормальной беременности, выздоравливающих больных, спортсменов при наборе формы( в тех случаях, когда усиливается синтез структурных и функциональных белков в клетках). При возрастании доли выводимого азота наблюдается отрицательный азотистый баланс. Отрицательный баланс отмечается у больных и голодающих. Всемирная организация здравоохранения рекомендует принимать не менее 42 г полноценного белка в сутки – это физиологический минимум. Только в этом случае в организме наступает азотистое равновесие. У детей при недостатке белка в пище задерживается рост, отстает физическое и умственное развитие, изменяется состав костной ткани, снижается активность иммунной системы и сопротивляемость к заболеваниям, тормозится деятельность эндокринных желез. Выраженным нарушением потребления белков является квашиоркор – нехватка белков, особенно животных, в пище. В результате возникает дисбаланс аминокислотного состава пищи и недостаток незаменимых аминокислот. Заболевание наиболее характерно для слаборазвитых стран Азии и Африки и его начало совпадает с отнятием ребенка от груди матери (1,5-3 годика), когда он лишается полноценного белка и переходит на скудное растительное питание взрослых. У больных наблюдается истощение, остановка роста, отечность, анемия, нарушение интеллекта и памяти, умственная отсталость, гипопротеинемия и аминоацидурия. Источники аминокислот, транспорт аминокислот, общие пути обмена аминокислот Фонд свободных аминокислот организма составляет примерно 35 г. Содержание свободных аминокислот в крови в среднем равно 35 — 65 мг/дл. Большая часть аминокислот входит в состав белков. 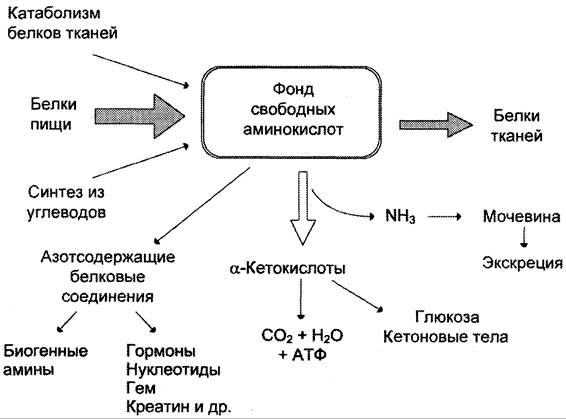 Рис 1. Источники аминокислот и пути их использования в организме В результате расщепления белков в ЖКТ под действием протеолитических ферментов белки теряют свою видовую, тканевую специфичность и всасываются в кровь в тонком кишечнике в виде аминокислот. Транспорт аминокислот через клеточные мембраны осуществляется в основном по механизму вторично-активного транспорта. В этом случае система активного транспорта приводится в действие не путем прямого гидролиза ЛТФ, а за счет энергии, запасенной в ионных градиентах. Перенос аминокислот внутрь клеток осуществляется чаще всего как симпорт аминокислот и ионов натрия, подобно механизму симпорта сахаров и ионов натрия. Энергия АТФ затрачивается на выкачивание Nа+/К+-АТФ-азой ионов натрия из клетки, создания электрохимического градиента на мембране, энергия которого опосредованно обеспечивает транспорт аминокислот в клетку. 1) Переаминирование аминокислот: Переаминирование — реакция переноса α-аминогруппы с аминокислоты на α-кетокислоту, в результате чего образуются новая α-кетокислота и новая аминокислота. Процесс трансаминирования легко обратим, при нем общее количество аминокислот в клетке не меняется. Реакции катализируют аминотрансферазы, коферментом которых служит пиридоксальфосфат (ПФ) — производное витамина В6 (пиридоксина). 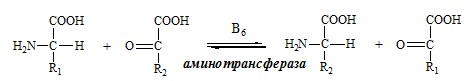 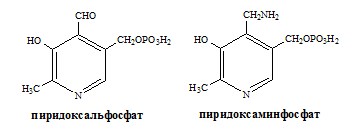 Рис 2. Общая схема переаинирования  Рис 3. Пример переаминирования Вначале, аминоксилота передает свою аминогруппу на пиродоксальфосфат. Аминокислота при этом превращается в кетокислоту, а пиродоксальфосфат – в пиридоксаминфосфат. Затем, реакции идут в обратную сторону: но уже другая кетокислота, принимает аминогруппу от пиридоксаминфосфата и превращается в новую АК, а пиридоксаминфосфат в пиродоксальфосфат. 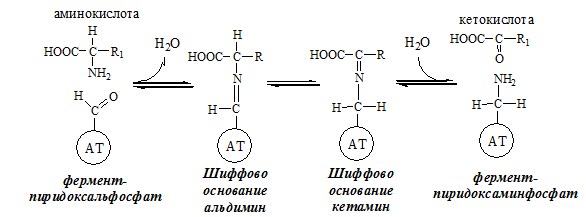 Рис 4. Развернутый пример в полных реакциях 2) Дезаминирование аминокислот — реакция отщепления α-аминогруппы от аминокислоты, в результате чего образуется соответствующая α-кетокислота и выделяется молекула аммиака. Дезаминирование бывает прямым и непрямым. Прямое дезаминирование – это дезаминирование, которое происходит в 1 стадию с участием одного фермента. Прямому дезаминированию повергаются глу, гис, сер, тре, цис. Окислительное дезаминирование – самый активный вид прямого дезаминирования аминокислот. Глутаматдегидрогеназа (глу-ДГ) – олигомер, содержит кофермент НАД+. Глу-ДГ катализирует обратимое дезаминирование глу, очень активна в митохондриях клеток практически всех органов, кроме мышц. Глу-ДГ аллостерический ингибируют АТФ, ГТФ, НАДH2, активирует избыток АДФ. Индуцируется Глу-ДГ стероидными гормонами (кортизолом). Реакция идёт в 2 этапа. Вначале происходит ферментативное дегидрирование глутамата и образование α-иминоглутарата, затем — неферментативное гидролитическое отщепление иминогруппы в виде аммиака, в результате чего образуется α-кетоглутарат. При избытке аммиака реакция протекает в обратном направлении (как восстановительное аминирование α-кетоглутарата). 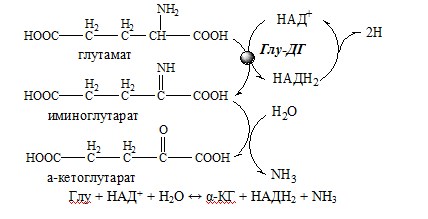 Оксидаза L-аминокислот - в печени и почках есть оксидаза L-АК, способная дезаминировать некоторые L-аминокислоты: 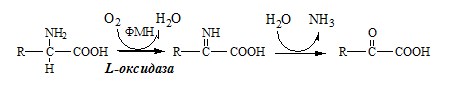 Оксидаза D-аминокислот также обнаружена в почках и печени. Это ФАД-зависимый фермент, с оптимумом рН в нейтральной среде. Оксидаза D-аминокислот превращает, спонтанно образующиеся из L-аминокислот, D-аминокислоты в кетокислоты. 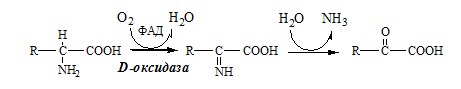 3) Непрямое дезаминирование – это дезаминирование, которое происходит в 2 стадий с участием нескольких ферментов. Оно характерно для большинства аминокислот, так как они не способны к прямому дезаминированию (нет ферментов). На первой стадии происходит одна и несколько реакций переаминирования с участием аминотрансфераз, в результате аминогруппа аминокислоты переходит на кетосоединение (α-КГ, ИМФ). На второй стадии происходит реакция дезаминирования аминосоединения (глу, АМФ), в результате чего образуется аммиак. Виды непрямого дезаминирования: В печени. Непрямое дезаминирование аминокислоты происходит при участии 2 ферментов: аминотрансферазы и глу-ДГ. Аминогруппы аминокислоты в результате трансаминирования переносятся на α-КГ с образованием глутамата, который затем подвергается прямому окислительному дезаминированию. Обе стадии непрямого дезаминирования обратимы, что обеспечивает как катаболизм аминокислот, так и возможность образования практически любой АК из соответствующей α-кетокислоты. 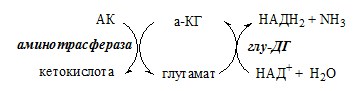 В мышечной ткани активность глу-ДГ низка, поэтому при интенсивной физической нагрузке функционирует ещё один путь непрямого дезаминирования с участием цикла ИМФ-АМФ. 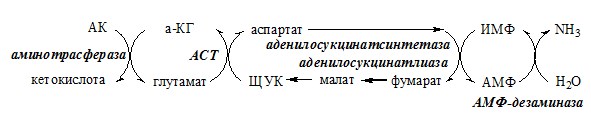 Можно выделить 4 стадии этого процесса: трансаминирование с а-кетоглутаратом, образование глутамата (аминотрансфераза); трансаминирование глутамата с ЩУК, образование аспартата (АСТ); реакция переноса аминогруппы от аспартата на ИМФ (инозинмонофосфат), образование АМФ и фумарата (аденилосукцинасинтаза и аденилосукцинатлиаза); гидролитическое дезаминирование АМФ (АМФ-дезаминаза). 4) Некоторые аминокислоты и их производные могут подвергаться декарбоксилированию – отщеплению α-карбоксильной группы. У млекопитающих декарбоксилируются: три, тир, вал, гис, глу, цис, арг, орнитин, SAM, ДОФА, 5-окситриптофан и т.д. Реакцию необратимо катализируют декарбоксилазы, которые содержат в активном центре пиридоксальфосфат. Механизм реакции похож на реакцию переаминирования. Продуктами реакции являются СО2 и биогенные амины, выполняющие регуляторные функции (гормоны, тканевые гормоны, нейромедиаторы). Серотонин. Серотонин образуется из триптофана в надпочечниках, ЦНС и тучных клетках. 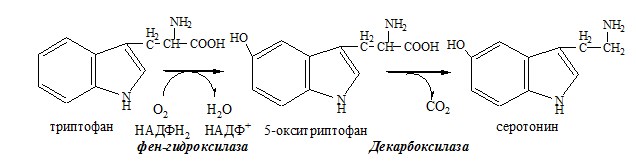 ГАМК. ГАМК образуется и разрушается в ГАМК-шунте ЦТК в высших отдела мозга. Он имеет очень высокую концентрацию. 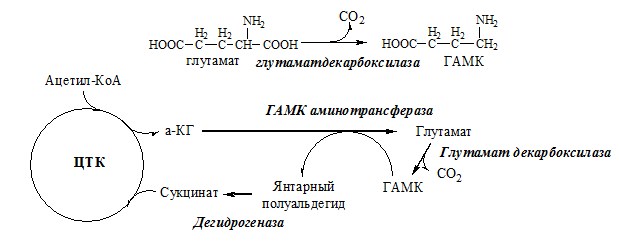 Гистамин. Гистамин образуется в тучных клетках. Секретируется в кровь при повреждении ткани, развитии иммунных и аллергических реакций. 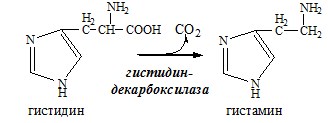 Дофамин. Дофамин образуется (фен → тир → ДОФА → дофамин) в мозге и мозговом веществе надпочечников. 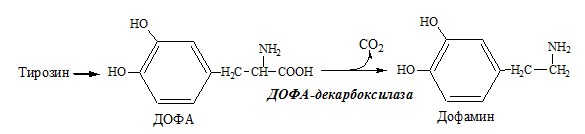 Гликогенные и кетогенные аминокислоты Аминокислоты, которые превращаются в пируват и промежуточные продукты ЦТК (α-КГ, сукцинил-КоА, фумарат) и образуют в конечном итоге оксалоацетат, могут использоваться в процессе глюконеогенеза. Такие аминокислоты относят к группе гликогенных аминокислот. Некоторые аминокислоты в процессе катаболизма превращаются в ацетоацетат (Лиз, Лей) или ацетил-КоА (Лей) и могут использоваться в синтезе кетоновых тел. Такие аминокислоты называют кетогенными. Ряд аминокислот используется и для синтеза глюкозы, и для синтеза кетоновых тел, так как в процессе их катаболизма образуются 2 продукта - определённый метаболит цитратного цикла и ацетоацетат (Три, Фен, Тир) или ацетил-КоА (Иле). Такие аминокислоты называют смешанными, или гликокетогенными. |
