1. Определение понятия фермент
 Скачать 0.71 Mb. Скачать 0.71 Mb.
|
7. Механизм и стадии ферментативного катализа: теории Фишера, Кошланда, переходных состояний.Механизм действия ферментов может быть рассмотрен с двух позиций: с точки зрения изменения энергетики химических реакций и с точки зрения событий в активном центре. А. Энергетические изменения при химических реакциях Любые химические реакции протекают, подчиняясь двум основным законам термодинамики: закону сохранения энергии и закону энтропии. Согласно этим законам, общая энергия химической системы и её окружения остаётся постоянной, при этом химическая система стремится к снижению упорядоченности (увеличению энтропии). Для понимания энергетики химической реакции недостаточно знать энергетический баланс входящих и выходящих из реакции реагентов, необходимо учитывать изменения энергии в процессе данной химической реакции и роль ферментов в динамике этого процесса. Рассмотрим реакцию разложения угольной кислоты: Н2СО3 → Н20 + С02. Угольная кислота слабая; реакция её разложения пойдёт цри обычных условиях, если молекулы угольной кислоты имеют энергию, превышающую определённый уровень, называемый энергией активации Еа (рис. 2-10). Энергией активации называют дополнительное количество кинетической энергии, необходимое молекулам вещества, чтобы они вступили в реакцию. При достижении этого энергетического барьера в молекуле происходят изменения, вызывающие перераспределение химических связей и образование новых соединений. Говорят, что молекулы, обладающие Еа, находятся в переходном состоянии. Разницу энергий между исходным реагентом Н2СО3 и конечными соединениями Н2О и СО2 называют изменением свободной энергии реакции DG. Молекулы Н2О и СО2 - более стабильные вещества, чем Н2СО3, т.е. обладают меньшей энергией и при обычных условиях практически не реагируют. Выделившаяся энергия в результате этой реакции рассеивается в виде тепла в окружающую среду. Чем больше молекул обладает энергией, превышающей уровень Еа, тем выше скорость химической реакции. Повысить скорость химической реакции можно нагреванием. При этом увеличивается энергия реагирующих молекул. Однако для живых организмов высокие температуры губительны, поэтому в клетке для ускорения химических реакций используются ферменты. Ферменты обеспечивают высокую скорость реакций при оптимальных условиях, существующих в клетке, путём понижения уровня Еа. Таким образом, ферменты снижают высоту энергетического барьера, в результате возрастает количество реакционно-способных молекул, следовательно, увеличивается скорость реакции. В механизме ферментативного катализа решающее значение имеет образование нестойких промежуточных соединений - фермент-субстратный комплекс ES, подвергающийся превращению в нестабильный переходный комплекс ЕР, который почти мгновенно распадается на свободный фермент и продукт реакции. Таким образом, биологические катализаторы (ферменты) не изменяют свободную энергию. Фермент, выполняя функцию катализатора химической реакции, подчиняется общим законам катализа и обладает всеми свойствами, характерными для небиологических катализаторов, однако имеет и отличительные свойства, связанные с особенностями строения ферментов. Сходство ферментов с небиологическими катализаторами заключается в том, что:
Отличия ферментов от небиологических катализаторов заключаются в том, что:
Механизмы действия ферментов В общем виде все сводится к комплементарному взаимодействию фермента и субстрата. При этом функциональные группы субстрата взаимодействуют с соответствующими им функциональными группами фермента. Наличие субстратной специфичности объясняют две гипотезы: 1. Теория Фишера (модель "жесткой матрицы", "ключ-замок") – активный центр фермента строго соответствует конфигурации субстрата и не изменяется при его присоединении. Эта модель хорошо объясняет абсолютную специфичность, но не групповую. 2. В 1958 г. Дениел Кошланд предложил модификацию модели «ключ-замок». Ферменты, в основном, — не жесткие, а гибкие молекулы. Активный центр фермента может изменить конформацию после связывания субстрата. Боковые группы аминокислот активного центра принимают такое положение, которое позволяет ферменту выполнить свою каталитическую функцию. В некоторых случаях молекула субстрата также меняет конформацию после связывания в активном центре. В отличие от модели «ключ-замок», модель индуцированного соответствия объясняет не только специфичность ферментов, но и стабилизацию переходного состояния. Эта модель получила название «рука-перчатка». 8. Кинетика ферментативных реакций. Зависимость скорости ферментативных реакций от температуры, рН среды, концентраций фермента, субстрата. Понятие об оптимумах рН и температуры, физиологическое и клинико-диагностическое значение. Определение константы Михаэлиса и ее клинико-диагностическое значение. Кинетикаферментативной реакции (т. е. зависимость скорости реакции от ее условий) определяется в первую очередь свойствами катализатора. Зависимость скорости ферментативной реакции от количества ферментов: При проведении ферментативной реакции в условиях избытка субстрата скорость реакции будет зависеть от концентрации фермента. Графическая зависимость такой реакции имеет вид прямой линии .Однако количество фермента часто невозможно определить в абсолютных величинах, поэтому на практике пользуются условными величинами, характеризующими активность фермента: одна международная единица активности (ME) соответствует такому количеству фермента, которое катализирует превращение 1 мкмоль субстрата за 1 мин при оптимальных условиях проведения ферментативной реакции. Оптимальные условия индивидуальны для каждого фермента и зависят от температуры среды, рН раствора, при отсутствии активаторов и ингибиторов. 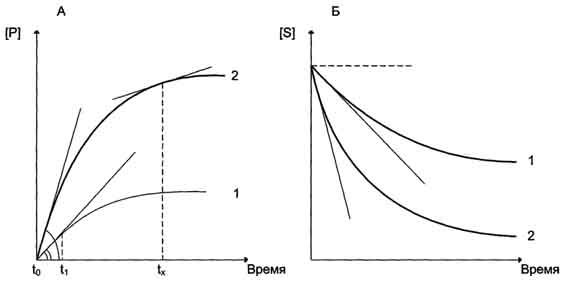  Рис. Зависимость накопления продукта (А) и убыли субстрата (Б) от времени (продолжительности) протекания реакции. Скорость ферментативной реакции определяется изменением концентрации продукта или субстрата за единицу времени. Период ферментативной реакции [t1 - tx] характеризуется нелинейным накоплением продукта (или убылью субстрата) в зависимости от времени реакции.  единица активности ферментов: 1 катал (кат), соответствующий такому количеству катализатора, которое превращает 1 моль субстрата за 1 с. Количество каталов определяют по формуле:
n катал = Международная единица ферментативной активности ME связана с каталом следующими равенствами: 1 кат = 1 моль S/c = 60 моль S/мин = 60х106мкмоль/мин = 6х107ME, 1 ME = 1 мкмоль/мин = 1/60 мкмоль/с = 1/60 мккат = 16,67 нкат. В медицинской практике для оценки активности ферментов часто используют международные единицы активности - ME. Для оценки количества молекул фермента среди других белков данной ткани определяют удельную активность (уд. ак.) фермента, численно равную количеству единиц активности фермента (пМЕ) в образце ткани, делённому на массу (мг) белка в этой ткани: Уд. ак. =
По удельной активности судят об очистке фермента: чем меньше посторонних белков, тем выше удельная активность. 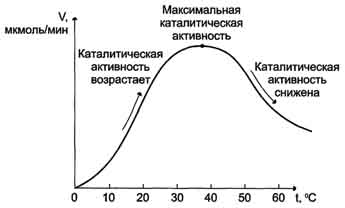 Зависимость скорости ферментативной реакции от температуры среды Повышение температуры до определённых пределов оказывает влияние на скорость ферментативной реакции, подобно влиянию температуры на любую химическую реакцию. С повышением температуры ускоряется движение молекул, что приводит к повышению вероятности взаимодействия реагирующих веществ. Кроме того, температура может повышать энергию реагирующих молекул, что также приводит к ускорению реакции. Однако скорость химической реакции, катализируемая ферментами, имеет свой температурный оптимум, превышение которого сопровождается понижением ферментативной активности, возникающим из-за термической денатурации белковой молекулы. Для большинства ферментов человека оптимальна температура 37-38 °С. Однако в природе существуют и термостабильные ферменты. Например, Taq-полимераза, выделенная из микроорганизмов, живущих в горячих источниках, не инактивируется при повышении температуры до 95 °С. Этот фермент используют в научно-практической медицине для молекулярной диагностики заболеваний с использованием метода полимеразной цепной реакции (ПЦР).  Рис. Зависимость скорости ферментативной реакции (V) от температуры. Зависимость скорости ферментативной реакции от рН среды Для каждого фермента существует значение рН, при котором наблюдается его максимальная активность. Отклонение от оптимального значения рН приводит к понижению ферментативной активности. Влияние рН на активность ферментов связано с ионизацией функциональных групп аминокислотных остатков данного белка, обеспечивающих оптимальную конформацию активного центра фермента. При изменении рН от оптимальных значений происходит изменение ионизации функциональных групп молекулы белка. Например, при закислении среды происходит протонирование свободных аминогрупп (NH3+), а при защелачивании происходит отщепление протона от карбоксильных групп (СОО-). Это приводит к изменению конформации молекулы фермента и конформации активного центра; следовательно, нарушается присоединение субстрата, кофакторов и коферментов к активному центру. Кроме того, рН среды может влиять на степень ионизации или пространственную организацию субстрата, что также влияет на сродство субстрата к активному центру. При значительном отклонении от оптимального значения рН может происходить денатурация белковой молекулы с полной потерей ферментативной активности. Оптимум значения рН у разных ферментов различный. Ферменты, работающие в кислых условиях среды (например, пепсин в желудке или лизосомальные ферменты), приобретают конформацию, обеспечивающую работу фермента при кислых значениях рН. Однако большая часть ферментов организма человека имеет оптимум рН, близкий к нейтральному, совпадающий с физиологическим значением рН . 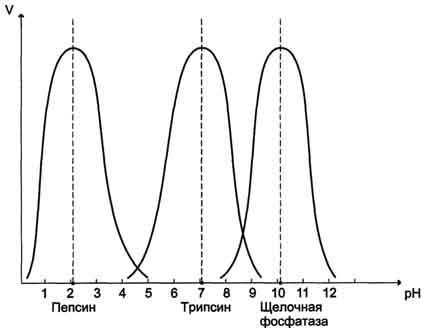 Зависимость скорости ферментативной реакции от количества субстрата Если концентрацию ферментов оставить постоянной, изменяя только количество субстрата, то график скорости ферментативной реакции описывают гиперболой. При увеличении количества субстрата начальная скорость возрастает. Когда фермент становится полностью насыщенным субстратом, т.е. происходит максимально возможное при данной концентрации фермента формирование фермент-субстратного комплекса, наблюдают наибольшую скорость образования продукта. Дальнейшее повышение концентрации субстрата не приводит к увеличению образования продукта, т.е. скорость реакции не возрастает. Данное состояние соответствует максимальной скорости реакции Vmax. Таким образом, концентрация фермента - лимитирующий фактор в образовании продукта. Это наблюдение легло в основу ферментативной кинетики, разработанной учёными Л. Михаэлисом и М. Ментен в 1913 г. Ферментативный процесс можно выразить следующим уравнением:  где k1 - константа скорости образования фермент-субстратного комплекса; k-1 - константа скорости обратной реакции, распада фермент-субстратного комплекса; k2 - константа скорости образования продукта реакции. Следующее соотношение констант скоростей (k-1 + k2)/k1 называют константой Михаэлиса и обозначают Кm. Скорость реакции пропорциональна концентрации фермент-субстратного комплекса ES, a скорость образования ES зависит от концентрации субстрата и концентрации свободного фермента. На концентрацию ES влияет скорость формирования и распада ES. Наибольшая скорость реакции наблюдается в том случае, когда все молекулы фермента находятся в комплексе с субстратом, т.е. в фермент-субстратном комплексе ES, т.е. [Е] = [ES]. Зависимость скорости ферментативной реакции от концентрации субстрата выражается следующим уравнением
V = Это уравнение получило название уравнения Михаэлиса-Ментен. В случае, когда скорость реакции равна половине максимальной, Km = [S] Таким образом, константа Михаэлиса численно равна концентрации субстрата, при которой достигается половина максимальной скорости. Уравнение Михаэлиса-Ментен - основное уравнение ферментативной кинетики, описывающее зависимость скорости ферментативной реакции от концентрации субстрата. Если концентрация субстрата значительно больше Km (S >> Km), to увеличение концентрации субстрата на величину Кm практически не влияет на сумму (Km + S) и её можно считать равной концентрации субстрата. Следовательно, скорость реакции становится равной максимальной скорости: V = Vmax. В этих условиях реакция имеет нулевой порядок, т.е. не зависит от концентрации субстрата. Можно сделать вывод, что Vmax - величина постоянная для данной концентрации фермента, не зависящая от концентрации субстрата. Если концентрация субстрата значительно меньше Km(S << Km), то сумма (Km + S) примерно равна Кm, следовательно, V = Vmax[S]/Km, т.е. в данном случае скорость реакции прямо пропорциональна концентрации субстрата (реакция имеет первый порядок). 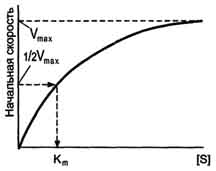 Рис. Зависимость скорости реакции (V) от концентрации субстрата S. Vmах и Km - кинетические характеристики эффективности фермента.
9..Ингибирование активности ферментов, виды ингибирования: обратимое, необратимое, конкурентное, неконкурентное, определение вида ингибирования с использованием Км. Под термином "ингибирование ферментативной активности" понимают снижение каталитической активности в присутствии определённых веществ - ингибиторов. К ингибиторам следует относить вещества, вызывающие снижение активности фермента. Следует отметить, что все денатурирующие агенты также вызывают уменьшение скорости любой ферментативной реакции, вследствие неспецифической денатурации белковой молекулы, поэтому денатурирующие агенты к ингибитррам не относят. Ингибиторы способны взаимодействовать с ферментами с разной степенью прочности. На основании этого различают обратимое и необратимое ингибирование. По механизму действия ингибиторы подразделяют на конкурентные и неконкурентные. А. Обратимое ингибирование Обратимые ингибиторы связываются с ферментом слабыми нековалентными связями и при определённых условиях легко отделяются от фермента. Обратимые ингибиторы бывают конкурентными и неконкурентными. 1. Конкурентное ингибирование К конкурентному ингибированию относят обратимое снижение скорости ферментативной реакции, вызванное ингибитором, связывающимся с активным центром фермента и препятствующим образованию фермент-субстратного комплекса. Такой тип ингибирования наблюдают, когда ингибитор - структурный аналог субстрата, в результате возникает конкуренция молекул субстрата и ингибитора за место в активном центре фермента. В этом случае с ферментом взаимодействует либо субстрат, либо ингибитор, образуя комплексы фермент-субстрат (ES) или фермент-ингибитор (EI). При формировании комплекса фермента и ингибитора (EI) продукт реакции не образуется. Кинетические зависимости Конкурентные ингибиторы уменьшают скорость химической реакции. Конкурентный ингибитор повышает Кm для данного субстрата (уменьшает сродство субстрата к ферменту). Это означает, что в присутствии конкурентного ингибитора необходима большая концентрация субстрата для достижения 1/2 Vmax. Увеличение соотношения концентрации субстрата и ингибитора снижает степень ингибирования. При значительно более высоких концентрациях субстрата ингибирование полностью исчезает, потому что активные центры всех молекул фермента будут находиться преимущественно в комплексе с субстратом. Лекарственные препараты как конкурентные ингибиторы Многие лекарственные препараты оказывают своё терапевтическое действие по механизму конкурентного ингибирования. Антиметаболиты как лекарственные препараты В качестве ингибиторов ферментов по конкурентному механизму в медицинской практике используют вещества, называемые антиметаболитами. Эти соединения, будучи структурными аналогами природных субстратов, вызывают конкурентное ингибирование ферментов, с одной стороны, и, с другой - могут использоваться этими же ферментами в качестве псевдосубстратов, что приводит к синтезу аномальных продуктов. Аномальные продукты не обладают функциональной активностью; в результате наблюдают снижение скорости определённых метаболических путей. В качестве лекарственных препаратов используют следующие антиметаболиты: сульфаниламидные препараты (аналоги парааминобензойной кислоты), применяемые для лечения инфекционных заболеваний, аналоги нуклеотидов для лечения онкологических заболеваний. 2. Неконкурентное ингибирование Неконкурентным называют такое ингибирование ферментативной реакции, при котором ингибитор взаимодействует с ферментом в участке, отличном от активного центра. Неконкурентные ингибиторы не являются структурными аналогами субстрата. Неконкурентный ингибитор может связываться либо с ферментом, либо с фермент-субстратным комплексом, образуя неактивный комплекс. Присоединение неконкурентного ингибитора вызывает изменение конформации молекулы фермента таким образом, что нарушается взаимодействие субстрата с активным центром фермента, что приводит к снижению скорости ферментативной реакции. Кинетические зависимости Этот тип ингибирования характеризуется снижением Vmax ферментативной реакции и уменьшением сродства субстрата к ферменту, т.е. увеличением Кm. |
