1. Определение понятия фермент
 Скачать 0.71 Mb. Скачать 0.71 Mb.
|
|
23. Микросомальное окисление (МСО) –моно - и диоксигеназные пути использования кислорода в клетке: локализация редокс-цепи в эндоплазматическом ретикулуме(ЭПР), биологическое значение. Особенности строения и функции цитохром-p450-оксидазы и цитохром-b5-оксидазы, возрастные особенности и факторы индукции синтеза ферментов. Цитохром р450 в клинической практике. Монооксигеназные реакции Монооксигеназы это ферменты, которые включают в субстрат только один атом молекулы кислорода. Другой атом кислорода восстанавливается до воды с участием электронов и протонов НАДФН2, НАДН2, реже витамин С: S-Н + О2 + RH2 → S-ОН + Н2О + R (где R = НАДФН2, НАДН2, витамин С) Монооксигеназные реакции протекают на цитоплазматической поверхности гладкого ЭПР, их называют микросомальным окислением, и на внутренней поверхности внутренней мембраны митохондрии. Катализируют низкоспецифичные реакции. Диоксигеназные реакции Диоксигеназы это ферменты, которые включают в субстрат оба атома молекулы кислорода: S + О2 → SО2 Таким путем окисляются циклические трудноокисляемые структуры, реакции идут с разрывом цикла. Диоксигеназные реакции протекают на цитоплазматической поверхности гладкого ЭПР. Гомогентизатдиоксигеназа печени, содержит Fe2+, участвует в катаболизме тирозина Цитохром Р450 – интегральный гемопротеин, содержит простетическую группу гем, имеет участки связывания для О2 и субстрата. Открыто 150 генов, кодирующих различные изоформы цитохрома Р450. Каждая из изоформ Р450 имеет много субстратов и отличается от других изоформ Р450 только белковой частью. Цитохром Р450 передает 2 электрона на 1 атом молекулы кислорода, который превращается в О2-, при взаимодействии с 2 протонами О2- дает воду. Второй атом молекулы кислорода включается в субстрат RH, образуя ROH. Цитохром b5. Цитозольный домен содержит гем, гидрофобный домен фиксирует фермент в мембране. Цитохром b5 может передавать свои электроны на различные ферменты (цитохромР450, Стеароил-КоА-десатуразу и т.д.), образуя различные ЦПЭ, при этом он участвует в десатурации и элонгации жирных кислот, в синтезе холестерина, плазминогенов и церамида. 24. Свободно-радикальное окисление (СРО): стадии и реакции образования активных форм О2 (супероксид, пероксид, гидроксид - радикал), факторы инициации. Значение в физиологии и патологии клетки пероксидазного и радикального пути использования кислорода. Образование активных форм кислорода АФК во многих клетках образуются в основном в ферментативных и неферментативных реакциях в результате последовательного присоединения е- к кислороду:
Ферментативные реакции образования АФК Электроны, необходимые для образования АФК могут давать ЦПЭ. Утечка е- из ЦПЭ на кислород является основным путем образования АФК в большинстве клеток:
Неферментативные реакции образования АФК Электроны, необходимые для образования АФК могут давать: 1). Металлы переменной валентности. Наличие в клетках Fe2+ или ионов других переходных металлов катализирует образования АФК. Например, в эритроцитах окисление иона железа гемоглобина способствует образованию супероксидного анион-радикала. Hb(Fe2+) + O2 → MetHb(Fe3+) + О∙2 2). Радикалы. АФК, обмениваясь электроном, легко переходят друг в друга: О∙2 + Н2О2 → О2 + НО∙ + ОН- АФК также могут образовываться в организме неферметативно при гомолитическом разрыве связей под действием ионизирующего излучения. Ионизирующее излучение вызывает например, радиолиз воды с образованием Н2; Н2О2 и свободных радикалов: Н·, НО∙, О·.(фотостарение) Кислородные радикалы, обладая высокой активностью, разрушают органические молекулы в реакциях свободно-радикального окисления (СРО). Большая часть этих реакций протекает с полиненасыщенными жирными кислотами липидов, и называется перекисным окислением липидов (ПОЛ). Значение в клетке: Использование активных форм кислорода в организме 1. Иммунная система. АФК используются фагоцитарными клетками - тканевыми макрофагами, моноцитами и гранулоцитами крови для разрушения бактерий, вирусов и онкоклеток.
При дефиците в клетках СОД, ферритина, а в плазме церулоплазмина, трансферрина активируются альтернативные реакции:
Фактор некроза опухоли 2. Поддержание гомеостаза. Эйказаноиды – медиаторы воспаления 3. Внутриклеточное пищеварение. В пероксисомах образуются АФК. Когда пероксисомы сливаются с фагосомами, АФК обеспечивают внутриклеточное пищеварение. Повреждающее действие активных форм кислорода в организме Радикалы гидроксила химически исключительно активны и вызывают повреждение белков, нуклеиновых кислот и липидов биологических мембран. В белках происходит неферментативное окисление аминокислотных остатков гистидина, цистеина, триптофана. Таким образом, инактивируют многие ферменты. Особенно тяжелые последствия имеют повреждение ДНК и липидов. Радикалы НО∙ вызывают разрыв нитей ДНК, обладая, в зависимости от ситуации, мутагенным, канцерогенным или цитостатическим действием. Радикалы гидроксила инициируют цепную реакцию ПОЛ, при этом нарушаются физико-химические свойства мембран - проницаемость, рецепторная функция и работа мембранных белков. Повреждение барьера приводит к нарушению регуляции внутриклеточных процессов и тяжелым расстройствам клеточных функций. Свободно-радикальные реакции часто вызывают гибель клеток и целом ускоряют процесс старения организма. 25. Биохимические механизмы ферментативной и неферментативной антиоксидантной защиты (АОЗ), возрастные особенности. Природные и синтетические прооксиданты и антиоксиданты, понятия. В нормальных условиях процесс СРО (свободно-радикальное окисление) находится под строгим контролем ферментативных и неферментативных систем клетки, от чего скорость его невелика. Химические соединения и физические воздействия, влияющие на скорость СРО, делят на прооксиданты и антиоксиданты. Прооксиданты усиливают процессы СРО. Это высокие концентрации кислорода (например, при длительной гипербарической оксигенации больного), ферментные системы, генерирующие супероксидные радикалы (например, ксантиноксидаза, ферменты плазматической мембраны фагоцитов и др.), ионы двухвалентного железа. Антиоксиданты тормозят СРО. Антиоксиданты бывают природные и синтетические. Природные содержатся в овощах, фруктах, ягодах, орехах, травах и других продуктах питания. Синтетические – в лекарственных препаратах и БАДах (хотя БАДы тоже бывают натуральными, нужно просто в этом разбираться), а также в пищевых добавках Е (нумерация от 300 до 399), которые добавляются в продукты для того, чтобы они могли дольше храниться. Синтетические антиоксиданты нужны лишь для того, чтобы замедлять процессы окисления в продуктах, и не полезны для здоровья человека (за исключением тех, что содержатся в выверенных дозах в лекарственных препаратах и применяются в ограниченных случаях по рекомендации врача). Более того, некоторые из них могут вызывать аллергию, приступы астмы, отеки и атеросклероз. Антиоксиданты, находящиеся в организме, образуют его ферментативную и неферментативную антиоксидантную систему. 1. Ферментативная антиоксидантная защита К ферментам, защищающим клетки от действия активных форм кислорода, относят супероксиддисмутазу, каталазу и глутатионпероксидазу. Наиболее активны эти ферменты в печени, надпочечниках и почках, где содержание митохондрий, цитохрома Р450 и пероксидом особенно велико. Супероксиддисмутаза (СОД) превращает супероксидные анионы в перекись водорода: 2О∙2 + 2H+ → H2O2+ O2 Изоферменты СОД находятся и в цитозоле (Cu2+ и Zn2+) и в митохондриях (Mn2+) и являются как бы первой линией защиты, потому что супероксидный анион образуется обычно первым из активных форм кислорода. СОД — индуцируемый фермент, т.е. синтез его увеличивается, если в клетках активируется СРО. Каталаза - геминовый фермент, катализирует реакцию разрушения перекиси водорода. При этом образуется вода и молекулярный кислород: 2Н2О2 → H2O+ O2 Каталаза находится в основном в пероксисомах, где образуется наибольшее количество перекиси водорода, а также в лейкоцитах, где она защищает клетки от последствий «респираторного взрыва» и в эритроцитах, где она защищает гем гемоглобина от окисления. Глутатионпероксидаза — обеспечивает разрушение перекиси водорода и гидропероксидов липидов при окислении глутатиона (у-глутамилцистеинилглицин): Н2О2 + 2 GSH → 2 Н2О + G-S-S-G. Глутатионпероксидаза в качестве кофермента содержит селен. Глутатионредуктаза восстанавливает окисленный глутатион с участием НАДФН2: GS-SG + НАДФН2 → 2 GSH + НАДФ+. Недостаток глутатиона в клетках, например эритроцитах, который может быть обусловлен действием токсических веществ, например ионами тяжелых металлов или наследственным недостатком глутатионредуктазы приводит к активации перекисного окисления; это, в частности, наблюдается при некоторых видах гемолитических анемий. Фосфолипаза в мембране отщепляет от фосфолипидов окисленные жирные кислоты, содержащие гидроперекисную группу (LOOH), тем самым разрушаются гидроперекиси липидов, предотвращается разветвление цепей окисления липидов в мембранах. 2. Неферментативная антиоксидантная защита "Липидные антиоксиданты" - производные фенола, способны инактивировать свободные радикалы в гидрофобном слое мембран. К ним относится α-токоферол (витамин Е), убихинон (коэнзим Q), тироксин и синтетические соединения, например ионол (бутилированный гидрокситолуол). Витамин Е (α-токоферол) самый распространённый липофильный антиоксидант, он обеспечивает защиту мембран от СРО. Различают 8 типов токоферолов, но α-токоферол наиболее активен. α-Токоферол отдаёт атом водорода радикалу липида ROO∙, восстанавливает его до гидропероксида (ROOH), а сам превращается в малоактивный свободный радикал, что прерывает ПОЛ: 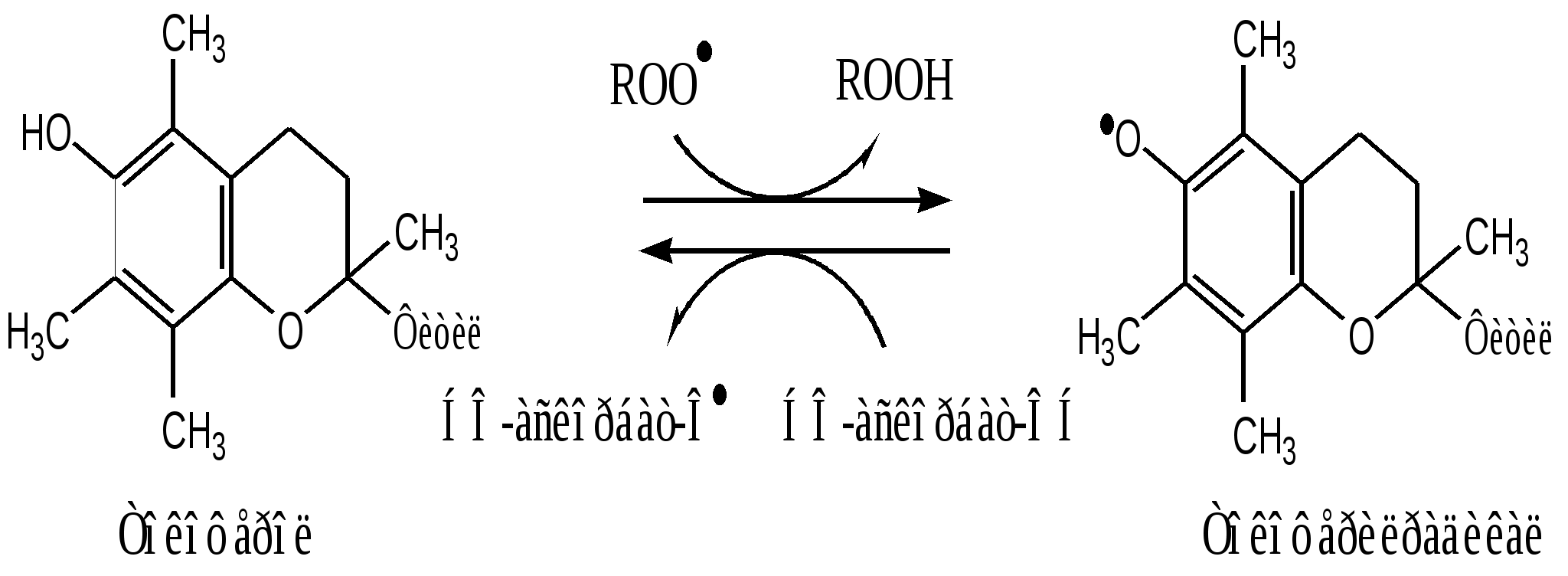 Регенерацию α-токоферола осуществляет витамин С. Свободный радикал витамина Е стабилен и не поддерживает ПОЛ, он взаимодействует с радикалами липидных перекисей, восстанавливает их, а сам превращается в стабильную окисленную форму — токоферолхинон. 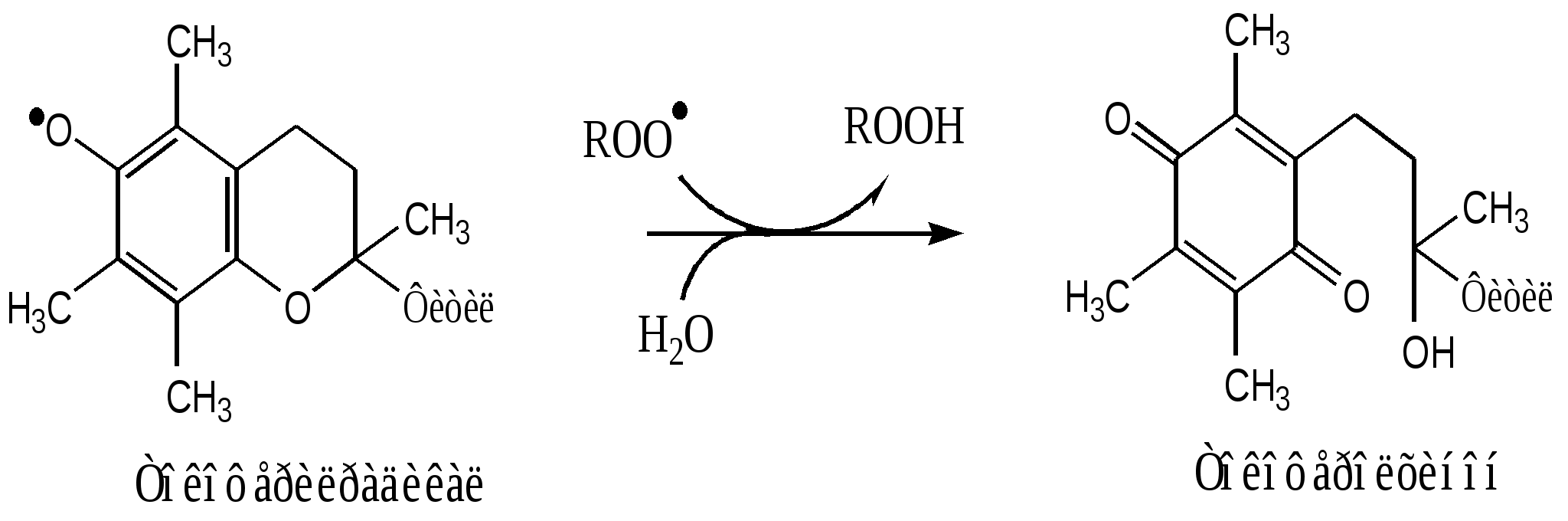 Витамин С ингибирует СРО с помощью двух различных механизмов: 1). восстанавливает в мембранах токоферолхинон до витамина Е: НО-аскорбат-ОН + α-ТФ-О· → α-ТФ-ОН + НО-аскорбат-О· (семидегидроаскорбиновая к-та) НО-аскорбат-О· + α-ТФ-О· → α-ТФ-ОН + О=аскорбат=О (дегидроаскорбиновая к-та) Регенерация аскорбиновой кислоты идет с участием ферментативных систем: а). В микросомах, с участием комплекса НАДН2-редуктаза-цитохром b5: 2НО-аскорбат-О· + НАДН2 → 2НО-аскорбат-ОН + НАД+ б). В митохондриях, с участием НАДН2-семидегидроаскорбатредуктазы: 2НО-аскорбат-О· + НАДН2 → 2НО-аскорбат-ОН + НАД+ в). В цитозоле, с участием НАДФН2-дегидроаскорбатредуктазы: О=аскорбат=О + 2НАДФН2 → НО-аскорбат-ОН + 2НАДФ+ г). В цитозоле, с участием GSH-дегидроаскорбатредуктазы: О=аскорбат=О + 2GSH → НО-аскорбат-ОН + GS-SG 2). взаимодействует с активными формами кислорода — О∙2, Н2О2, НО∙ и инактивирует их. β-Каротин, предшественник витамина А, также обладает антиоксидантным действием и ингибирует ПОЛ. Для детоксикации двухвалентного железа в организме существует, по-видимому, целая система окисления и связывания ионов железа. В плазме крови эта система представлена ферментом церрулоплазмином (феррооксидазой), который окисляет Fe2+ до Fe3+ кислородом без образования свободных радикалов, и белком трансферрином, который связывает и переносит в кровяном русле ионы трехвалентного железа, которые затем захватывается клетками. В клетках железо может восстанавливаться аскорбиновой кислотой и другими восстановителями, но затем окисляется и депонируется в окисленной форме внутри ферментного белкового комплекса ферритина. |
