1.Переваривание и всасывание белков в пищеварительном тракте животных Белки начинают перевариваться в желудке. Белки, попадающие в желудок, стимулируют выделение гормона гастрина эпителиальными клетками желудка. Гастрин вызывает секрецию соляной кислоты обкладочными клетками желез слизистой желудка, а также пепсиногена главными клетками. Желудочный сок имеет рН от 1,5 до 2,5. Он действует как антисептик, убивая большинство бактерий. Кроме того, глобулярные белки подвергаются денатурации, их молекулы разворачиваются и вследствие этого внутренние пептидные связи полипептидных цепей становятся более доступными для ферментативного гидролиза. Пепсиноген превращается в активный пепсин путем автокатализа. В желудке пепсин гидролизует по карбоксильной группе те пептидные связи, которые образованы в основном ароматическими аминокислотами. В итоге из длинных полипептидных цепей образуется смесь более коротких пептидов. Как только кислое содержимое желудка попадает в тонкий кишечник, в нем под влиянием низкого рН начинается секреция гормона секретина, поступающего в кровь. Этот гормон вызывает выделение из поджелудочной железы в тонкий кишечник бикарбоната, что приводит к нейтрализации рН желудочного сока. В тонком кишечнике переваривание белков продолжается. Поступление аминокислот в двенадцатиперстную кишку вызывает высвобождение гормона холецистокинина, который стимулирует секрецию нескольких ферментов поджелудочной железы с оптимумом в слабощелочной среде. Трипсиноген подвергается активированию с помощью фермента энтерокиназы, синтезируемой клетками кишечника, а также автокаталитически. Трипсин катализирует гидролиз полипептидов по карбоксильным группам остатков лизина и аргинина. Химотрипсиноген активируется трипсином. Химотрипсин гидролизует пептиды по карбоксильным группам ароматических аминокислот. Карбоксипептидаза синтезируется в поджелудочной железе в виде неактивного зимогена прокарбоксипептидазы и осуществляет последовательное отщепление С-концевых остатков. Аминопептидаза синтезируется клетками тонкого кишечника и осуществляет последовательное отщепление N-концевых остатков за исключением пролина. Дипептидаза гидролизует дипептиды. В конце концов, свободные аминокислоты транспортируются через эпителиальные клетки, выстилающие тонкий кишечник, проникают в капилляры ворсинок и переносятся кровью в печень.
2. Особенности превращения азотсодержащих веществ в пищеварительном тракте животных. У жвачных желудок многокамерный. Сычуг является железистым желудком, вырабатывает сок, сод. НСl, пепсин, куда поступает около трети белков корма. Большая часть белков подвергается воздействию ферментов бактерий и инфузорий в преджелудках с обр. аминокислот, часть которых используется на синтез белков микр. клетки, а другая часть распадается до аммиака. Он может идти на синтез аминокислот или в печень для синтеза мочевины. Мочевина поступать в рубец с кормом и из крови. С ферментом уреазы бактерий она гидролизируется с образованием свободного аммиака, СО2 и воды. При распаде мочевина служит источником для синтеза заменимых и незаменимых аминок-т микрофлоры, заменяя таким образом определенный процент аминокислот корма.
3.Процессы гниения в кишечнике животных. ЦЕЛИАКИЯ – наследственное прогрессирующее заболевание, приводящее к изменениям в тощей кишке: воспалению и сглаживанию слизистой оболочки, исчезновению ворсинок, атрофии щеточной каемки и появлению кубовидных энтероцитов. Причиной является врожденная непереносимость белка клейковины злаков глютена, или точнее – его растворимой фракцииглиадина. Заболевание проявляется после введения в рацион младенца глиадинсодержащих продуктов, в первую очередь манной каши. Патогенез заболевания до сих пор не выяснен, имеются гипотеза о прямом токсическом воздействии на стенку кишечника и гипотеза иммунного ответа на белок в стенке кишки. ГНИЕНИЕ БЕЛКОВ В КИШЕЧНИКЕ. При ухудшении всасывания аминокислот, при избытке белковой пищи, при нарушении деятельности пищеварительных желез недопереваренные фрагменты белков достигают толстого кишечника, где подвергаются воздействию кишечной микрофлоры. Этот процесс получил название гниение белков в кишечнике. При этом образуются продукты разложения аминокислот, представляющие собой кактоксины (кадаверин, путресцин, крезол, фенол, скатол, индол, пиперидин, пирролидин, сероводород и метилмеркаптан (СН3SН)), так инейромедиаторы (серотонин, гистамин, октопамин, тирамин). Гниение белков также активируется при снижении перистальтики кишечника (запоры).
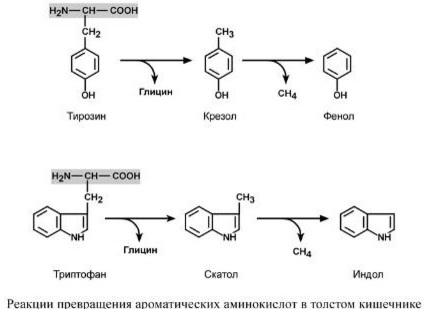
В процессе переваривания в желудке и тонком кишечнике основная масса белков расщепляется и всасывается преимущественно в виде аминокислот. Однако часть белков сухожилий, апоневрозом кожи, которые трудно перевариваются, и некоторое количество свободных аминокислот поступают в толстую кишку. При многих заболеваниях, особенно при кишечных инфекций, переваривание и всасываемого белков ухудшается, поэтому большинство из них попадает в толстый кишечник. Зависимости от количества пищевых продуктов и состояния аппарата пищеварения количество нерасщепленных белков может составлять от 2-3 до 5-10%, а иногда и больше. Толстый кишечник населенный микроорганизмами, которые используют пищевые аминокислоты для своего роста. Они ферментные системы, катализирующие различные превращения пищевых белков и свободных аминокислот (гидролиз, окисление, восстановление, дезаминирование, декарбоксилирование, деметилирования). Поэтому в толстом кишечнике создаются оптимальные условия для образования ядовитых продуктов распада аминокислот, в частности фенола, индола, крезола, скатол, сероводорода, метилмеркаптана, а также нетоксичных для организма соединений - спиртов, жирных кислот, кетокислот, гидроксикислоты и др.. Все эти преобразования аминокислот, обусловленные деятельностью микроорганизмов кишечника, получили общее название: гниение белков в кишечнике. В процессе постепенного и глубокого распада серосодержащих аминокислот (цистина, цистеина и метионина) в кишечнике образуются сероводород (H2S) и метилмеркаптан (CH3SH). Диаминокислоты испытывают процесса декарбоксилирования с образованием аминов. Два из них - путресцин и кадаверин - давно известны через их неприятный запах. Путресцин (putrificatio - гниение, лат.) - Образуется при декарбоксилировании орнитина, а кадаверин (cadaver - труп, лат.) - При декарбоксилировании лизина. Путресцин может образовываться и другим путем, а именно: в результате декарбоксилирования аргинина, с образованием агматину. Последний превращается в путресцин в ходе реакции, которая катализируется аг-матинуреагидролазою, которую также содержит кишечная палочка. Агматин является биологически активным диамином. Он способен вызвать снижение содержания сахара в крови.
Путресцин и кадаверин, вероятнее всего, обезвреживаются в клетках слизистой оболочки кишечника под действием специфических диамино-оксидаз, после чего легко всасываются в кровь и выделяются с мочой. Из циклических аминокислот тирозина и триптофана при последовательном разрушения их боковой цепи в результате реакции декарбоксилирования, дезаминирования, а затем и деметилирования образуются токсичные продукты: крезол и фенол - с тирозина, скатол и индол - с триптофана. Этот тест успешно используется в клинико-биохимических исследованиях. Таким образом, организм человека и животных имеет ряд защитных механизмов синтеза, биологическая роль которых заключается в обезвреживании токсических продуктов, которые поступают в организм извне или образующихся в кишечнике из продуктов питания благодаря жизнедеятельности микроорганизмов.
4.Реакции превращения аминокислот.
1. Общие пути превращения аминокислот реакции дезаминирования,трансаминирования, декарбоксилирования.
Дезаминирование ( отщепление аминогруппы) – существ 4 типа реакций,катализируемых своими ферментами. Восстановительное дезаминорование ( +2H+); Гидролитическое дезаминированиие (+H2О);Внутримолекулярное дезаминирование; Окислительное дезаминирование (+1/2 О2). Во всех случаях NH2- группа аминокислоты высвобождается в виде аммиака. Помимо аммиака продуктами дезаминирования являются жирные кислоты, оксикислоты и кетокислоты.
Трансаминирование – реакции межмолекуляр переноса аминогруппы (NH2) от аминокислоты на α-кетокислоту без промежуточного образования аммиака (глутамат+ пируват = α-кетоглутарат + аланин). Реакции трансаминирования являются обратимыми и универсальными для всех живых организмов, они протекают при участии специфических ферментов – аминотрансфераз (трансамниназ). Декарбоксилирование - отщепление карбоксильной группы в виде СО2, образующиеся продукты реакции называются биогенными аминами, они оказывают сильное фармакологическое действие на множество функций. Эти реакции являются необратимыми. Окислительное дезаминирование.Наиболее активно в тканях происходит дезаминирование глутаминовой кислоты. Реакцию катализирует фермент глутаматдегидрогеназа, коферментом глутаматдегидрогеназы является NAD+. Реакция идёт в 2 этапа. Глутаматдегидрогеназа очень активна в митохондр клеток практически всех органов, кроме мышц. Глутаматдегидрогеназа играет важную роль, так как является регуляторным ферментом аминокислотного обмена.
Значение этих реакций в обмене аминокислот очень велико, так как непрямое дезаминирование - основной способ дезаминирования большинства амк. Обе стадии непрямого дезаминирования обратимы, что обеспечивает как катаболизм ,так и возможность образования практически любой амк из соответствующей α-кетокислоты В организме человека наибольшее значение имеют две аминотрансферазы: аспартатаминотрансфераза (АСТ или АсАТ) и аланинаминотрансфераза (АЛТ или АлАТ). Особенно важное значение имеет определение активности аминотрансфераз для диагностики заболеваний печени. Некроз или повреждение печеночных клеток любой этиологии 2. Сурфактант — внеклеточный липидный слой с небольшим количеством гидрофобных белков, выстилающий поверхность легочных альвеол и предотвращающий слипание стенок альвеол во время выдоха. Основной компонент сурфактанта — дипальмитоилфосфатидилхолин. Синтез дипальмитоилфосфатидилхолина в пневмоцитах происходит в процессе эмбрионального развития и резко увеличивается в период от 32 до 36 нед. беременности. Недостаточное формирование сурфактанта у недоношенных детей после рождения приводит к развитию респираторного дистресс-. синдрома. В случае необходимости применяется ингаляции с сурфактантами
5.Связывание (обезвреживание) аммиака. Высокая интенсивность процессов дезаминирования аминокислот в тканях и очень низкий уровень аммиака в крови свидетельствуют о том, что в клетках активно происходит связывание аммиака с образованием нетоксичных соединений, которые выводятся из организма с мочой. Эти реакции можно считать реакциями обезвреживания аммиака. В разных тканях и органах обнаружено несколько типов таких реакций. Основной реакцией связывания аммиака, протекающей во всех тканях организма, является синтез глутамина под действием глутамин-синтетазы: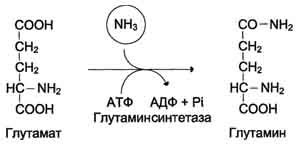
Глутаминсинтетаза локализована в митохондриях клеток, для работы фермента необходим кофактор - ионы Mg2+. Глутаминсинтетаза - один из основных регуляторных ферментов обмена аминокислот и аллостерически ингибируется АМФ, глюкозо-6-фосфатом, а также Гли, Ала и Гис.
Глутамин легко транспортируется через клеточные мембраны путём облегчённой диффузии (для глутамата возможен только активный транспорт) и поступает из тканей в кровь. Основными тканями-поставщикам:и глутамина служат мышцы, мозг и печень. С током крови глутамин транспортируется в кишечник и почки. В клетках кишечника под действием фермента глутаминазы происходит гидролитическое освобождение амидного азота в виде аммиака:
Образовавшийся в реакции глутамат подвергается трансаминированию с пируватом. ос-Аминогруппа глутаминовой кислоты переносится в состав аланина (рис. 9-10). Большие количества аланина поступают из кишечника в кровь воротной вены и поглощаются печенью. Около 5% образовавшегося аммиака удаляется в составе фекалий, небольшая часть через воротную вену попадает в печень, остальные 90% выводятся почками.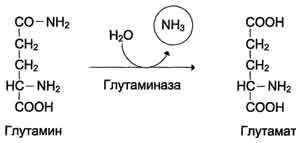
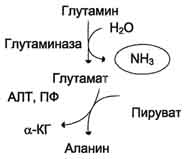
Рис. 9-10. Метаболизм азота глутамина в кишечнике.
В почках также происходит гидролиз глутамина под действием глутаминазы с образованием аммиака. Этот процесс является одним из механизмов регуляции кислотно щелочного равновесия в организме и сохранения важнейших катионов для поддержания осмотического давления. Глутаминаза почек значительно индуцируется при ацидозе, образующийся аммиак нейтрализует кислые продукты обмена и в виде аммонийных солей экскретируется с мочой (рис. 9-11). Эта реакция защищает организм от излишней потери ионов Na+ и К+, которые также могут использоваться для выведения анионов и утрачиваться. При алкалозе количество глутаминазы в почках снижается. В почках образуется и выводится около 0,5 г солей аммония в сутки. Высокий уровень глутамина в крови и лёгкость его поступления в клетки обусловливают использование глутамина во многих анаболических процессах. Глутамин - основной донор азота в организме. Амидный азот глутамина используется для синтеза пуриновых и пиримидиновых
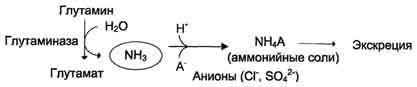
Рис. 9-11. Метаболизм амидного азота глутамина в почках.
нуклеотидов, аспарагина, аминосахаров и других соединений (рис. 9-12).
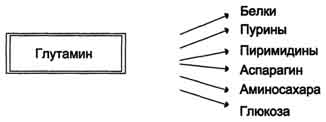
Рис. 9-12. Пути использования глутамина в организме.
Ещё одной реакцией обезвреживания аммиака в тканях можно считать синтез аспарагина под действием аспарагинсинтетазы.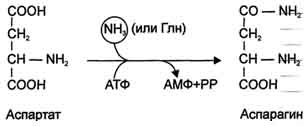
Существуют 2 изоформы этого фермента - глутаминзависимая и аммиакзависимая, которые используют разные доноры амидных групп. Первая функционирует в животных клетках, вторая преобладает в бактериальных клетках, но присутствует и у животных. Однако такой путь обезвреживания аммиака в клетках человека используется редко и к тому же требует больших энергетических затрат (энергию двух макроэргических связей), чем синтез глутамина.
Наиболее значительные количества аммиака обезвреживаются в печени путём синтеза мочевины. В первой реакции процесса аммиак связывается с диоксидом углерода с образованием карбамоилфосфата, при этом затрачиваются 2 молекулы АТФ. Реакция происходит в митохондриях гепатоцитов под действием фермента карбамоилфос-фатсинтетазы I. Карбамоилфосфатсинтетаза II локализована в цитозоле клеток всех тканей и участвует в синтезе гшримидиновых нуклеотидов (см. раздел 10). Карбамоилфосфат затем включается в орнитиновый цикл и используется для синтеза мочевины.
В мозге и некоторых других органах может протекать восстановительное аминирование α-кетоглутарата под действием глутаматдегидрогеназы, катализирующей обратимую реакцию. Однако этот путь обезвреживания аммиака в тканях используется слабо, так как глутаматдегидрогеназа катализирует преимущественно реакцию дезаминирования глутамата. Хотя, если учитывать последующее образование глутамина, реакция выгодна для клеток, так как способствует связыванию сразу 2 молекул NH3.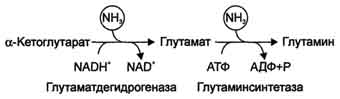
Из мышц и кишечника избыток аммиака выводится преимущественно в виде аланина. Этот механизм необходим, так как активность глутаматдегидрогеназы в мышцах невелика и непрямое дезаминирование аминокислот малоэффективно. Поэтому в мышцах существует ещё один путь выведения азота. Образование аланина в этих органах можно представить следующей схемой (см. схему ниже).
Аминогруппы разных аминокислот посредством реакций трансаминирования переносятся на пируват, основным источником которого служит процесс окисления глюкозы.
Мышцы выделяют особенно много аланина в силу их большой массы, активного потребления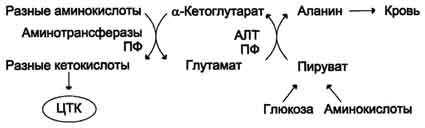
Схема
глюкозы при физической работе, а также потому, что часть энергии они получают за счёт распада аминокислот. Образовавшийся аланин поступает в печень, где подвергается непрямому дезаминированию. Выделившийся аммиак обезвреживается, а пируват включается в глюконеогенез. Глюкоза из печени поступает в ткани и там, в процессе гликолиза, опять окисляется до пирувата (рис. 9-13).
Образование аланина в мышцах, его перенос в печень и перенос глюкозы, синтезированной в печени, обратно в мышцы составляют глюкозо-аланиновый цикл, работа которого сопряжена с работой глюкозо-лактатного цикла (см. раздел 7).
Совокупность основных процессов обмена аммиака в организме представлена на рис. 9-14. Доминирующими ферментами в обмене аммиака служат глутаматдегидрогеиаза и глутаминсинтетаза.
7. Синтез гемоглобина. Почти на 85% биосинтез гема происходит в костном мозге и лишь небольшая часть — в печени. В синтезе гема участвуют митохондрии и цитоплазма. Гем и глобин синтезируются по отдельности. Затем соединяются, и образуется третичная и четвертичная структура гемоглобина.
СИНТЕЗ ГЕМА Рисунок 1
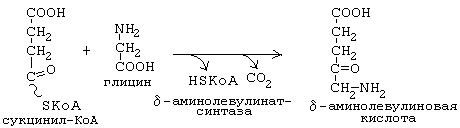
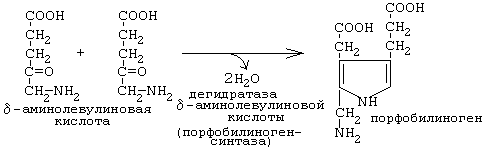
Синтез тетрагидропиррольных колец начинается в митохондриях (рис.1). Из сукцинил-КоА конденсацией с глицином получается продукт, декарбоксилирование которого приводит к 5-аминолевулинату (ALA). Отвечающая за эту стадию 5-аминолевулинат-синтаза (ALA-синтаза) является ключевым ферментом всего пути. Коферментом дельта-аминолевулинатсинтазы является пиридоксаль-фосфат (производное витамина В6). Фермент ингибируется по принципу отрицательной обратной связи избытком гема. После синтеза 5-аминолевулинат переходит из митохондрий в цитоплазму, где две молекулы конденсируются в порфобилиноген (рис. 3), который уже содержит пиррольное кольцо . Порфобилиногенсинтаза ингибируется ионами свинца. Поэтому при острых отравлениях свинцом в крови и моче обнаруживают повышенные концентрации 5-аминолевулината.
Рисунок 3
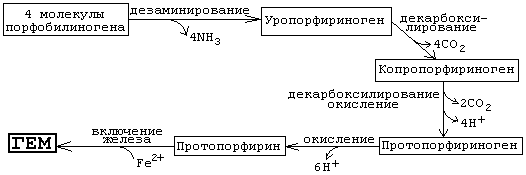
Порфобилиногенсинтаза тоже угнетается избытком гема. На последующих стадиях образуется характерная для порфирина тетрапиррольная структура. Связывание четырех молекул порфобилиногена с отщеплением NH2-групп и образованием уропорфириногена III катализируется гидроксиметилбилан-синтазой. Для образования этого промежуточного продукта необходим второй фермент, уропорфириноген III-синтаза. Отсутствие этого фермента приводит к образованию «неправильного» изомера — уропорфириногена I. Тетрапиррольная структура уропорфиринoгена III все еще существенно отличается от гема. Так, отсутствует центральный атом железа, а кольцо содержит только 8 вместо 11 двойных связей. Кроме того, кольца несут только заряженные боковые цепи R (4 ацетатных и 4 пропионатных остатков). Так как группы гема в белках функционируют в неполярном окружении, необходимо, чтобы полярные боковые цепи превратились в менее полярные. Вначале четыре ацетатных остатка (R1) декарбоксилируются с образованием метильных групп . Образующийся копропорфириноген III снова возвращается в митохондрии. Дальнейшие стадии катализируются ферментами, которые локализованы на/или внутри митохондриальной мембраны. Прежде всего под действием оксидазы две пропионатные группы (R2) превращаются в винильные . Модификация боковых цепей заканчивается образованием протопорфириногена IX. На следующей стадии за счет окисления в молекуле создается сопряженная π-электронная система, которая придает гему характерную красную окраску. При этом расходуется 6 восстановительных эквивалентов. В заключение с помощью специального фермента, феррохелатазы, в молекулу включается атом двухвалентного железа. Образованный таким образом гем или Fe-протопорфирин IX включается, например, в гемоглобин и миоглобин, где он связан нековалентно, или в цитохром С, с которым связывается ковалентно.
Рисунок 4
Источник железа - белок ферритин. В комплексе с ферритином в организме хранится (депонируется) резерв железа
8. Распад гемоглобина. Желчные пигменты. Распад гемоглобина За сутки в организме человека распадается около 9г гемпротеидов, главным образом в результате распада гемоглобина эритроцитов. Эритроциты живут 100-120 дней, распад их происходит либо в кровеносном русле, либо в селезенке. Гемоглобин, освобождающийся из эритроцитов в крови, связывается гаптоглобином и в виде комплекса гемоглобин-гаптоглобин попадает в клетки системы мононуклеарных фагоцитов, главным образом селезенки. Гемоглобин окисляется в метгемоглобин (Fe3+). Гаптоглобин при этом отщепляется и переходит в кровь, а гемоглобин подвергается распаду. Под действием гемоксигеназы происходит окислительное расщепление метинового мостика гема, кольцевая структура гема разрывается и образуется вердоглобин. Вердоглобин теряет:
- железо, которое связывается белком-переносчиком трансферрином и доставляется с кровью в костный мозг;
- глобин, который гидролизуется катепсинами селезенки до аминокислот.
Таким образом, вердоглобин превращается в биливердин (пигмент зеленого цвета), при восстановлении которого образуется билирубин - пигмент красно-желтого цвета. Это свободныйбилирубин (непрямой, неконъюгированный). Свободный билирубин - токсичен и плохо растворим в воде, не проникает через почечный барьер. Непрямым билирубин называется потому, что с реактивом Эрлиха он дает непрямую реакцию (после предварительной обработки крови сыворотки спиртом). Свободный билирубин, поступая в кровь, связывается белком плазмы альбумином и с током крови поступает в клетки печени, где он легко проникает через мембрану клеток, освобождаясь от альбумина. В печени билирубин под действием фермента УДФ-глюкуронилтрансферазы связывается с глюкуроновой кислотой, при этом образуются билирубинглюкурониды или связанный (конъюгированный, прямой билирубин). Связанный билирубин – нетоксичен, растворим в воде, проникает через почечный барьер. Прямой билирубин с реактивом Эрлиха дает прямую реакцию. Билирубинглюкурониды могут диффундировать в кровеносные капилляры в незначительных количествах, поэтому в плазме на их долю приходится 25% от общего билирубина, а на долю свободного - 75%. В желчных протоках происходит отщепление остатков глюкуроновой кислоты от связанного билирубина и в таком виде он поступает в кишечник, где подвергается многократному восстановлению под действием ферментов микрофлоры. В тонком кишечнике билирубин превращается в мезобилирубин, затем мезобилиноген (или уробилиноген), который всасывается в тонком кишечнике и через воротную вену поступает в печень, где уробилиноген необратимо разрушается до моно- и дипирролов. В толстом кишечнике мезобилиноген восстанавливается анаэробными бактериями до стеркобилиногена. Большая часть стеркобилиногена выделяется с фекалиями и быстро окисляется кислородом воздуха до стеркобилина, определяя цвет фекалий. Небольшие количества стеркобилиногена всасываются в прямой кишке и через систему геморроидальных вен, минуя печень, поступают с током крови в почки, которые выводят его с мочой. Стеркобилиноген мочи окисляется в стеркобилин, частично определяя нормальный соломенно-желтый цвет мочи. В норме содержание общего билирубина в сыворотке крови составляет 8-20,5 мкмоль/л (из них 75% свободного). Стеркобилиноген выделяется у человека в основном с калом (примерно 300 мг в сутки) и в незначительных количествах с мочой (около 1-4 мг в сутки).
9. Синтез пуриновых основания Для синтеза пуриновых основания необходимо 5 веществ, углекислый газ, глицин, муравьина кислота, аспарагиновая кислота и глутамин. Исходным веществом для биосинтеза служит 5 фосфорибозилпирофсофат, который образуется из рибозо5фосфата и АТФ, катализируется киназой ФРПФ является матрицей на которой в результате 11 реакций синтезируется инозиновая кислота являющееся промежуточным продуктом образования пуриновых нуклеотидов. А)Глицин – 4 и 5 углерод и 7 азот. Б)Муравьина кислота 2 и 8 углерод В)Глутамин 3 и 9 азот. Г)Аспарагин 1 азот, Д)СО2 6 углерод.
Инозиновая кислота используется в дальнейшем для биосинтеза сначала адениловой и гуаниловой кислот, а затем нуклеиновых кислот
1.инозиновая кислота + аспарагиновая к-та =адениловая к-та 2.инозиновая + глутаминовая = гуаниловая 3.инозиловая – мочевая кислота
Биосинтез пуриновых нуклеотидов. В отличие от многих других синтетических процессов, биосинтез пуриновых нуклеотидов происходит чаще всего не при взаимодействии соответствующих веществ, входящих в состав этих нуклеотидов (пуриновых оснований, рибозы, дезоксирибозы и фосфорной кислоты), а в результате более сложных реакций. Оказалось, что исходным соединением при биосинтезе нуклеотидов является рибоза, или рибозо-5-фосфат. К рибозо-5-фосфату затем последовательно присоединяются отдельные атомы или группы атомов, из которых постепенно строится гетероциклический скелет пуринового основания. В образовании этого скелета принимают участие атомы азота и углерода ряда аминокислот, муравьиной кислоты и угольной кислоты. Процесс требует значительной затраты энергии. Донором формильных остатков (остатков муравьиного альдегида) является производное фолиевой кислоты – ангидроформилтетрагидрофолиевая кислота (АФТГФК). Синтез АФТГФК происходит из тетрагидрофолиевой кислоты (ТГФК) с участием АТФ по схеме: НСООН+ТГФК+АТФ АФТГФК+АДФ+Н3РО4
Промежуточным продуктом в синтезе пуриновых нуклеотидов является инозиновая кислота. Она состоит из пуринового основания – гипоксантина, рибозы и фосфорной кислоты. Пуриновые нуклеотиды – адениловая, дезоксиадениловая, гуаниловая и дезоксигуаниловая кислоты – образуются из инозиновой кислоты в результате довольно простых превращений. Рибозо-5-фосфат, необходимый для синтеза нуклеотидов, образуется в растениях в процессе фотосинтеза или при окислении углеводов через пентозофосфатный цикл. Процесс биосинтеза инозиновой кислоты довольно сложен и идет через несколько стадий. Суммарное уравнение биосинтеза инозиновой кислоты из простейших предшественников можно схематически представить следующим образом: 3 NH4++ 2 HCOO–+ HCO3–+ глицин + рибозо-5-фосфат инозиновая кислота + 9 Н2О.
При этом две молекулы аммиака отщепляются от глютамина и одна – от аспарагиновой кислоты, а остатки муравьиной кислоты переносятся от 2 молекул ангидроформилтетрагидрофолиевой кислоты. Всего для синтеза 1 молекулы инозиновой кислоты из рибозо-5-фосфата необходимо 5 молекул АТФ. Но при расчете общего количества энергии следует учитывать, что при образовании каждой молекулы инозиновой кислоты необходимо девять молекул АТФ. Синтез адениловой кислоты из инозиновой кислоты идет в две стадии через аденил-янтарную кислоту. Донором атома азота является аспарагиновая кислота. Эта реакция во многом напоминает реакцию синтеза инозиновой кислоты. Основное различие состоит в используемых макроэргических соединениях, которые дают энергию для синтеза С-N-связи. В реакции участвует АТФ, а в реакции синтеза адениловой кислоты – гуанозинтрифосфат (ГТФ). На 2-й стадии от аденилянтарной кислоты отщепляется фумаровая кислота, и образуется адениловая кислота. Обе реакции синтеза адениловой кислоты катализируются ферментом аденилосукцинатлиазой. Биосинтез гуаниловой кислоты из инозиновой кислоты также идет в две стадии и требует затрат энергии. На 1-й стадии инозиновая кислота окисляется до ксантиловой кислоты при помощи восстановленного никотинамидадениндинуклеотида. Эта реакция катализируется ферментом инозин-5-фосфатдегидрогеназой. На 2-й стадии происходит аминирование ксантиловой кислоты, которое требует затрат энергии. Донором атома азота здесь является глутамин. В результате реакции образуется гуаниловая кислота, аденозинмонофосфат и пирофосфорная кислота. Пуриновые дезоксирибонуклеотиды – дезоксиадениловая и дезоксигуаниловая кислоты, которые необходимы для биосинтеза ДНК, – образуются аналогично. Исходным продуктом для их синтеза также является рибоза, а превращение производных рибозы в производные дезоксирибозы осуществляется в результате их восстановления на уровне нуклеотидов при сохранении гликозидной связи между пентозой и основанием. Для восстановления необходим НАДФ*Н2.
10.Распад пуриновых оснований
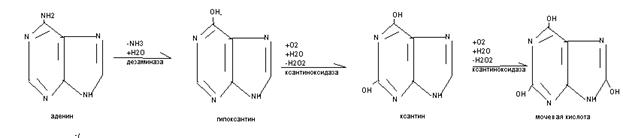
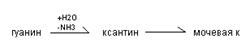
Распад пуриновых оснований происходит не в свободном виде, а в составе нуклеозидов.
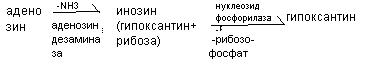
У взрослого человека экскретируется 0,5-1,5 г мочевой кислоты в сутки, азот которой составляет 3,5% всего выводимого азота. У детей относительная доля мочевой кислоты выше, чем у взрослых, на её азот приходится до 8,5%. В крови взрослых людей содержание мочевой кислоты равно 0,1-0,3(0,4) ммоль/л, у детей- до 0,47 ммоль/л.Мочевая кислота является антиоксидантом, в детском возрасте стимулирует развитие головного мозга. Мочевая кислота может присутствовать в тканях и в крови как в свободной форме (плохо растворимой в воде), так и в виде солей (более растворимых в воде). Повышение концентрации мочевой кислоты в крови - гиперурекимия. На её фоне могут развиваться подагра и почечнокаменная болезнь. При подагре кристаллы мочевой кислоты откладываются в околосуставных тканях в виде подагрических узлов. При почечнокаменной болезни кристаллы мочевой кислоты формируют камни в мочевыводящих путях.
К нарушениям распада пуриновых оснований относят некоторые иммунодефициты. При отсутствии аденозиндезаминазы развивается Т- и В – иммунодефицит, а отсутствии нуклеозидфосфорилазы возможен В - иммунодефицит. Для уменьшения гиперурекемии используют препараты – аналоги пуриновых оснований (например, аллопуринол), которые угнетают фермент ксантиноксидазу и блокируют образование мочевой кислоты.
11.Расщепление и всасывание нуклеиновых кислот в пищеварительном тракте животных Пищевые нуклеопротеины, попадая в организм человека, в желудке отщепляют белковый компонент и денатурируют под действием НС1 желудочного сока (рис. 10-1). Далее полинуклеотидная часть этих молекул гидролизуется в кишечнике до мононуклеотидов. В расщеплении нуклеиновых кислот принимают участие ДНК-азы и РНК-азы панкреатического сока, которые, будучи эндонуклеазами, гидролизуют макромолекулы до олигонуклеотидов. Последние под действием фосфодиэстераз панкреатической железы расщепляются до смеси 3'- и 5'-мононуклеотидов. Нуклеотидазы и неспецифические фосфатазы гидролитически отщепляют фосфатный остаток нуклеотидов и превращают их в нуклеозиды, которые либо всасываются клетками тонкого кишечника, либо расщепляются нуклеозидфосфорилазами кишечника с образованием рибозо- или дезоксирибозо-1-фосфата, пуриновых и пиримидиновых оснований. Пищевые пурины и пиримидины не являются незаменимыми пищевыми факторами и очень мало используются для синтеза нуклеиновых кислот тканей. В энтероцитах обнаружена высокая активность ксантиноксидазы - фермента, который большую часть пуринов, поступающих в клетки, превращает в мочевую кислоту, удаляющуюся с мочой. Пиримидиновые основания, не успевшие поступить в энтероциты, под действием микрофлоры кишечника расщепляются до NH3, CO2, β-аланина и β-аминоизобутирата. В различных клетках организма синтезируется до 90% пуриновых и пиримидиновых нуклеотидов из простых предшественников de novo.Введённые в кровь азотистые основания и нуклеозиды, а также основания и нуклеозиды, образующиеся в результате внутриклеточного разрушения нуклеиновых кислот, в небольшом количестве могут использоваться для повторного синтеза нуклеотидов по так называемым "запасным" путям.
12.Классификация углеводов. Переваривание и всасывание углеводов в пищеварительном тракте животных. Переваривание углеводов
Переваривание углеводов начинается в ротовой полости главным образом с помощью α-амилазы слюны. Некоторые исследователи считают, что в слюне имеется и другой фермент - мальтаза. α-Амилаза состоит из одной полипептидной цепи, стабилизируется кальцием, имеет оптимум рН 7,1 и активируется ионами хлора. Фермент относится к эндоамилазам, действует на внутренние α-1,4-гликозидные связи крахмала и гликогена пищи и не способен гидролизовать α-1,6-гликозидные связи этих полисахаридов. α-Амилаза гидролизует весьма беспорядочно α-1,4-гликозидные связи полисахаридов в отличие от β- и γ-амилаз. β-Амилаза последовательно отщепляет от конца полисахарида дисахарид мальтозу, а γ-амилаза - концевой моносахарид глюкозу. Поэтому обе эти амилазы являются экзоамилазами. γ-Амилаза присутствует в ткани печени и участвует в расщеплении гликогена (β-амилазы в организме человека нет; она находится в бактериях).
После действия α-амилaзы слюны полисахариды расщепляются на α-лимитдекстрин, мальтозу и небольшое количество глюкозы. Поскольку время нахождения пищи в ротовой полости невелико, доля расщепленных полисахаридов относительно мала, хотя содержание фермента в слюне очень велико. Дисахариды пищи, главными из которых являются сахароза, лактоза, трегалоза, не расщепляются в полости рта. В желудке α-амилаза инактивируется кислым содержимым желудка, и переваривание углеводов прекращается. В кишечнике происходит полный гидролиз полисахаридов, включая и образовавшийся в полости рта α-лимитдекстрин, и всех дисахаридов до моносахаридов. Действию ферментов благоприятствует нейтрализация поступающей в кишечник кислой пищи гидрокарбонатами, растворенными в щелочном содержимом сока поджелудочной железы и желчи. Гидролиз углеводов в кишечнике осуществляется ферментами поджелудочной железы и кишечника. К первым относятся панкреатическая α-амилаза и олиго-1,6-глюкозидаза. Остальные ферменты - олигосахаридазы и дисахаридазы - образуются преимущественно в слизистой кишечника. Панкреатическая α-амилаза сходна по действию с α-амилазой слюны. Она буквально в течение 4-5 мин гидролизует поступающий крахмал и гликоген до α-лимитдекстринов и мальтозы. Гидролиз α-лимитдекстрина происходит с помощью олиго-1,6-глюкозидазы, которая специфически разрывает α-1,6-гликозидные связи в точках "ветвления" полисахарида. При этом образуется мальтоза:

Дисахариды гидролизуются не в полости, а в стенке кишечника, поэтому образующиеся моносахариды сразу всасываются. Существуют α-специфичные и β-специфичные олигосахаридазы, которые расщепляют дисахариды до моносахаридов. К α-олигосахаридазам относятся мальтаза, изомальтаза, сахараза, α,α-трегалаза. Сахараза образует чаще всего комплекс с изомальтазой. Такой ферментативный сахаразо-изомальтазный комплекс (сахарозо-α-глюкогидролаза) расщепляет сахарозу на глюкозу и фруктозу, а изомальтозу - на две молекулы глюкозы.
Мальтаза гидролизует мальтозу (иногда мальтаза образует комплекс с сахaразой):

α, α-трегалаза расщепляет трегалозу:
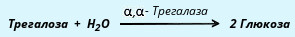
Среди β-олигосахаридаз наибольшее значение имеет специфичная β-галактозидаза, или лактаза, осуществляющая гидролиз лактозы:

Конечными продуктами переваривания углеводов являются моносахариды, преимущественно глюкоза, фруктоза, галактоза. Доля остальных моносахаридов, поступающих с пищей, относительно невелика. Далее в тонком кишечнике происходи т всасывание моносахаридов.
13. Особенности переваривания углеводов у жвачных Большая часть органического вещества растений состоит из углеводов. Углеводы представляют собой главную часть кормов. Их основой являются моносахариды . У жвачных процесс переваривания углеводов в количественном и качественном отношении протекает иначе, чем у моногастричных. Углеводы под воздействием микроорганизмов частично расщепляются в рубце на уксусную, пропионовую, масляную и некоторые другие низкомолекулярные жирные кислоты. При этом происходит образование и высвобождение диоксида углерода и метана. Жирные кислоты абсорбируются стенкой рубца (за сутки в рубце у коровы образуется и всасывается до 4 кг летучих жирных кислот). Часть крахмала достигает сычуга, а затем поступает в тонкий отдел кишечника, где расщепляется под действием ферментов до глюкозы. Крахмал отдельных видов кормов (кукурузный, картофельный) поступает в тонкий отдел кишечника в значительных количествах. Доля уксусной кислоты, образовавшейся из углеводов в рубце жвачных, преобладает над другими низкомолекулярными жирными кислотами. При скармливании жвачным животным кормов, богатых крахмалом и сахаром, в содержимом рубца возрастает доля пропионовой и масляной кислот. Если же корма богаты сырой клетчаткой, то в рубце повышается количество высвобождаемой уксусной кислоты. Уксусная и масляная кислоты используются организмом жвачных для получения энергии, а у лактирующих животных, кроме того — для образования молочного жира.
Структурные углеводы имеют большое значение, прежде всего, для жвачных животных, у которых они поддерживают обмен веществ в рубце. Структурные углеводы грубых кормов (трава, силос, сено, солома) обеспечивают нормальное функционирование рубца, содержание которого отрыгивается в ротовую полость и повторно пережевывается. При этом выделяется значительное количество слюны, которая содержит буферное вещество — гидрокарбонат натрия (NаНС03), обеспечивающее оптимальную величину рН в рубце. Ферментация структурных углеводов в рубце протекает равномерно, но на протяжении длительного периода, в то время как крахмал и сахар расщепляются очень быстро, что приводит к резкому снижению величины рН рубцового содержимого, нарушению в нем баланса микроорганизмов, ухудшению поедаемости кормов животными. Поэтому при организации кормления жвачных животных необходимо контролировать содержание углеводов в их рационе.
Глюкоза используется в организме животного в таких обменных процессах:
• образование гликогена как кратковременного резерва энергии в печени и мышцах;
• образование галактуроновой кислоты, используемой для образования слизистых веществ (мукополисахаридов) и аскорбиновой кислоты (витамин С);
• синтез глюкозамина — составной части гликопротеинов;
• образование заменимых аминокислот;
• трансформация в жир (долговременный резерв энергии).
Поддержание постоянного уровня сахара (глюкозы) в крови играет большую роль в непрерывном обеспечении организма достаточным количеством энергии. Если потребность организма в глюкозе резко возрастает, то происходит расщепление гликогена с помощью гормонов глюкагона и адреналина. Если глюкоза поступает в кровь в количестве, превышающем потребность организма, то увеличивается синтез инсулина, стимулирующего образование гликогена и жира. Уровень сахара в крови у всех видов животных колеблется в узких пределах. У жвачных большая часть глюкозы вырабатывается самим организмом. В качестве основного предшественника глюкозы используются пропионовая кислота, образующаяся при бактериальной ферментации углеводов в рубце, а также некоторые аминокислоты (серин, аланин, треонин). |
 Скачать 1.07 Mb.
Скачать 1.07 Mb.