1. Переваривание и всасывание белков в пищеварительном тракте животных
 Скачать 1.07 Mb. Скачать 1.07 Mb.
|
SKoA→-O-CO-Rфосфоглицерин →фосфатидная к-та-O-CO-R → -O-CO-Rфосфатидная к-та → триглицеридИз печени могут уходить в жировую ткань(запасаться), в подкожной клетчатке, в жировой ткани почки, глаза и т.д. Из стенки кишечника не могут самостоятельно пройти в кровь, поэтому они соединяются с белком и образуют комплекс хиломикроны, они направляются в лимфу→в кровь→в печень→во все органы и ткани.14.Судьба глюкозы в организме. Синтез гликогена в печени. Выделяется пять основных путей метаболизма проникшей в клетку глюкозы: - отложение в организме в форме гликогена; - гликолиз с образованием пирувата и лактата; - аэробное окисление через цикл Кребса или, в меньшей степени, через пентозный цикл до CO2;- превращение в свободные жирные кислоты и отложение в виде триацилглицеринов; - освобождение из клетки в виде свободной глюкозы. Гликогенез - биохимическая реакция протекающая в основном в печени и мышцах в результате которой глюкоза превращается в гликоген. Это очень важная биологическая реакция так как глюкоза является основным источником энергии в организме, а гликоген это форма хранения глюкозы в клетке на случай энергетических затрат между приемами пищи. Гликогенез это только один из этапов сложного превращения углеводов в организме. В целом это происходит следующим образом: Во время приема пищи углеводы, к которым относится крахмал, а также дисахариды сахароза, лактоза и мальтоза, под действием фермента слюны амилазы расщепляются на менее крупные молекулы. Далее в тонком кишечнике уже другие ферменты (панкреатическая амилаза, сахараза, мальтаза и лактаза) гидролизируют углеводные остатки до моносахаридов, одним из которых является глюкоза. Затем половина всосавшейся глюкозы поступает в печень, а остальная часть транспортируется в остальные ткани. Поступление глюкозы в клетки во многих органах регулируется инсулином, за исключением печени и мозга где скорость диффузии зависит только от концентрации глюкозы. В клетках происходит распад глюкозы - гликолиз. Гликолиз может происходить с участием кислорода (аэробный процесс), тогда в результате образуется две молекулы пирувата, и без участия кислорода (анаэробный процесс), в этом случае образуются две молекулы лактата. В случае аэробного процесса пируват в конечном итоге окисляется до углекислого газа и воды. А анаэробный процесс включает те же реакции что и аэробный, только в конце пируват превращается в лактат. В результате распада глюкозы с участием кислорода образуется 38 молекул АТФ - источника энергии в живых организмах, а после анаэробного гликолиза всего 2 молекулы АТФ. Смысл этого заключается в том, что анаэробный процесс протекает в мышцах в начале интенсивной физической нагрузки когда снабжение кислородом ограничено. Часть попадающей с пищей глюкозы не идет на образование АТФ, а откладывается про запас в виде гликогена у животных и в виде крахмала у растений. Гликоген и крахмал это разветвленные цепочки из молекул глюкозы. Процесс гликогенеза, т.е. образование гликогена из глюкозы представляет собой процесс полимеризации, т.е происходит последовательное присоединение друг к другу мономеров глюкозы и образование полисахаридной цепи гликогена. Мышечный гликоген является источником глюкозы для самой мышечной клетки, а печеночный поддерживает физиологическую концентрацию глюкозы в крови. 15.Анаэробный гликолиз и его значение.Представляет запасной путь, способный дать две молекулы АТФ, основного соединения макроэргического метаболизма тканей, из молекулы глюкозы при отсутствии молекулярного кислорода. Это значит, что когда в тканях имеется дефицит кислорода, уровень АТФ может еще поддерживаться, по крайней мере, на короткое время, за счет гликолиза. Так, при рождении животного во всех органах, за исключением мозга, циркуляция крови снижается и энергетика тканей обеспечивается за счет гликолиза до восстановления нормальной циркуляции крови. Это экономит кислород для мозга. Анаэробный гликолиз — это стадия окисления глюкозы, в которой кислород не является необходимым в клетках и его присутствие может косвенно угнетать процесс. Учитывая, что клетки содержат митохондрии, конечным продуктом гликолиза в присутствии кислорода в первую очередь является пируват, а не молочная кислота. Пирови ноградная кислота затем может быть полностью окислена в аэробных условиях до С02 и Н20 за счет ферментов митохондрий. Гликолиз при этом служит подготовительным механизмом для полного аэробного окисления глюкозы. Важность гликолиза установлена для функционирования мозга, имеющего абсолютную потребность в глюкозе, окисление которой протекает через аэробный гликолиз и цикл Кребса до С02 и Н20 в митохондриях клеток. В других тканях гликолиз является основным механизмом продукции АТФ. В частности, эритроциты имеют мало митохондрий, а значит, они не способны активно превращать пиро- виноградную кислоту в С02 и Н20. Роговица, хрусталик глаза имеют недостаток циркуляции крови, число митохондрий, поэтому для них гликолиз важен как источник энергии. Мозговая доля почек, тестикулы, лейкоциты, белые мышечные волокна также в целом зависят от гликолиза, источника АТФ (они сравнительно бедны митохондриями). В присутствии достаточного количества кислорода глюкоза полностью окисляется до С02 и Н20 (С6Н120б + 602 -» —> 6С02 ■+* 6Н20 + 38АТФ) посредством 10 взаимосвязанных реакций. Для непрерывной работы цикла необходимо постоянное поступление в систему ацетил-КоА, а коферменты (НАД+ и ФАД), перешедшие в восстановленное состояние, должны снова и снова окисляться. Это окисление осуществляется в системе переносчиков электронов в дыхательной цепи (в цепи дыхательных ферментов), локализованной в мембране митохондрий. Образовавшийся ФАДН2 прочно связан с СДГ, поэтому он передает атомы водорода через KoQ. Освобождающаяся в результате окисления ацетил-КоА энергия в значительной мере сосредоточивается в макроэргических фосфатных связях АТФ. Из 4 пар атомов водорода 3 пары переносят НАДН на систему транспорта электронов; при этом в расчете на каждую пару в системе биологического окисления образуется 3 молекулы АТФ (в процессе сопряженного окислительног фосфорилирования), а всего, следовательно, 9 молекул АТФ (см. главу 9). Одна пара атомов от сукцинатдегидрогеназы-ФАДН2 попадает в систему транспорта электроновчерез KoQ, в результате образуется только 2 молекулы АТФ. В ходе цикла Кребса синтезируется также одна молекула ГТФ (субстратноефосфорилирование), что равносильно одной молекуле АТФ. Итак, при окислении одной молекулы ацетил-КоА в цикле Кребса и системе окислительного фосфорилирования может образоваться 12 молекул АТФ. 16.Анаэробный распад углеводов. Биологическое значение цикла трикарбоновых кислот. Анаэробный распад углеводов обычно протекает в мышцах при выполнении интенсивных нагрузок. По своему содержанию анаэробный распад соответствует первому этапу ГДФ-пути. Однако из-за высокой скорости этого процесса образующиеся в больших количествах НАД-Н2 и пируват не полностью окисляются в митохондриях. В этом случае большая часть НАД-Н2 передает атомы водорода пировиноградной кислоте непосредственно в цитоплазме В этом случае все реакции протекают анаэробно(без участия митохондрий и потребления кислорода) и приводят к образованию и накоплению лактата (молочной кислоты). Такой анаэробный распад углеводов получил названиеанаэробный гликолиз,или просто гликолиз . Гликолиз полностью протекает в цитоплазме клеток, и синтез АТФ происходит только анаэробно В аэробных условиях углеводы окисляются полностью до СО2 и Н2О. Гликолиз составляет первую стадию окисления углеводов и заканчивается образованием пировиноградной кислоты, которая не восстанавливается до молочной кислоты, как в анаэробных условиях, а окисляется до ацетил-КоА и СО2. Далее двовуглецеви ацетильных группы (с ацетил-КоА) окисляются до СО2 и Н2О в ходе циклической последовательности реакций, называемые циклом лимонной кислоты, и реакций тканевого дыхания. При окислении глюкозы до СО2 и Н2О высвобождается значительно больше энергии, чем при гликолизе (максимально 38 моль АТФ на 1 моль глюкозы на 2 моль АТФ при анаэробного гликолиза). АТФ образуется главным образом путем окислительного фосфорилирования, соединенного с тканевым дыханием. Окислительное декарбоксилирование пировиноградной кислоты Процесс окислительного декарбоксилирования пирувата включает реакции дегидрирования и декарбоксилирования, когда карбоксильная группа пирувата высвобождается в виде СО2, а ацетильных остаток, то есть остаток уксусной кислоты, переносится на коэнзим А. Катализирует эту совокупность реакций сложный пируватдегидрогеназный комплекс, локализованный в митохондриях. Поэтому сначала пируват переходит из цитоплазмы, где происходит гликолиз, в матрикс митохондрий. Пируватдегидрогеназный комплекс состоит из 3 различных ферментов: пируватдегидрогеназы, дигидролипоатацетилтрансферазы и дигидролипоатдегидрогеназы. В его состав входят 5 коферментов: тиамин-дифосфат (ТДФ), коэнзим А (КоА), липоевая кислота, НАД и ФАД. ТДФ – это производное витамина В1 (тиамина), КоА – витамина В3 (пантотеновой кислоты), НАД – витамина РР (никотинамид), ФАД – витамина В2 (рибофлавина), а липоевая кислота является витаминоподобным составом. При недостатке этих витаминов окислительное декарбоксилирование пировиноградной кислоты и ряда других альфа-кетокислот тормозится; накопление пирувата и лактата приводит ацидоз. У больных с наследственной недостнистю пируватдегидрогеназы также может развиться ацидоз, особенно после нагрузки гдюкозою. Каждый из ферментов пируватдегидрогеназного комплекса катализирует определенный этап суммарной реакции, причем ультраструктура комплекса, компактное размещение всех компонентов обеспечивают эффективную работу без освобождения промежуточных продуктов до завершения процесса. Процесс окислительного декарбоксилирования пирувата сопровождается значительным уменьшением стандартной свободной энергии и практически необратимый. Активность пируватдегидрогеназного комплекса регулируется двумя способами. Во-первых, продукты реакции – ацетил-КоА и НАДН – есть аллостерический ингибиторами комплекса. И тогда, когда окисления ацетил-КоА в цикле лимонной кислоты отстает от образования его пирувата или жирных кислот, активность пируватдегидрогеназного комплекса тормозится. Такой же эффект имеет место при накоплении НАДН вследствие перегрузки дыхательной цепи. Активирует комплекс фруктозо-1,6-дифосфат – промежуточный продукт гликолиза. Аллостерические эффекты проявляются очень быстро. Второй механизм регуляции (медленный) – это переходы между активной и неактивной формами фермента вследствие фосфорилирования и дефосфорилирования. Фосфорилированная форма пируватдегидрогеназы неактивна, а нефосфорильована – активная. Реакцию фосфорилирования фермента под действием АТФ катализирует киназа пируватдегидрогеназы, которая активируется при высоком уровне НАДН и АТФ. Следовательно, в таких условиях пируватдегидрогеназный комплес исключается. Противоположный процесс активации пируватдегидрогеназы путем дефосфорилирования катализирует фосфатаза, которая активируется ионами Са 2. Уровень их в клетке всегда возрастает при увеличении потребности в АТФ. Киназа и фосфатаза входящих в состав пируватдегидрогеназного мультиферментного комплекса. 17.Глюконеогенез и его значение. Глюконеогенез - синтез моноса харидов из неугле водных предшественников, происходя щий в живых клетках под действием ферментов. Глюконеогенез осуществля ется в направлении, обратном глико лизу. Большинство стадий этих двух процессов совпадают и катализируются одинаковыми ферментами. Исключение — необратимые реакции, которые в глюконеогенезе протекают обходными путями. Так, синтез фосфоенол-пировиноградной к-ты из пировиноградной осу ществляется след. образом: где АТФ-аденозинтрифосфат, АДФ-аденозиндифосфат, НАДН и НАД-со отв. восстановленная и окисленная формы кофермента никотинамидаде ниндинуклеотида, ГТФ - гуанозинтри фосфат, ГДФ-гуанозиндифосфат. Пер вая и вторая стадии этого процесса про текают в митохондриях. Образовав шаяся яблочная к-та способна прони кать через мембрану митохондрий в цитоплазму и участвовать в дальней ших превращениях. У растений и бак терий обнаружены ферменты, осущест вляющие синтез фосфоенолпиро-вино градной к-ты без промежут. стадий, а у нек-рых животных он протекает полно стью в митохондриях, откуда эта к-та поступает в цитоплазму для участия в дальнейших р-циях глюконеогенеза. В цитоплазме может осуществляться также восстановительное карбоксили рование пировиноградной к-ты с обра зованием яблочной. Фруктозо-6-фосфат образуется в результате необратимого гидролиза фруктозо-1,6-дифосфата. Глюкозо-6-фосфат дефосфорилируется с образованием глюкозы или превращ. в глюкозо-1-фосфат-ключевое промежут. соед. в синтезе углеводов. Синтез одной молекулы глюкозы м. б. выражен сум марным ур-нием: 2СН3С(O)СООН + 2НАДН + 4АТФ + 2ГТФ -> -> С6Н12О6 + 2НАД + 4АДФ + 2ГДФ + 6Н3РО4 Осн. пункты контроля глюконеогенеза - регуляция синтезов фосфоенол-пирови ноградной к-ты и глюкозо-6-фосфата. Первая р-ция катализируется пируват карбоксилазой (активируется ацетили рованным коферментом А), вторая - фруктозо-бис-фосфатазой (ингибиру ется аденозинмонофосфатом и активи руется АТФ). Регуляция глюконеоге неза в организме животных осуществляется также гормонами, напр. инсулин тормозит синтез ферментов глюконеогенеза, катехоламины, глюка гон и адренокортикотропин стимули руют глюконеогенез в печени, а парати реоидный гормон-в почках. 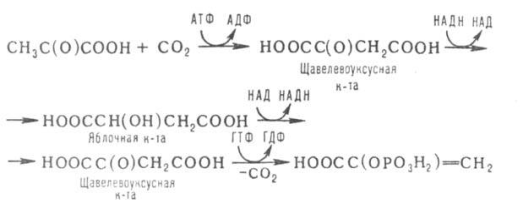 18.Пентозный путь окисления углеводов и его значение. Расхождение путей окисления углеводов – классического (цикл трикарбоновых кислот, или цикл Кребса) и пентозофосфатного – начинается со стадии образования гексозомонофосфата. Если глюкозо-6-фосфат изомеризуется во фруктозо-6-фосфат, который фосфорилируется второй раз и превращается во фруктозо-1,6-бисфосфат, то в этом случае дальнейший распад углеводов происходит по обычному гликолитическому пути с образованием пировиноградной кислоты, которая, окисляясь до ацетил-КоА, затем «сгорает» в цикле Кребса. Если второго фосфорилирования гексозо-6-монофосфата не происходит, то фосфорилированная глюкоза может подвергаться прямому окислению до фосфопентоз. В норме доля пентозофосфатного пути в количественном превращении глюкозы обычно невелика, варьирует у разных организмов и зависит от типа ткани и ее функционального состояния. У млекопитающих активность пентозофосфатного цикла относительно высока в печени, надпочечниках, эмбриональной ткани и молочной железе в период лактации. Значение этого пути в обмене веществ велико. Он поставляет восстановленный НАДФН, необходимый для биосинтеза жирных кислот, холестерина и т.д. За счет пентозофосфатного цикла примерно на 50% покрывается потребность организма в НАДФН. Другая функция пентозофосфатного цикла заключается в том, что он поставляет пентозофосфаты для синтеза нуклеиновых кислот и многих коферментов. При ряде патологических состояний удельный вес пенто-зофосфатного пути окисления глюкозы возрастает. Механизм реакций пентозофосфатного цикла достаточно расшифрован. Пентозофосфатный цикл начинается с окисления глюкозо-6-фосфата и последующего окислительного декарбоксилирования продукта (в результате от гексозофосфата отщепляется первый атом углерода). Это первая, так называемая окислительная, стадия пентозофосфатного цикла. Вторая стадия включает неокислительные превращения пентозофосфатов с образованием исходного глюкозо-6-фосфата (рис. 10.12). Реакции пентозофосфатного цикла протекают в цитозоле клетки. Первая реакция – дегидрирование глюкозо-6-фосфата при участии фермента глюкозо-6-фосфатдегидрогеназы и кофермента НАДФ+. Образовавшийся в ходе реакции 6-фосфоглюконо-δ-лактон – соединение нестабильное и с большой скоростью гидролизуется либо спонтанно, либо с помощью фермента 6-фосфоглюконолактоназы с образованием 6-фос-фоглюконовой кислоты (6-фосфоглюконат): Во второй – окислительной – реакции, катализируемой 6-фосфоглюко-натдегидрогеназой (декарбоксилирующей), 6-фосфоглюконат дегидрируется и декарбоксилируется. В результате образуется фосфорилированная кетопентоза – D-рибулозо-5-фосфат и еще 1 молекула НАДФН: 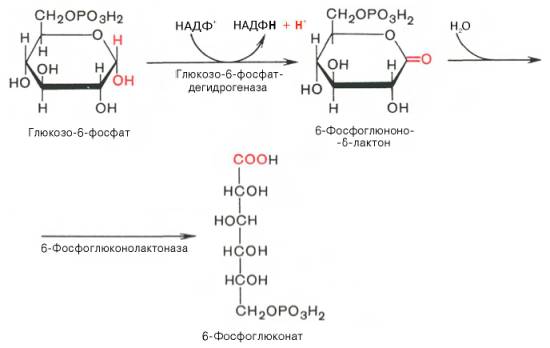 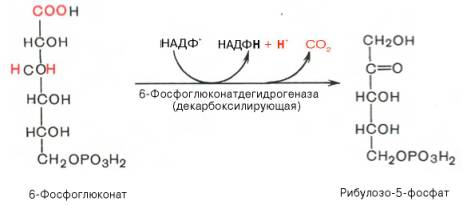 Под действием соответствующей эпимеразы из рибулозо-5-фосфата может образоваться другая фосфопентоза – ксилулозо-5-фосфат. Кроме того, рибулозо-5-фосфат под влиянием особой изомеразы легко превращается в рибозо-5-фосфат. Между этими формами пентозофосфатов устанавливается состояние подвижного равновесия: 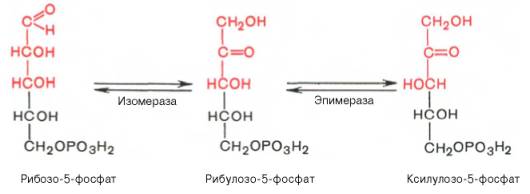 При определенных условиях пентозофосфатный путь на этом этапе может быть завершен. Однако при других условиях наступает так называемый неокислительный этап (стадия) пентозофосфатного цикла. Реакции этого этапа не связаны с использованием кислорода и протекают в анаэробных условиях. При этом образуются вещества, характерные для первой стадии гликолиза (фруктозо-6-фосфат, фруктозо-1,6-бисфосфат, фосфотрио-зы), а другие – специфические для пентозофосфатного пути (седогептулозо-7-фосфат, пентозо-5-фосфаты, эритрозо-4-фосфат). Основными реакциями неокислительной стадии пентозофосфатного цикла являются транскетолазная и трансальдолазная. Эти реакции катализируют превращение изомерных пентозо-5-фосфатов: 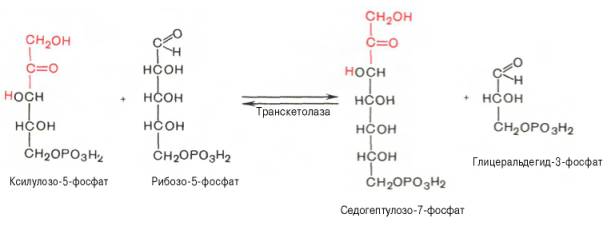 Коферментом в транскетолазной реакции служит ТПФ, играющий роль промежуточного переносчика гликольальдегидной группы от ксилулозо-5-фосфата к рибозо-5-фосфату. В результате образуется семиуглеродный моносахарид седогептулозо-7-фосфат и глицеральдегид-3-фосфат. Транскетолазная реакция в пентозном цикле встречается дважды, второй раз – при образовании фруктозо-6-фосфата и триозофосфата в результате взаимодействия второй молекулы ксилулозо-5-фосфата с эритрозо-4-фосфатом: 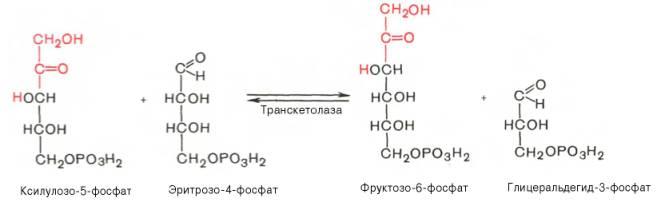 Фермент трансальдолаза катализирует перенос остатка диоксиацетона (но не свободного диоксиацетона) от седогептулозо-7-фосфата на гли-церальдегид-3-фосфат: 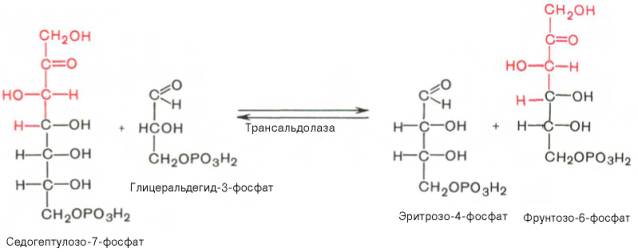 Шесть молекул глюкозо-6-фосфата, вступая в пентозофосфатный цикл, образуют 6 молекул рибулозо-5-фосфата и 6 молекул СО2, после чего из 6 молекул рибулозо-5-фосфата снова регенерируется 5 молекул глюко-зо-6-фосфата (см. рис. 10.12). Однако это не означает, что молекула глюкозо-6-фосфата, вступающая в цикл, полностью окисляется. Все 6 молекул СО2 образуются из С-1-атомов 6 молекул глюкозо-6-фосфата. Валовое уравнение окислительной и неокислительной стадий пенто-зофосфатного цикла можно представить в следующем виде: или Образовавшийся НАДФН используется в цитозоле на восстановительные синтезы и, как правило, не участвует в окислительном фосфори-лировании, протекающем в митохондриях. 19.Концентрация сахара в крови у животных и ее регуляция. Поддержание содержания глюкозы в крови на определенном уровне является примером одного из самых совершенных механизмов гомеостаз а, в функционировании которого участвуют печень, внепеченочные ткани и некоторые гормоны(Инсулин — единственный гормон, способный понижать уровень сахара в крови, тогда как целый ряд других гормонов в организме повышают уровень сахара в крови). Глюкоза легко проникает в клетки печени и относительно медленно в клетки внепеченочных тканей. Следовательно, прохождение через клеточную мембрану является лимитирующей скорость стадией при потреблении глюкозы внепеченочными тканями. Поступившая в клетки глюкоза быстро фосфорилируется при действии гексокиназы . С другой стороны, вполне возможно, что более значительное влияние на потребление глюкозы печенью или на выход глюкозы из этого органа оказывают активность некоторых других ферментов и концентрации ключевых промежуточных продуктов. Тем не менее концентрация глюкозы в крови является важным фактором, регулирующим скорость потребления глюкозы как печенью, так и внепеченочными тканями. У жвачных концентрация глюкозы - около 40 мг/100 мл у овец и 60 мг/100 мл у крупного рогатого скота. 20.Липиды и их классификация. Переваривание и всасывание липидов пищеварительном тракте животных. Липиды-разнообразные органические соединения,нерастворимые в воде,но хорошо растворимые в органических растворителях.Липиды делятся на простые и сложные.Среди них выделяют нейтральные жиры,прежде всего триглицериды(точнее,триацилглицерины),фосфолипиды,стериды и другие группы.По химическому строению липиды являются сложными эфирами карбоновых кислот и многоатомных спиртов.Липиды кормов более чем на 90% представлены триглицеридами.Липиды являются предшественниками различных биологически активных веществ органов и тканей(стероидные гормоны,простагландины);выполняют регуляторную и медиаторную функции.Липиды являются хорошими растворителями витаминов жирорастворимой группы,обеспечивая таким образом их абсорбцию в пищеварительном тракте.Липиды растительного и животного происхождения в составе кормов поступают в ротовую полость животного,где они не претерпевают каких-либо превращений,так как слюна взрослых животных не содержит липолитических ферментов.В желудке липиды кормов подвергаются воздействию желудочной липазы,однако активность этого фермента низкая(из-за низкого pH 1,5-2,0).У жвачных животных липиды кормов подвергаются действию липолитических ферментов микроорганизмов рубца.Из преджелудков как жиры кормов,так и продукты их гидролиза поступают в сычуг,затем в тонкий кишечник,где происходит их окончательный гидролиз,транспорт в эпителиоциты кишечника и всасывание.Для эмульгирования липидов в кишечнике присутствует желчь,секрет печеночных клеток. После эмульг. в процесс вовлекается поджел. липаза, которая расщепляет триглецериды на составные части. 21.Желчь.Состав желчи и ее роль в обмене липидов. Желчь-жёлто-зелёная горькая жидкость, выделяемая печенью. Для эмульгирования липидов в кишечнике присутствует желчь,секрет печеночных клеток.Печень крс вырабатывает 5-7 л желчи в сутки,у крупных собак-0,2-0,3 л.В составе желчи 96-99% воды,а основу плотного остатка составляют желчные кислоты(0,51,5%),холестерин,фосфолипиды,гормоны,минеральные вещества.Первичные желчные кислоты являются конечными продуктами обмена холестерина в печени.К ним относятся-холевая,хенодекзоксихолевая кислота. 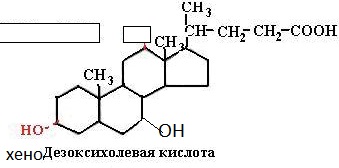 Под влиянием бактерий кишечника эти желчные кислоты переходят в дезоксихолевую и литохолевую кислоту соответственно.   Находящиеся в желчи желчные кислоты в виде натриевых солей конъюгируют с глицином(NH2-CH2-COOH) или с таурином(NH2-CH2-CH2-SO3H).Данные комплексы снижают поверхностное натяжение жиров и таким образом обеспечивают основную степень их эмульгирования.Основным конъюгатом желчи является таурохолевая кислота  Желчь учавствует в нейтрализации кислотного химуса,что необходимо для проявления активности ферментов панкреатического и кишечного секретов. За счет щелочной среды кишечника жирные кислоты образуют ПАВ(поверхностно-активные вещества),которые также являются хорошими эмульгаторами жиров.Распад жировой эмульсии на мелкие частицы облегчает воздействие на них липазы поджелудочной железы. 22.Окисление жирных кислот. Установлено, что окисление жирных кислот протекает в печени, почках, скелетных и сердечной мышцах, в жировой ткани. В мозговой ткани скорость окисления жирных кислот весьма незначительна; основным источником энергии в мозговой ткани служит глюкоза. Жирные кислоты, входящие в состав естественных жиров животных и растений, имеют четное число углеродных атомов. Любая такая кислота, от которой отщепляется по паре углеродных атомов, в конце концов проходит через стадию масляной кислоты. После очередного β-окисления масляная кислота становится ацетоуксусной. Последняя затем гидролизуется до двух молекул уксусной кислоты. Доставка жирных кислот к месту их окисления – к митохондриям – происходит сложным путем: при участииальбумина осуществляется транспорт жирной кислоты в клетку; при участии специальных – транспорт в пределах цитозоля; при участии карнитина – транспорт жирной кислоты из цитозоля в митохондрии. Процесс окисления жирных кислот складывается из следующих основных этапов. Активацияжирных кислот. Свободная жирная кислота независимо от длины углеводородной цепи является метаболически инертной и не может подвергаться никаким биохимическим превращениям, в том числе окислению, пока не будет активирована. Активация жирной кислоты протекает на наружной поверхности мембраны митохондрийпри участии АТФ, коэнзима A (HS-KoA) и ионов Mg2+. Реакция катализируется ферментом ацил-КоА-синтетазой: В результате реакции образуется ацил-КоА, являющийся активной формой жирной кислоты. Далее сульфгидрильная группа КоА действует на прочно связанный с ферментом ациладенилат с образованием ацил-КоА и АМФ. Транспортжирных кислотвнутрьмитохондрий. Коэнзимная форма жирной кислоты, в равной мере как и свободныежирные кислоты, не обладает способностью проникать внутрь митохондрий, где, собственно, и протекает ихокисление. Переносчиком активированных жирных кислот с длинной цепью через внутреннюю митохондриальную мембрану служит карнитин. Ацильная группа переносится сатома серы КоА на гидроксильную группу карнитина с образованием ацилкарнитина, который диффундирует через внутреннюю митохондриальную мембрану:  Реакция протекает при участии специфического цитоплазматического фермента карнитин-ацилтрансферазы. Уже на той стороне мембраны, которая обращена к матриксу, ацильная группа переносится обратно на КоА, что термодинамически выгодно, поскольку О-ацильная связь в кар-нитине обладает высоким потенциалом переноса группы. Иными словами, после прохождения ацилкарнитина через мембрану митохондрий происходит обратнаяреакция – расщепление ацилкарнитина при участии HS-KoA и митохондриальной карнитин-ацилтрансферазы:  Внутримитохондриальноеокислениежирных кислот. Процесс окисления жирной кислоты в митохондриях клеткивключает несколько последовательных энзиматических реакций. Первая стадиядегидрирования. Ацил-КоА в митохондриях прежде всего подвергается ферментативномудегидрированию, при этом ацил-КоА теряет 2 атома водорода в α- и β-положениях, превращаясь в КоА-эфир ненасыщенной кислоты. Таким образом, первой реакцией в каждом цикле распада ацил-КоА является его окислениеацил-КоА-де-гидрогеназой, приводящее к образованию еноил-КоА с двойной связью между С-2 и С-3:  Существует несколько ФАД-содержащих ацил-КоА-дегидрогеназ, каждая из которых обладает специфичностью по отношению к ацил-КоА с определенной длиной углеродной цепи. Стадия гидратации. Ненасыщенный ацил-КоА (еноил-КоА) при участии фермента еноил-КоА-гидратазы присоединяет молекулу воды. В результате образуется β-оксиацил-КоА (или 3-гидроксиацил-КоА):  Заметим, что гидратация еноил-КоА стереоспецифична, подобно гидратации фумарата и аконитата (см. с. 348). В результате гидратации транс-Δ2-двойной связи образуется только L-изомер 3-гидроксиацил-КоА. Вторая стадиядегидрирования. Образовавшийся β-оксиацил-КоА (3-гидроксиацил-КоА) затем дегидрируется. Этуреакцию катализируют НАД+-зависимые дегидрогеназы:  Тиолазнаяреакция. В ходе предыдущих реакций происходило окисление метиленовой группы при С-3 в оксогруппу. Тиолазная реакция представляет собой расщепление 3-оксоацил-КоА с помощью тиоловой группы второй молекулыКоА. В результате образуется укороченный на два углеродных атома ацил-КоА и двууглеродный фрагмент в виде ацетил-КоА. Данная реакция катализируется ацетил-КоА-ацилтрансферазой (β-ке-тотиолазой):  Образовавшийся ацетил-КоА подвергается окислению в цикле трикар-боновых кислот, а ацил-КоА, укоротившийся на два углеродных атома, снова многократно проходит весь путь β-окисления вплоть до образования бутирил-КоА (4-углеродное соединение), который в свою очередь окисляется до 2 молекул ацетил-КоА (рис. 11.2). Например, приокислении пальмитиновой кислоты (С16) повторяется 7 циклов β-окисления. Запомним, что при окислении жирной кислоты, содержащей п углеродных 23.Окисление глицерина. Глицерин,образовавшийся при гидролизе отдельных групп жиров,может служить источником энергии,окисляясь при этом до углекислоты и воды.На первом этапе окисления происходит переход глицерина в его активную форму-глицерофосфат в глицеролкиназной реакции  Полученный глицерофосфат взаимодействует с НАД(окисленный никотинамидадениндинуклеотид) при участии цитоплазматической глицеролфосфат дегидрогеназы с образованием 3-фосфодиоксиацетона  Затем 3-фосфодиоксиацетон превращается в фосфоглицериновый альдегид,судьбу которого можно проследить в реакциях анаэробного и аэробного гликолиза.3-фосфоглицериновый альдегид также может быть использован как субстрат для процесса глюконеогенеза.Таким образом,глицерин в тканях рассматривается как посредник гликолиза и глюконеогенеза. 24.Синтез фосфолипидов и их значение. Фосфолипиды(глицерин+2 ост.жир.к-т +фосфарная к-та) - лецитин, кефолин. В тонком кишечнике также подвергаются эмульгированию, а затем гидролизуются с участием фосфолипаз A1, A2, C, D поджел.железы. Вначале под влиянием фосфолипазы A2 происходит гидролиз только одной внутренней эфирной связи с образованием, в частности, из лецитина - лизолецитина, который в свободном состоянии находится в змеином яде. Под влияние A1 он распадается на свободную жир. к-ту и глицерофосфохолин, который под влиянием С распадается до глицерина и холинфосфата. Фосфолипаза D осуществляет гидролиз холинфосфата до свободного холина и фосфорной к-ты, которая всасывается киш.стенкой в виде натриевых и калиевых солей. Синтез фосфолипидов. Во всех органах, тканях, кроме эритроцитов. 25.Синтез жирных кислот Синтез жирных кислот происходит в основном в печени, в меньшей степени – в жировой ткани и лактирующей молочной железе. Гликолиз и последующее окислительное декарбоксилирование пирувата способствуют увеличению концентрации ацетил-КоА в матриксе митохондрий. Синтез же жирных кислот происходит в цитозоле, куда и должен быть транспортирован субстрат. Для этого в матриксе митохондрий ацетил-КоА конденсируется со ЩУК с образованием цитрата. Затем транслоказа переносит цитрат в цитоплазму. Это происходит только при увеличении количества цитрата в митохондриях, когда изоцитратдегидрогеназа и a-кетоглутаратдегидрогеназа ингибированы высокими концентрациями НАДН и АТФ. Такая ситуация создается в абсорбтивном периоде, когда клетка печени получает достаточное количество источников энергии. В цитоплазме цитрат расщепляется до ЩУК и ацетил-КоА. Последний служит исходным субстратом для синтеза жирных кислот, а ЩУК под действием малатдегидрогеназы превращается в малат, который при участии малик-фермента образует пируват. Пируват транспортируется обратно в матрикс митохондрий. Первая реакция синтеза жирных кислот – превращение ацетил-КоА в малонил-КоА, осуществляемое ацетил-КоА-карбоксилазой, определяет скорость всех последующих реакций синтеза жирных кислот. Далее синтез жирных кислот продолжается на мультиферментном комплексе – синтазе жирных кислот. Этот фермент состоит из 2 идентичных протомеров, каждый из которых имеет доменное строение и, соответственно, 7 центров, обладающих разными каталитическими активностями (ацетилтрансацилаза, малонилтрансацилаза кетоацилсинтаза, кетоацилредуктаза, гидратаза, еноил-редуктаза, тиоэстераза) и ацилпереносящий белок (АПБ). АПБ не является ферментом, его функция связана только с переносом ацильных радикалов. В процессе синтеза важную роль играют SH-группы. Одна из них принадлежит 4-фосфопантетеину, входящему в состав АПБ, вторая – цистеину кетоацилсинтазы. Протомеры синтазы жирных кислот расположены «голова к хвосту». Несмотря на то, что каждый мономер содержит все активные центры, функционально активен комплекс из двух протомеров. Поэтому реально синтезируются одновременно 2 жирных кислоты (в схемах для упрощения изображают синтез только одной молекулы).Этот комплекс последовательно удлиняет радикал жирной кислоты на 2 углеродных атома, донором которых служит малонил-КоА. Циклы реакций повторяются до тех пор, пока не образуется радикал пальмитиновой кислоты, который под действием тиоэстеразного центра гидролитически отделяется от ферментного комплекса, превращаясь в свободную пальмитиновую кислоту. В каждом цикле биосинтеза пальмитиновой кислоты проходят 2 реакции восстановления, донором водорода в которых служит НАДФН. 26. Синтез триглицеридов в стенке кишечника Синтез триглицеридов происходит из глицерина и жирных кислот (главным образом стеариновой, пальмитиновой и олеиновой). Путь биосинтеза триглицеридов в тканях протекает через образование α-глице-рофосфата (глицерол-3-фосфата) как промежуточного соединения. В почках, а также в стенке кишечника, где активность фермент глицеролкиназы высока, глицерин фосфорилируется за счет АТФ с образованием глицерол-3-фосфата: в процессе гликолитического распада глюкозы образуется дигид-роксиацетонфосфат. Последний в присутствии ци-топлазматической глицерол-3-фос-фатдегидрогеназы способен превращаться в глицерол-3-фосфат: Образовавшийся тем или иным путем глицерол-3-фосфат последовательно ацилируется двумя молекулами КоА-производного жирной кислоты (т.е. «активными» формами жирной кислоты – ацил-КоА). В результате образуется фосфатидная кислота (фосфатидат): Далее фосфатидная кислота гидролизуется фосфатидат-фосфогидро-лазой до 1,2-диглицерида (1,2-диацилглицерола): Затем 1,2-диглицерид ацилируется третьей молекулой ацил-КоА и превращается в триглицерид (триацилглицерол). Эта реакция катализируется диацилглицерол-ацилтрансферазой: Биосинтез триглицеридов (триацилглицеролов).Биосинтез жирных кислот Жир может синтезироваться как из продуктов распада жира, так и из углеводов. Синтез эндогенного жира из углеводов протекает в печени и в жировой ткани. Ацил-КоА синтезируется из Ацетил-КоА. ГБФ-путь распада углеводов обеспечивает синтез энергией. Образование Ацетил-КоА происходит в матриксе митохондрий. Синтез жирных кислот идет в цитоплазме на мембранах эндоплазматического ретикулума путем постепенного удлинения ацетил-КоА на 2 углеродных атома за каждый цикл. Удлинение высших жирных кислот, содержащих более 16 углеродных атомов, идет путем реакций, обратных -окислению. Однако реакции синтеза жирных кислот до 16 углеродных атомов принципиально отличаются от реакций, обратных -окислению. Они протекают обходным обратным путем. Изучено 2 пути синтеза:в стенке кишечника из моноглицерида-O-CO-R + 2R-CO |
