1. Переваривание и всасывание белков в пищеварительном тракте животных
 Скачать 1.07 Mb. Скачать 1.07 Mb.
|
|
30.Классификация и номенклатура витаминов
Известно свыше 30 витаминов и витаминоподобных соединений. Не все они необходимы в пище. Некоторые вит., напр., аскорбиновая кислота, нужны в пище только человеку, обезьянам и морским свинкам. Другие животные не нуждаются в поступлении аскорбиновой кислоты с пищей, поскольку, она синтезируется в достаточном количестве из глюкозы в их тканях. В 1913г. по предложению Мак - Коллума, витамины по мере их выделения условились обозначать буквами лат. алфавита. После того, как была исследована химическая природа ряда витаминов, стали вводить их химические названия. По физико-хим. свойствам вит. классифицируются на: 1. Жирорастворимые – А, D, Е, К – для их всасывания необходимо наличие жиров и солей желчных кислот. Они способны депонироваться в печени в >> количествах. 2. Водорастворимые – В1, В2, В3, В5, В6, Вс, В12, С, Н, Р – они не депонируются в тканях животного, их поступление с кормами д.б. постоянным, многие из них являются коферментами сложных ферментов, хорошо растворимы в воде, термолабильны и не устойчивы к изменениям рН среды. Есть еще группа – витаминоподобные – F, U и др. Такое деление характеризует и их биологич. особенности. В наст. время Спиричевым (2005 г) предложена новая классификация витаминов, основанная на характере их специфических функций. В соответствии с ней вит. // на 3 группы. В 1-ю, самую многочисл., входят витамины, из которых образуются коферменты и простетические группы различных ферментов. К энзимовитаминам относятся водорастворимые витамины группы В, и К, осуществляющий коферментные функции в реакции γ-карбоксилирования остатков глутаминовой кислоты в ряде кальцийсвязывающих белков. В эту группу м. б. отнесен и вит. А, являющийся в форме ретиналя простетической группой зрительного белка родопсина, участвующего в процессе фоторецепции. Др. форма вит. А - ретилфосфат - может выполнять функцию кофермента - переносчика остатков сахаров в синтезе гликопротеидов клеточных мембран. 2-ю группу образуют прогормоны, активные формы которых обладают гормональной активностью. К ним относится вит. D, функционирует как гормон в процессах обмена кальция, вит. А, гормональной формой которого является ретиноевая кислота, играющая важную роль в процессах роста и дифф. эпителиальных тканей. К 3-ей группе можно отнести витамины - антиоксиданты: аскорбиновую кислоту (вит. С) и вит. Е, входящие в систему антиоксидантной защиты организма от повреждающего действия активных, свободнорадикальных форм О2. В эту группу можно включить β-каротин, ликопин, лютеин и другие каротиноиды, обладающие собственной антиоксидантной активностью. Антиоксидантной активностью обладают и многие биофлавоноиды. Для обозначения каждого витамина существует буквенное, химическое и физиологическое название. Соединения, обладающие одним и тем же биологическим действием, но различающиеся витаминной активностью, называются витамерами (витамин Д - кальциферол в двух формах: Д2 - эргокальциферол, и Д3 -холекальциферол. В природе есть соединения, имеющие неидентичную, но сходную с витаминами структуру и оказывающие действие, основанное на конкурентных взаимоотношениях с ними. Такие вещества являются антивитаминами. 31.Коферментная функция витаминов Ферменты (энзимы) - это биологические катализаторы — вещества, роль которых значительно ускорять химическую реакцию. Причём, в процессе реакции они не затрачиваются. Основу фермента составляет белковая молекула. Но большинству таких молекул для активации необходим специальный свойственный ей кофермент (коэнзим). Именно витамин или минерал является основным составляющим такого активатора, подходя ферменту как «ключ к замку». Коферментная функция витаминов заключается в их вхождении в состав коферментов. Кофермент имеет 2 функциональных участка, один из которых отвечает за связь с апоферментом, а другой принимает непосредственное участие в каталитическом акте. Как правило, активная форма витаминов принимает участие именно в катализе. Например к ним, т.е. энзимовитаминам можно отнести водорастворимые витамины группы В, и вит. К, осуществляющий коферментные функции в реакции γ-карбоксилирования остатков глутаминовой кислоты в ряде кальцийсвязывающих белков. В эту же группу может быть отнесен и вит. А в форме ретилфосфат - может выполнять функцию кофермента - переносчика остатков сахаров в синтезе гликопротеидов клеточных мембран. 32.Каротины – провитамины витамина А. Их превращение в организме Различные растения синтезируют и содержат предшественники вит. А – каротины (в темно-зеленых и желтых растениях) и картиноиды. Каротин (от лат. carota — морковь) - жёлто-оранжевый пигмент, непредельный углеводород из гуппы каротиноидов. Эмпирическая формула С40H56. Нерастворим в воде, но растворяется в органических растворителях. Содержится в листьях всех растений, а также в корне моркови, плодах шиповника и др. Различают а, в и y-каротины. в-каротин – наиболее биологически эффективная форма, ее молекула в тонком кишечнике под влиянием фермента каротиназы распадается на 2 молекулы активного вит. А, из а и y-каротинов образуется по 1 молекуле. Из кишечника вит. А поступает в кровь и депонируется в печени в форме сложных эфиров с уксусной или пальмитиновой кислотой. в-каротин является эффективным антиоксидантом в снижении риска развития новообразований, индуцированных радикалами О2 и др. окислителями. Каротинемия или гиперкаротинемия — избыток каротина в организме (в отличие от избытка витамина А, каротин малотоксичен). Обычно каротинемия не рассматривается как опасное состояние, хотя и ведёт к пожелтению кожи (каротинодермия). В норме уровень каротина в сыворотке крови – 1,5 – 2,5 мг% 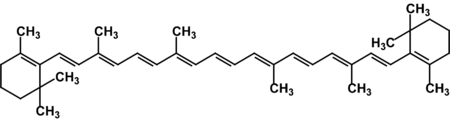 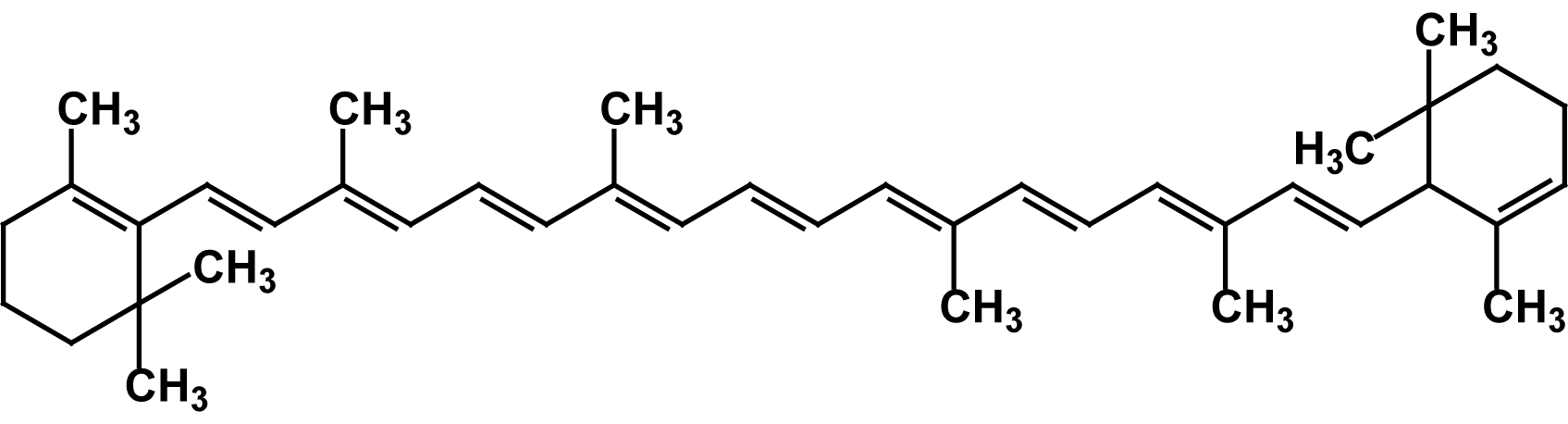 33.Витамин А. Структура, биологическая роль Витамин А – ретинол, антиксерофтальмический. Предшественниками являются каротины и каротиноиды. Молекулы каротина в тонком кишечнике под действием фермента каротиназы распадается на молекулы активного витамина А. Из кишечника он поступает в кровь и депонируется в печени в форме сложных эфиров с уксусной и пальмитиновой кислотой. Высокий уровень нитратов и нитритов в кормах оказывает (-) влияние на абсорбцию и метаболизм вит. А. Вит. А существует в тканях организма в форме ретинола, ретиналя и ретиноевой к-ты. В тканях ретинол переходит в ретинол-фосфат (переносчик остатков маннозы и галактозы, необходимых для синтеза гликопротеинов и мукополисахаридов), что обеспечивает рост клеток и секрецию слизи оболочек. Вит. А играет главную роль в поддержании целостности анатомических барьеров, необходим для предупреждения синтеза высокомолекулярных форм белка – кератина, предотвращая кератинизацию эпителия – вит. А называют антиинфекционным. Важна роль в зрительном процессе - в форме ретиналя участвует в процессе фоторецепции. Принимает участие в синтезе специфических белков, участвующих в росте, делении клеток, поэтому гиповитаминоз вит. А сопровождается снижением роста и смертностью эмбрионов, снижает активность биосинтеза стероидных структур надпочечников. Вит. А – наиболее нестабильный, поэтому рекомендовано вводить в рацион в количествах превышающих потребность или совместно с антиоксидантами. Возможны гипервитаминозы – увеличение объема печени и селезенки, диарея и чешуйчатый дерматит, гиповитаминозы – чувствительность к инфекциям и рост опухолей. В норме уровень каротина в сыворотке крови – 1,5 – 2,5 мг%. В пастбищный период – максимальный уровень.  34.Витамины группы D, их провитамины. Структура, биологическая роль. Витамин D – кальциферол, кальцитриол, антирахитичнеский. Находится в природе в виде предшественников стероидной структуры. Предшественник вит. D2 (растительный стерол) – эргостерол под влиянием УФ способен превращаться в активный вит. D2. Вит. D2 в >> кол-ах в дрожжах, молоке, сене. Др. стероид – 7 дегидрохолестерол (в коже) под влиянием УФ трансформируется в D3 (холекальциферол). Он в >> кол-ах в печени морских рыб, желтке яиц, накопление происходит в ядрах клеток-мишеней (почки, мозг, поджелудочная и молочная железа, гипофиз). Вит. D поступает в печень, превращается в реакции гидроксилирования в 25-гидроксихолекальциферол (осн. циркулирующая форма), затем в почках в 1,25-дигидроксихолекальциферол (наиболее активная форма) – по механизму действия как стероидный гормон кальцитриол. Основной эффект вит. D – обеспечение транспорта Са и Р через мембраны эпителиальных клеток кишечника и реабсорбции в почечных канальцах, уменьшая их выведение. Участвует в регуляции соотношения Са и Р в сыворотке крови. В норме у животных 2:1, у птиц 3:1. Вместе с паратгормоном оказывает синергический эффект на костную ткань. Недостаток вит. D вызывает деминирализацию костной ткани, рахит у молодняка и остеомаляцию у взрослых, нервные расстройства, снижении яйценосности. Уровень портебности установить сложно, недостаток оценивают по повышению концентрации пировиноградной к-ты и снижению уровны лимонной к-ты в крови. 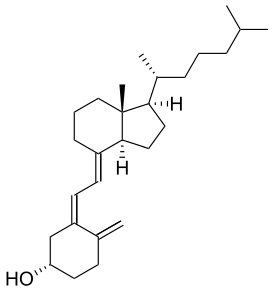 35.Витамины группы Е (токоферолы). Структура, биологическая роль. Антистерильный, витамин размножения. В группу отнесены токоферолы – гетероциклические жирорастворимые соединения, недостаток которых проявляется нарушением развития плода. Существует несколько видов токоферолов, более активный а-токоферол или 5,7,8-триметил-токол: 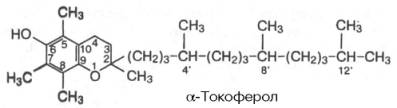 Содержится во всех кормах растительного происхождения. Синтез происходит и за счет микрофлоры пищеварит. тракта. Действует как оксидант, защищающий ненасыщенные жирные кислоты и липиды мембран от окисления, угнетает образование перекиси жирных кислот. Роль: 1. влияет на концентрацию транспортеров О2, на синтез гемоглобина. 2. на клеточном уровне способствует упрочнению мембран клеток, взаимодействуя с ненасыщенными жирными кислотами фосфолипидов. Наряду с ним важен и селен. Авитоминоз проявляется мышечной дистрофией, стерильности, высокой смертности эмбрионов. Витамин Е защищает витамин А, каротин и каротиноиды от окисления. При гиповитаминозе Е может наблюдаться гиповитаминоз А. В организме животного участвует в биосинтезе антител, выполняя функцию регулятора синтеза белка, антиоксиданта или регулятора окислительно-восстановительных процессов. 36.Витамины группы К. Структура, биологическая роль. Антигеморрагический, филлохинон. Включает несколько производных структур нафтохинона с боковыми цепями в виде изопреновых звеньев. Различают в природе витамины К1 и К2, получен синтетически К3 (викасол). Наибольшей активностью обладает К1. Находится в зеленых кормах (в люцерне), синтез осуществляется и микрофлорой ЖКТ, всасывание в тонком кишечнике при участии желчных кислот с депонированием в клетках печени, миокарде, селезенке. Участвует в механизме свертывания крови, необходим для перехода протромбина в активную форму. Превращение связано с карбоксилированием глутаминовой кислоты протромбина в y-карбоксиглутаминовую кислоту. Дефицит приводит к удлинению времени образования сгустка крови, а следовательно к кровотечению (геморрагии). Имеет структуру близкую по строению с коэнзимом Q, поэтому полагают, что он участвует в цепи реакций биологического окисления. Установлено несколько антивитаминов – дикумарол (угнетает синтез протромбина и проконвертина), салициловая кислота и зоокумарин. 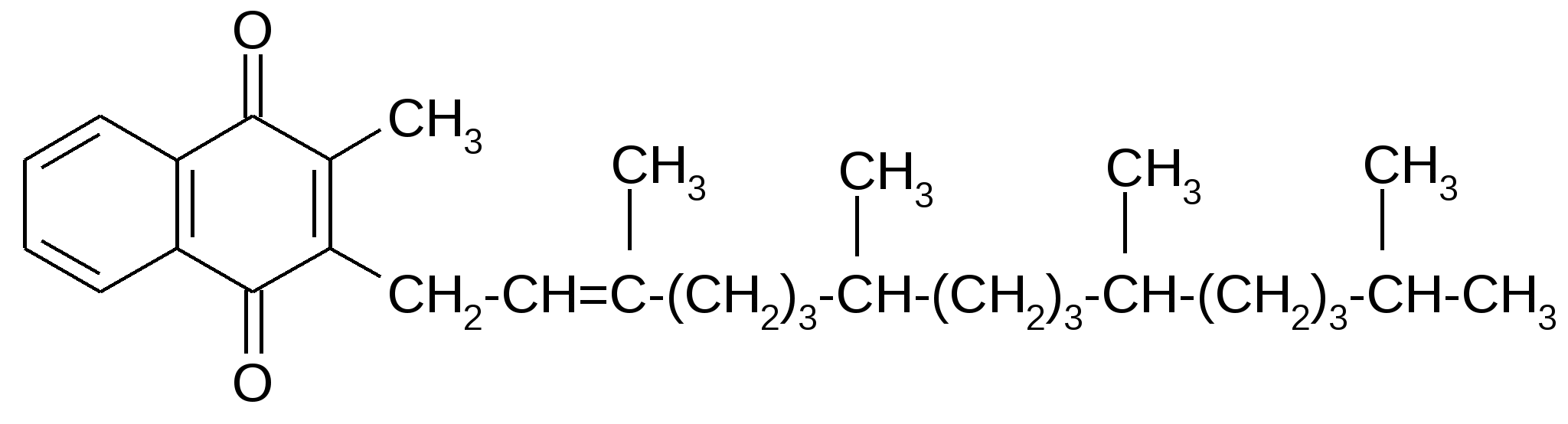 37.Витамин F. Структура, биологическая роль. Витамин F – витаминоподобное жирорастворимое вещество. Это комплекс ненасыщенных жирных кислот: линолевой С17Н33СООН, линоленовой С17Н31СООН, арахидоновой С19Н29СООН входит в состав биомембран. Эти кислоты не способны синтезироваться в организме животного и поэтому рассматриваются как незаменимые. В >> кол-ах присутствуют в растительных маслах. Имеют высокую биологическую активность: 1. являются составнями компонентами мембран клеток 2. являются предшественниками простогландинов, лейкотриенов, тромбоксанов, обладающих гормональной активностью. Эти кислоты способствуют нормализации уровня холестерина в организме, рпедупреждают развитие атеросклероза. Вит. F (+) влияет на состояние кожного и шерстяного покрова. Недостаток проявляется сухостью кожи, выпадением волос, развитием дерматитов, нарушением обмена холина фосфолипидов и холестерина. Был открыт в 1928 году. Витамин неустойчив к нагреванию и действию солнечного света. 38.Витамин В1 (тиамин). Структура, биологическая роль. Витамин В1 – тиамин, аневрин – выделен впервые Функом в 1911 г., в своей структуре содержит пиримидиновый и тиазоловый гетероциклы, соединенные метиленовым мостиком и остаток эталона. Тиамин нестоек к нагреванию в щелочной среде, в кислой среде устойчив при кипячении. Потребность организма покрывается за счет кормов (фуражное зерно, трава, дрожжи) и активного бактериального синтеза в ЖКТ. Из тонкого кишечника В1 поступает в печень, почки, мозг и миокард. Биолог. роль связана с его коферментной функцией, он обеспечивает течение реакций превращений пировиноградной и а-кетоглутаровой к-т до ацетил-КоА и сукцинил-КоА. Дефицит В1 в составе пируват-дегидрогеназного комплекса, содержащего тиаминпирофосфат, приводит к накоплению пирувата в организме – негативному влиянию на нервную ткань и функции гол. мозга. Недостаток может вызывать параличи и парезы, болезнь бери-бери, атрофию половых органов, анорексию у цыплят, у КРС коматоз и энцефалопатию. В1 в форме тиаминпирофосфата входит в молекулы транскетолазы, фермента превращающего рибулозо-5-фосфат в рибозо-5-фософат в пентозном превращении гексоз. Торможение пентозного пути приводит к снижению НАДФН2, необходимого для синтеза жир. к-т, холестерина и стероидных гормонов. Тиаминаза – фермент, разрушающий В1, содержится в рыбе. 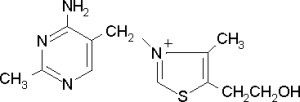 39.Витамин В2 (рибофлавин). Структура, биологическая роль. Витамин В2 – рибофлавин – имеет в структуре изоаллоксазиновый гетероцикл и спирт рибитол. Структура сравнительно термостабильна, устойчива в кислой среде при 1200, разрушается в нейтральной и щелочной среде и при УФ облучении. Синтез активен в растениях (в зерновых) + синтез бактериями и дрожжами в ЖКТ, в корнеклубнеплодах практически отсутствует. Много в мясокостной и рыбной муке, дрожжах. После всасывания в тонком кишечнике он фосфорилируется в различных тканях, образуя 2 кофермента – флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД). Эти коферменты участвуют в реакциях окисления – В2 участвует в реакциях получения энергии в форме АТФ. Поэтому дефицит вызывает задержку роста, слабость, дерматиты, атрофию, повышение смертности эмбрионов. Важную роль в стабилизации функции зрения. Наличие коферментов – производных вит. В2 установлено в десятках ферментов (цитохромредуктаза, гистаминаза, аминооксидаза). Участвует в 2-х типах реакций: перенос 2Н+ непосредственно с субстрата, окисление через НАД+ или НАДФ+. 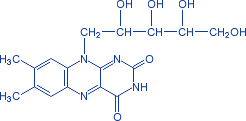 40.Витамин В3 (пантотеновая кислота). Структура, биологическая роль. Витамин В3 – пантотеновая к-та, пантотен, антидерматитный. В структуре содержит в-аланин и производное масляной к-ты. Синтезируется растениями и за счет микрофлоры ЖКТ. Содержится в зерновых, дрожжах, печени. Известо около 70 ферментных систем, где используется коэнзим-А и ацилпереносящий белок, содержащий в структуре В3. НS-КоА участвует в обмене жиров (окисление жир. к-т, фосфолипидов и стероидных гормонов), в обмене белков (синтез гемоглобина) и углеводов через цикл трикарбоновых кислот. При недостатке рождение слабых циплят, задержка роста, неравномерное оперение, карликовая болезнь циплят, поражение кожных покровов, выпадение волос, исхудание и поражение нерв. системы. Авитаминоз м.б. вызван избыточным применением антибиотиков.  41.Витамин В5 (никатинаммид). Структура, биологическая роль. Витамин В5 – никотинамид, ниацин, антипелларгический, является пиридиновым производным. Представлен никотиновой кислотой и ее амидом. Структура устойчива при 1200 2 часа. Синтезируется в зеленых растениях и микрофлорой ЖКТ. В тканях никотиновая к-та переходит в никатиамид. При поступлении в организм в избытке с кормами триптофана эта аминокислота м.б. превращена в В5. Биологич. роль связана с коферментными функциями. Он является составной частью коферментов НАД+ и НАДФ+ в составе >> 100 оксидоредуктаз, принимающих участие в окислит. – восстан. реакциях. Недостаток приводит к нарушению окисления субстратов, обеспечивающих выход энергии для организма. Известен также как предупреждающий пеллагру (диарея, деменция, дерматиты). Недостаток у циплят вызывает синдром «черного языка», воспаления рот. полости, поражению суставов ног. В5 используют как фармакологический агент для понижения уровня холестерина в сыворотке крови.  42.Витамин В6. Биологическая роль. Существуют 3 природные формы вит. В6 (пиридоксин, антидерматитный), производные пиридина. Устойчив к действию кислот и щелочей, чувствителен к свету. Содержится в растит. кормах и синтезируется микрофлорой ЖКТ. В тканях все 3 формы активно превращаются в кофермент пиридоксальфосфат (ПФ), необходимый для продукции энергии из аминокислот (напр. при превращении аланина в пировиноградную к-ту) – энергореализующий витамин. ПФ является простетической группой >> чем 20 пиридоксалевых ферментов (декарбоксилазы, трансминазы), осуществляющих важнейшие реакции декарбоксилирования и трансаминирования аминокислот. Он необходим для синтеза δ – аминолевулиновой к-ты – предшественника гемма. В6 является участником белкового обмена, необходим для синтеза нейромедиаторов – серотонина, норадреналина. При дефиците нервозность, депрессия, конвульсии. Может вызывать потерю аппетита, снижением массы тела. В ветеринарии используется препарат перидоксин гидрохлорид для восполнения недостатка В6.   43.Витамин В 12. Биологическая роль. Витамин В12 – цианкобаламин, антианемический. В своей структуре включает нуклеотидную часть (5,6,диметилбензимидазол + рибоза+ фосфорная к-та) и хромофорную, в центре которой кобальт. Растения не синтезируют, только микроорганизмы ЖКТ. Содержатся в навозе, почве, стоячей воде. Чтобы использовать В12 его нужно «оторвать» от белка под влиянием НCl желудка или трипсина в кишечнике, затем связать с мукопротеином желуд. сока, далее всасывается в кровь. Депонируется в печени на период до неск. лет – реального дефицита не бывает. Влияет на обмен нуклеин. к-т, белков, жиров и углеводов, но известны 2 типа реакций с прямой ролью В12: нужен для превращения метил-малонил-КоА в сукцинил-КоА, как переносчик метильной группы в реакции превращения гомоцистеина в метионин. В12 стимулирует норм. эритропоэз. Недостаток приводит к нарушению кроветворения, макроцитарной анемии в руз-те нарушений его абсорбции. Применяется для поддержания гомеостаза кост. мозга, защиты печени от ожирения, сохранения функций поджелуд. железы. 44.Витамин Вс (фолиевая кислота). Биологическая роль. Витамин Вс (В9) – фолиевая к-та, антианемический – комплекс, включающий производное птеридина, пара-аминобензойной и глутаминовой кислот. Активный синтез в растениях и ЖКТ. Много в дрожжах, люцерне, мясе, молоке. В организме депонируется в печени. Является фактором роста цыплят. Активной формой является тетрагидрофолиевая к-та – продукт гидрирования птериновой циклической группировки. В этой форме выполняет коферментные функции – перенос одноуглеродных радикалов, которые используются в синтезе холина, серина, глицина, пуринов. При дефиците происходит снижение синтеза пуринов, что приводит к угнетению синтеза ДНК клеток., что вызывает замедление созревания эритроцитов. Недостаток приводит к задержке роста, плохому оперению у циплят, анемией, снижением уровня гемоглобина.  45.Биотин. Структура, биологическая роль. Биотин – вит. Н, антисеборейный – имеет в своей структуре тиофеновое кольцо, мочевину и валериановую кислоту. Синтезируется в растениях и микрофлорой ЖКТ, много в дрожжах, молоке, люцерне. Яйца кур содержат белок авидин, связывающий биотин в кишечнике и блокирующий его всасывание, следовательно, в корм надо добавлять вареные яйца. Является составной частью многих ферментов обмена белков, жиров и углеводов. Коферментативная функция – обеспечение реакций карбоксилирования (в синтезе жирных к-т, синтезе пуринового кольца, щавелево-уксусной к-ты из пировиноградной и СО2). Синтез мочевины на 1-м этапе также требует наличия в среде фермента карбамоилфосфатсинтазы, содержащего биотин в качестве кофермента. Недостаток вызывает синдром «ожирения почек и печени», у цыплят дерматиты, снижение выводимости яиц, искривление клюва у эмбрионов, хондродистрофию. Недостаток может возникнуть при антибиотикотерапии. Биотин необходим для перозиса у цыплят и индеек.  46.Витамин С. Структура, биологическая роль. Аскорбиновая кислота - органическое соединение с формулой C6H8O6, является одним из основных веществ в рационе, которое необходимо для нормального функционирования соединительной и костной ткани. Выполняет биологические функции восстановителя и кофермента некоторых метаболических процессов, является антиоксидантом. Биологически активен только один из изомеров — L-аскорбиновая кислота, который называют витамином С (антискорбутный). Он может синтезироваться у большинства животных. Добавки важны для птиц, т.к. у них синтез не достаточен, для повышения яйценосности, роста, прочности скорлупы, при стрессах. Широко представлен в природе, в растениях, животных тканях. Синтез происходит из глюкозы, которая сначала превращается в свободную глюкороновую к-ту, затем восстанавливается при участии НАДФН2 в L-гулоновую к-ту, далее в L- аскорбиновую к-ту. Человек, обезьяны и мор. свинки не имеют фермента – восполняют за счет пищи. Аскорбин. к-та в организме способна превращаться в дегидроаскорбиновую, участвуя в окислит. – восстан. реакциях. Важная функция – участие в реакциях гидроксилирования лизина и пролина – формирование нормальных коллагеновых волокон, а также фенилаланина до тирозина, дофамина до норадреналина. Она необходима для формирования костной ткани. Дефицит проявляется в хрупкости капилляров, кровоточивости десен, цинге. В наибольшей концентрации находится в печени и надпочечниках. Как восстанавливающий агент способствует абсорбции железа, предохраняет вит. Е и некоторые вит. группы В от окисления, выступая как оксидант, снижает риск развития опухолей, как антиоксидант, способствует использованию депонированного в форме ферритина железа для синтеза молекул гемоглобина.  47.Холин. Структура, биологическая роль. Холи́н (витамин B4) (от греч. - жёлчь) — (спирт) - гидроксид 2-оксиэтилтриметиламмония, впервые получен из желчи. Представляет собой очень гигроскопичные бесцветные кристаллы, хорошо растворимые в воде, этаноле, хуже растворимые в амиловом спирте, ацетоне и хлороформе, нерастворимые в диэтиловом эфире, сероуглероде, бензоле. Разбавленные растворы стабильны при температурах до 70°С. Холин является сильным основанием, способен вытеснять аммиак из его солей и легко образует соли с сильными кислотами. Широко распространён в живых организмах. Особенно высоко содержание его в яичном желтке, мозге, печени, почках и мышце сердца. Находится в капусте, шпинате, сое, грибах. В организме из холина синтезируется важнейший нейромедиатор-передатчик нервного импульса — ацетилхолин. Холин является важным веществом для нервной системы и улучшает память. Входит в состав фосфолипидов (лецитина). Участвует в синтезе аминокислоты метионин, где является поставщиком метильных групп. Влияет на углеводный обмен, регулируя уровень инсулина в организме. Холин является гепатопротектором и липотропным средством. В комплексе с лецитином способствует транспорту и обмену жиров в печени. Отсутствие холина в пище приводит к отложению жира в печени, поражению почек и кровотечениям. Холин необходим для лечения заболеваний печени и при атеросклерозе. В медицине для лечения заболеваний печени применяют хлорид холина. Его вводят также в состав комбикормов.  48.Ферменты – биологические катализаторы Фермент биологические катализаторы белковой природы, способные ускорять биохимические реакции. Вещество, превращение которого катализирует фермент, полу чило название с у б с т р а т (Общее уравнение биохимической реакции, катализируемой ферментом, можно записать в следующем виде: E + S ⇌ ES → EP ⇌ E + P, где Е — фермент, S — субстрат, ES, EP — комплекс фермента и субстрата, фермента и продукта реакции, соответственно, P — продукт реакции) Участок молекулы фермента, где происходит связывание и превращение субстрата, называют активным центром. Активный центр фермента функционально неоднороден. Контактный участок обеспечивает присоединение субстрата, каталитический – принимает непосредственное участие в химическом катализе. Кроме активного центра у ферментов есть аллостерический, или регуляторный центр, посредством которого осуществляется регуляция активности данного фермента. К нему могут присоединяться гормоны и их производные, различные метаболиты, медиаторы и др. 49.Номенклатура и классификация ферментов. Название фермента формируется из следующих частей: 1. название субстрата с которым он взаимодействует 2. характер катализируемой реакции 3. наименование класса ферментов (но это необязательно) 4. суффикс -аза- пируват - декарбоксил - аза, сукцинат - дегидроген – аза Поскольку уже известно порядка 3 тыс. ферментов их необходимо классифицировать. В настоящее время принята международная классификация ферментов, в основу которой положен тип катализируемой реакции. Выделяют 6 классов, которые в свою очередь делятся на ряд подклассов 1. Оксидоредуктазы. окислительно-восстановительные реакции. Делятся на 17 подклассов. Все ферменты содержат небелковую часть в виде гема или производных витаминов В2ФАД, В5.HSCoA Субстрат, подвергающийся окислению выступает как донор водорода. (лактатдегидрогеназа) 2. Трансферазы - переносит функциональныетгруппы от одно в-ва к другому Аминотрансферазы (АлАТ) - перенос аминогрупп коферментом являнтся В6 : пируват + глутамат = аланин + альфа-кетоглутарат 3. Гидролазы - реакции гидролиза, т.е. расщепление веществ с присоединением по месту разрыва связи воды. К этому классу относятся преимущественно пищеварительные ферменты, они однокомпонентные (не содержат небелковой части) липаза.4. Лиазы - реакции расщепления молекул без присоединения воды. Эти ферменты имеют небелковую часть в виде В1и В6. Лиазы связи С-С. декарбоксилазы. С-О.гидратазы-дегидратазы енолаза. С-N. С-S. 5.Изомеразы– внутримолекулярный перенос функциональных групп одного атома углерода к другому. 6. Лигазы реакции синтеза более сложных веществ из простых. Такие реакции идут с затратой энергии АТФ. К названию таких ферментов прибавляют "синтетаза". 50. Химическая структура ферментов. Доказательства белковой природы ферментов таковы: а) потеря активности при кипя чении; б) денатурация при УФ и рентгеновском облучении, действии ультразвука, кислот, щелочей, тяжелых металлов; в) гидролиз до аминокислот; г) осаждение под действием солей (высаливание) без потери каталитических свойств; д) высокая молекулярная масса, амфотерные свойства, способность к электрофорезу; е) возможность искусственного синтеза из ами нокислот (впервые так была синтезирована рибонуклеаза). Являясь белками, ферменты по строению бывают простыми и сложными. Простые ферменты состоят только из АК (аминокислот). У сложных ферментов раздичают апофермент (белковая часть молекулы) и кофермент (небелковый компонент, часто – компоненты) В целом сложный фермент (апофермент + кофермент) называется холоферментом. Свойства ферментов Являясь белками, ферменты проявляют все характерные им физико-химические свойства (растворимость, осаждаемость, способность к коогуляции и денатурации) Так же ферменты имеют специфические свойства: обратимость действия эффективность действия - ферменты превосходят все известные катализторы по каталитической эффективности специфичность - характеризует способность ферменты катализировать превращение либо 1го субстрата, либо группы похожих. Те, что катализируют только 1 субстрат - имеют индивидуальную (абсолютную) специфичность. Ферменты, способные катализировать ряда или группы похожих субстратов имеют относительную (групповую) специфичность. ферментативный катализ идет строго определенным образом на поверхности активного центра, конфигурация которого изменяется в зависимости от условий внешней среды. К этим условиям относятся: Термолабильность - чувствительность к температуре, Чувствительность к Ph среды, Ингибиторы и активаторы 51. Механизм действия ферментов. Ферменты обладают очень высокой специфичностью. Фишер (Fischer) в 1890 г. высказал предположение, что эта специфичность обусловливается особой формой молекулы фермента, точно соответствующей форме молекулы субстрата (или субстратов). Эту гипотезу часто называют гипотезой «ключа и замка»: субстрат сравнивается в ней с «ключом», который точно подходит по форме к «замку», т. е. к ферменту. В схематическом виде это представлено на рисунке. Часть молекулы фермента, вступающую в контакт с субстратом, называют активным центром фермента, и именно активный центр фермента имеет особую форму. Молекулы большей части ферментов во много раз крупнее, чем молекулы тех субстратов, которые атакует данный фермент. Активный же центр фермента составляет лишь очень небольшую часть его молекулы, обычно от 3 до 12 аминокислотных остатков. Роль остальных аминокислот, составляющих основную массу фермента, заключается в том, чтобы обеспечить его молекуле правильную глобулярную форму, которая, как мы увидим далее, очень важна для наиболее эффективной работы активного центра фермента. Образовавшиеся продукты по форме уже не соответствуют активному центру фермента. Они отделяются от него (поступают в окружающую среду), после чего освободившийся активный центр может принимать новые молекулы субстрата. В 1959 г. Кошланд (Koshland) предложил новую интерпретацию гипотезы «ключа и замка», получившую название гипотезы «индуцированного соответствия». На основе данных, позволяющих считать ферменты и их активные центры физически более гибкими, чем это казалось вначале, он заключил, что субстрат, соединяясь с ферментом, вызывает какие-то изменения в структуре его активного центра. Аминокислотные остатки, составляющие активный центр фермента, принимают определенную форму, которая дает возможность ферменту наиболее эффективным образом выполнять свою функцию. Подходящей аналогией в этом случае может служить перчатка, которая при надевании на руку соответствующим образом изменяет свою форму. Из лекции: По теории Фишера, кативный центр фермента должен строго соответствовать принимаемому субстрату (замок-ключ) Взаимодействие протекает в несколько этапов: Узнавание и сближение Взаимное изменение и приближение субстрата к активному центру. Сорбция субстрата на поверхности активного центра. Образование общих химических связей (фермент-субстратный комплекс) «Эффект дыбы» Десорбция с активного центра продукта реакции. *Сам фермент остается неизменным и способен к новому катализу. 52.Коферменты. NAD+ и NADP образуются в организме человека из витамина ннацина. Ниацин включает никотиновую кислоту и ее амид (никотинамид)— каждое из этих соединений может, выполнять функции витамина в пищевом рационе. Для синтеза NAD+ или NADP+ ферменты, находящиеся в цитозоле большинства клеток, используют только никотиновую кислоту, но не никотинамид. Никотинамидный фрагмент NAD+ образуется из никотинатного фрагмента, когда последний находится в составе нуклеотида; амидная группа поступает из глутамина Синтез NAD в организме протекает в 2 этапа:  NADP образуется из NAD путём фосфорилирования под действием цитоплазматической NAD-киназы. NAD+ + АТФ → NADP+ + АДФ |
