1. Понятие об инфекционном процессе. Механизмы, пути и факторы передачи инфекции. Входные ворота инфекции
 Скачать 0.68 Mb. Скачать 0.68 Mb.
|
|
25. Иммунокомпетентный и иммунокомпрометированный организм. Иммунокомпитентный организм — иммунологически зрелый, способный развивать иммунный ответ. Иммунокомпетентные клетки — это клетки, входящие в состав иммунной системы. Все эти клетки происходят из единой родоначальной стволовой клетки красного костного мозга. Все клетки делятся на 2 типа: гранулоциты и агранулоциты. К гранулоцитам относят нейтрофилы, эозинофилы и базофилы. К агранулоцитам: макрофаги и лимфоциты (B, T). 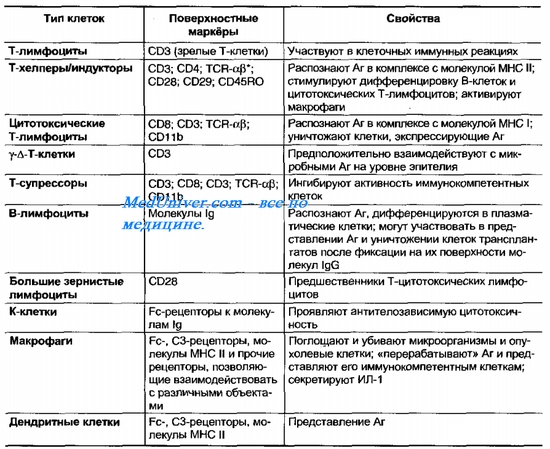 Иммунокомпромитированный организм — организм с нарушенной функцией иммунного ответа. Выделяют иммунодефициты первичные- врожденные (генетические поломки), вторичные, или преобретенные, связанные с повреждающим действием факторов внешней среды. 26. Реакция агглютинации, её разновидности, механизм и техника постановления. Реакция агглютинации применяется в лабораторной практике для идентификации выделенных микроорганизмов или для обнаружения специфических антител в сыворотке крови. Механизм реакции основан на взаимодействии детерминантных групп антигена с активными центрами иммуноглобулина в электролитной среде. Реакции протекают в две фазы - соединение антигена с антителом, вторая фаза - выделение в осадок образовавшегося комплекса АГ+АТ . Характер осадка зависит от природы антигена: жгутиковые бактерии дают крупнохлопьевый осадок, безжгутиковые и бескапсулярные - мелкозернистый, капсульные - тяжистый. Существуют два способа постановки реакции агглютинации: пластинчатый и пробирочный. Пластинчатый метод является качественной реакцией и служит для предварительного определения вида микроба. Пробирочный метод используется для определения количественного содержания антител, при этом в пробирках ставится развернутая реакция агглютинации. При положительной реакции на дне пробирки образуется осадок ( агглютинат ). За титр антител принимают последнее разведение, в котором наблюдается четкая агглютинация. Интенсивность оценивается по 4-х крестной системе. Постановка РА должна сопровождаться контролем сыворотки и антигена. Учет реакции агглютинации на стекле производится через 5 - 10 мин, пробирочной - через 18 - 20 часов. 27. Реакции пассивной агглютинации. Реакции ко-агглютинации, латекс-агглютинации и непрямой гемагглютинации. Механизм и применение. Реакции называются непрямыми (пассивными), так как при их проведении используют Аг (или Aт), искусственно сорбированные на поверхности различных частиц. Реакцию коагглютинации применяют для определения антигенов с помощью антител, адсорбированных на белке А клеток стафилококка (антительный диагностикум). Белок А имеет сродство к Fc-фрагменту иммуноглобулинов, поэтому такие бактерии, обработанные иммунной диагностической сывороткой неспецифически адсорбируют антитела сыворотки, которые затем взаимодействуют активными центрами с соответствующими микробами, выделенными от больных. В результате коагглютинации образуются хлопья, состоящие из стафилококков, антител диагностической сыворотки и определяемого микроба. Реакция латекс-агглютинации: реакция отличается высокой чувствительностью и позволяет выявлять незначительные количества антител в сыворотке, в связи с чем ее возможно использовать ее для ранней диагностики болезни. При этом частицы латекса с адсорбированными на них молекулами Аг (Ат) агглютинируются соответствующими Ат (Аг). Применяют качественный и количественный методы. Ставят по типу агглютинации реакции на стекле (реакция положительна, когда обнаруживается «зонтик») Реакция непрямой гемагглютинации (РНГА): РНГА применяют в двух вариантах: с известными антигеном для обнаружения антител или с известными антителами для выявления антигена. Эта реакция специфична и применяют ее для диагностики заболеваний вызванных бактериями и риккетсиями. Для постановки РНГА используют эритроцитарные диагностикумы, приготовленные путем адсорбции на эритроцитах антигенов или антител в зависимости от цели исследования. В положительных случаях степень агглютинации эритроцитов отмечают плюсами. Четырьмя плюсами оценивают реакцию, имеющую вид тонкой пленки из склеивающихся эритроцитов (зонтик), покрывающей дно пробирки, наличие пленки с фестончатыми кружевными краями обозначают двумя плюсами. За титр принимают предельное разведение исследуемого материала, вызывавшее агглютинацию эритроцитов на два полюса. В положительных случаях степень агглютинации эритроцитов отмечают плюсами. Четырьмя плюсами оценивают реакцию, имеющую вид тонкой пленки из склеивающихся эритроцитов (зонтик), покрывающей дно пробирки, наличие пленки с фестончатыми кружевными краями обозначают двумя плюсами. За титр принимают предельное разведение исследуемого материала, вызывавшее агглютинацию эритроцитов на два полюса. 28. Реакция преципитации, ее разновидности, механизм и применение. Реакция преципитации (РП) Феномен преципитации заключается во взаимодействии мелкодисперсных антигенов (преципитиногенов) с соответствующими антителами (преципитинами) и образованием преципитата (рис. 1). Постановку РП осуществляют двумя методами: в жидкой среде - по типу реакции флокуляции , кольцепреципитации или в плотной среде в агаре (геле). РП применяют в двух целях: выявление антигенов по известной иммунной преципитирующей сыворотке или антител с использованием известных антигенов. Существует много вариантов постановок реакции, но чаще всего используют следующие методики: реакция преципитации в геле по Оухтерлони , радиальная иммунодиффузия по Манчини , реакция иммуноэлектрофореза , реакция флокуляции , кольцепреципитации . 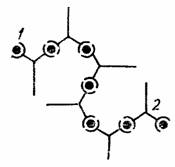 Рис. 1. Реакция преципитации:1 - антиген; 2 - антитело. Реакция преципитации в геле по Оухтерлони . Для постановки реакции используют 1% агар Дифко, который разливают расплавленным на предметные стекла или чашки Петри слоем толщиной 0,5 см. В застывшем агаре вырезают лунки диаметром 5 мм специальным приспособлением. В одну лунку помещают взвесь, содержащую исследуемый антиген, в другую - иммунную сыворотку. Антиген и антитела диффундируют в питательную среду, вступают в иммунную реакцию и образуют полосы преципитации. Учет реакции проводят предварительно через 4 часа, окончательно - через 24-48 часов. Реакцию Оухтерлони можно использовать для определения токсичности бактерий, титра антител, активности стандартных диагностикумов или иммунных специфических сывороток (рис. 2). 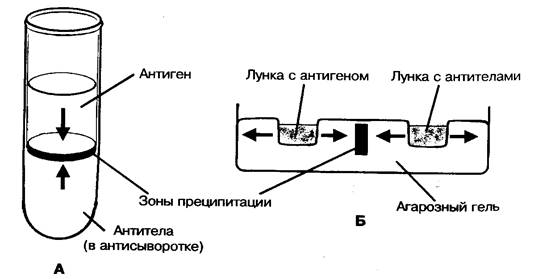 Рис. 2. Реакция преципитации: А - реакция кольцепреципитации ; Б - реакция преципитации по Оухтерлони . Реакция кольцепреципитации Данную реакцию применяют для выявления антигенов с помощью иммунной преципитирующей сыворотки, содержащей специфические антитела. Это качественный метод исследования. Реакцию проводят путем наслаивания на иммунную сыворотку среды, содержащей определенный антиген. Реакцию ставят в узких пробирках объемом 0,1- 0,5 мл. В случае соответствия антигена и антитела на границе между ними через 3-5 мин образуется кольцо преципитации (рис. 2). Необходимым условием образования нерастворимого иммунного комплекса является эквивалентное соотношение антигенов и антител. Радиальная иммунодиффузия по Манчини Радиальная иммунодиффузия по Манчини позволяет использовать моноспецифические антисыворотки и эталон с известным содержанием антигена. Тест-антиген и разведения растворов, исследуемых на наличие данного антигена, помещают в лунки, вырезанные рядами в пластине геля, куда предварительно внесена соответствующая моноспецифическая антисыворотка . Антиген диффундирует в гель и, соединившись со специфическими антителами, формирует кольца преципитации, диаметры которых зависят от концентрации антигена в лунках. Полученные результаты используют для построения калибровочной кривой, выражающей зависимость диаметров преципитантов от концентрации антигена в исследуемых растворах (рис. 3). Принцип радиальной диффузии положен в основу метода, применяемого для изучения токсигенности бактериальных культур и отбора из бактериальной популяции клонов с высокой степенью токсичности. В этом случае исследуемые культуры засевают в чашки с агаром , содержащим антитоксическую сыворотку. Вокруг отдельных колоний образуются кольца преципитации, диаметр которых прямо пропорционален степени токсичности штамма (рис. 3). 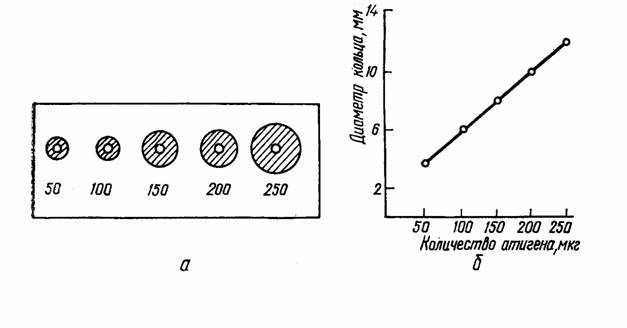 Рис. 3. Простая радиальная иммунодиффузия :а - кольца преципитации;б - калибровочная кривая. Реакция иммуноэлектрофореза (ИЭФ) В основе реакции лежит принцип преципитации. ИЭФ, как правило, используется для исследования антигенной структуры микроорганизмов. Реакцию проводят в два этапа. Вначале проводят электрофоретическое разделение антигена в забуференном агаровом геле. Антигенный комплекс помещают в лунку, которая находится в центре геля, залитого на стеклянную пластинку. Затем через гель пропускают электрический ток, в результате происходит перемещение антигенов на неодинаковые расстояния соответственно своей электрофоретической подвижности. После этого в канавку, которая расположена по краю пластинки, вносят специфическую иммунную сыворотку и помещают во влажную камеру. Антигены и антитела диффундируют в геле навстречу друг другу. В месте их соприкосновения образуются дугообразные линии преципитации. С помощью ИЭФ анализируются состав и количество белков сыворотки крови, спиномозговой жидкости, микробных протеинов (рис. 4).  Рис. 4. Реакция иммуноэлектрофореза . 29. Феномен вирусной гемагглютинации, применение и механизм реакции гемагглютинации (РГА). Реакция торможения гемагглютинации (РТГА), применение и механизм. В основе РГА лежит способность эритроцитов склеиваться при адсорбции на них определенных антигенов. В качестве исследуемого материала при гемагглютинации используют аллантоисную, амниотическую жидкость, суспензию хорионаллантоисных оболочек куринных эмбрионов, взвеси и экстракты из культур или органов животных, зараженных вирусами, нативный инфекционный материал. РГА не является серологической, поскольку происходит без участия иммунной сыворотки и используется для выбора рабочего разведения антигена для постановки РТГА или наличия антигена (вируса) в исследуемом материале (например, при гриппе). В реакции используются эритроциты животных, птиц, человека I (0) группы крови. Для постановки ориентировочной РГА на предметное стекло наносят каплю 5% взвеси эритроцитов и каплю испытуемого материала, тщательно смешивают. При положительном результате через 1-2 минуты макроскопически наблюдают появление хлопьевидной агглютинации эритроцитов. Для постановки РГА в развернутом ряду в лунках полистероловых планшетов готовят двукратно возрастающие разведения исследуемого материала на физиологическом растворе в объёме 0,5 мл. Во все пробирки вносят по 0,5 мл 0,25 - 1% взвеси эритроцитов. Результаты учитывают после полного оседания эритроцитов в контроле (эритроциты + физиологический раствор). Реакцию учитывают по характеру осадка эритроцитов. В положительных случаях степень агглютинации отмечают плюсами. Четырьмя плюсами оценивают реакцию, имеющую вид тонкой пленки из склеившихся эритроцитов, покрывающей дно пробирки (зонтик), реакцию с просветами в пленке отмечают тремя плюсами, наличие пленки с фестончатыми кружевными краями из склеившихся эритроцитов обозначают двумя плюсами, хлопьевидный осадок эритроцитов, окруженный зоной комочков агглютинированных эритроцитов соответствует одному плюсу. Резко очерченный осадок эритроцитов, неотличимый от контроля показывает отсутствие агглютинации. За титр принимают предельное разведение исследуемого материала, вызвавшее агглютинацию эритроцитов на два плюса. При положительном результате РГА исследование продолжают, определяя тип выделенного вируса с помощью реакции торможения гемагглютинации типоспецифическими сыворотками. РТГА основана на свойстве антисыворотки подавлять вирусную гемагглютинацию, так как нейтрализованный специфичными антителами вирус утрачивает способность агглютинировать эритроциты. При ориентировочном типировании вирусов используют капельный метод на стекле. Для окончательного установления типовой принадлежности выделенного вируса и титрования антител в сыворотках ставят развернутую РТГА в пробирках или в лунках. С этой целью готовят двухкратные разведения сывороток на физиологическом растворе и разливают по 0,25 мл. К разведениям сыворотки прибавляют по одной капле материала, содержащего вирус и по одной капле 1% взвеси эритроцитов. При использовании РТГА для определения типа вируса, используют типоспецифические сыворотки, которые добавляют к равному объему рабочего разведения антигена. Типовую принадлежность выделенного вируса устанавливают по специфической иммунной сыворотке, показавшей наивысший титр антител к этому вирусу. РГА и РТГА широко применяется для диагностики вирусных инфекций (клещевой энцефалит, грипп и др.) с целью обнаружения специфических антител и для идентификации многих вирусов по их антигенам. 30. Реакция нейтрализации (РН) с использованием лабораторных животных (РБН) и культуры ткани (метод цветной пробы). Механизм и применение. Реакции нейтрализации основаны на способности антител нейтрализовать in vitro биологически-активные антигенсодержащие субстраты: токсины, вирусы, яды змей и т.п. Реакция состоит в смешивании биологически-активного вещества с сывороткой, содержащей антитела, и выявлении нейтрализации его активности в биологическом тесте на животном или в культуре ткани. Эту реакцию используют при вирусных заболеваниях как для определения антител в крови больного, так и для идентификации вирусов, выделенных у больных . Принцип реакции нейтрализации заключается в том, что специфические иммунные сыворотки способны гасить инфекционное действие вируса при смешивании вирус содержащего материала и соответствующих вирусу иммунных сывороток. Эффект нейтрализации вируса антителами определяют, вводя смесь чувствительному животному, после выдерживания ее в течение определенного времени. Постановку реакции нейтрализации осуществляют в двух модификациях: 1) титруют (разводят) взвесь или исследуемый материал и соединяют эти разведения с определенной постоянной дозой иммунной сыворотки; 2) постоянную определенную дозу вируса соединяют с различными дозами иммунной сыворотки — титруют сыворотку. О результатах реакции нейтрализации судят по гибели чувствительных животных, зараженных смесью вирус содержащего материала и сыворотки, или по клинической картине заболевания. В культуре клеток определяют цитопатический эффект — гибель клеток. В случае выделения вируса у больного и при необходимости идентификации его применяют известную иммунную вирус нейтрализующую сыворотку. Реакцию нейтрализации можно также использовать при установлении типа ботулинического токсина, применяя токсиннейтрализующие специфические иммунные сыворотки, и для определения токсина возбудителя газовой гангрены. 31. Серологические реакции с использованием метки. Реакция иммунофлюоресценции (прямая и непрямая РИФ),иммуноферментный анализ (ИФА), радиоиммунный анализ (РИА), Механизм реакций. В настоящее время широко применяются серологические реакции, в которых участвуют меченые АГ-ы или АТ-ла. К ним относятся реакции иммунофлюоресценции, радиоиммунный и иммуноферментный методы. Они применяются: 1)для серодиагностики инфекционных заболеваний, т. е. для выявления АТ с помощью набора известных конъю-гированных (химически соединённых) с различными метками (ферментами, флюорохромными красителями) антигенов; 2) для определения микроорганизма или его серовара с помощью стандартных меченых диагностических антител (экспресс-диагностика). Готовят сыворотки иммунизацией животных соответствующим АГ-м, затем выделяют иммуноглобулины и конъюгируют их со светящимися красителями (флюорохромами), ферментами, радиоизотопами. Меченые СР по специфичности не уступают другим СР, а по своей чувствительности они превосходят все СР. Нет сходных материалов РИФ В качестве метки используются светящиеся флюорохромные красители (изотиоционат флюорисцеина и др.). Существуют различные модификации РИФ. Для экспресс-диагностики инфекционных заболеваний — для выявления микробов или их антигенов в исследуемом материале применяется РИФ по Кунсу. Выделяют два метода РИФ по Кунсу: прямой и непрямой. Компоненты прямой РИФ: 1) исследуемый материал (испражнение, отделяемое носоглоткой и др.); 2) меченая специфическая иммунная сыворотка, содержащая АТ-ла к искомому антигену; 3) изотонический раствор хлорида натрия. Мазок из исследуемого материала обрабатывают меченой антисывороткой. Происходит реакция АГ-АТ. При люминесцентном микроскопическом исследовании в том участке, где локализуются комплексы АГ-АТ, обнаруживают флюоресценцию — свечение. Компоненты непрямой РИФ: 1) исследуемый материал; 2) специфическая антисыворотка; 3) антиглобулиновая сыворотка (АТ-ла против иммуноглобулина), меченая флюорихромом; 4) Изотонический раствор хлорида натрия. Мазок из исследуемого материала сначала обрабатывают иммунной сывороткой к искомому антигену, а затем — меченой антиглобулиновой сывороткой. Светящиеся комплексы АГ-АТ — меченые АТ обнаруживаются при помощи люминесцентного микроскопа. Преимущество непрямого метода состоит в том, что нет необходимости приготовления широкого набора флюоресцирующих специфических сывороток, а применяется лишь одна флюоресцирующая антиглобулиновая сыворотка. Также выделяют 4-компонентную разновидность непрямой РИФ, когда дополнительно вводится комплемент (сыворотка морской свинки). При положительной реакции образуется комплекс АГ-АТ — меченые — АТ-комплемент. РИФ основана на соединении антигенов бактерий, риккетсий и вирусов со специфическими антителами, меченными флюоресцирующими красителями ( флуоресцеинизотиоцианат , родамин, В-изотицианит , лиссатинродамин В-200, сульфохлорид и др.), имеющими реакционно-способные группы ( сульфохлорид , изотиоцианит и др.). Эти группы соединяются со свободными аминогруппами молекул антител, которые не теряют при обработке флуорохромом специфического сродства к соответствующему антигену. Образовавшиеся комплексы АГ-АТ становятся хорошо видимыми, ярко светящимися структурами под люминесцентным микроскопом (рис. 7). С помощью РИФ можно обнаруживать небольшие количества бактериальных и вирусных антигенов. Метод РИФ используют в двух вариантах: прямой и непрямой метод. Прямой метод основан на непосредственном соединении антигена с меченым антителом. Непрямой метод - на поэтапном выявлении комплекса АГ-АТ с помощью флуоресцентных красителей. Первый этап заключается в образовании иммунных комплексов определенного антигена со специфическими антителами. Второй этап - в выявлении этого комплекса путем обработки его меченым антигаммаглобулином . Преимущество РИФ - простота, высокая чувствительность, скорость получения результата. РИФ применяется как метод ранней экспресс-диагностики гриппа, дизентерии, малярии, чумы, туляремии, сифилиса и др. Для проведения такого исследования используется люминесцентный микроскоп. Радиоиммунологический анализ (РИА) РИА - один из самых чувствительных методов иммунодиагностики. Его применяют для выявления антигена вируса гепатита В , у больных вирусным гепатитом. Для этого к исследуемой сыворотке добавляют референс-сыворотку (сыворотку, содержащую антитела к вирусу гепатита В). Смесь инкубируют 1-2 сут при температуре 40 ° С, затем добавляют референс-антиген (антиген, меченный изотопом 125 J) и продолжают инкубацию еще 24 часа. К образовавшемуся комплексу антиген-антитело добавляют преципитирующие антииммуноглобулины против белков референс-сыворотки , что приводит к образованию преципитата (рис. 8). Результат учитывают по наличию и числу импульсов в преципитате, зарегистрированных счетчиком. При наличии в исследуемой сыворотке антигена, связавшегося со специфическими антителами, последние не вступают в связь с меченным антигеном и, поэтому, он не обнаруживается в преципитате. Таким образом, в основу РИА положен принцип конкурентного взаимодействия определяемого антигена и известного количества меченного антигена с активными центрами антител.В качестве метки используются радиоактивные изотопы. В зависимости от техники постановки выделяют два способа РИА. 1) Техника «жидкая фаза» (классический РИА). Недостаток этой техники постановки — необходимость специального разделения свободного и связанного меченого антигенов (или антител). 2) Техника «твёрдая фаза». АГ или АТ известной специфичности связываются на сорбентах (твёрдой фазе) — стенках полистироловой лунки или пластиковой пробирки. На иммобилизованный АГ (АТ) последо-ватепьно сорбируются остальные компоненты ИК. В зависимости от характера реакции различают следующие методы: 1) Конкурентный метод — метод, основанный на конкуренции АГ. Компоненты реакции: а) определяемый АГ (исследуемый материал — кровь, мокрота и др.); б) идентичный к исследуемому АГ-у антиген, меченый радиоизотопом; в) специфические АТ-ла известной концентрации, связанные на сорбенте; г) стандартный АГ (контрольный); д) буферный раствор. Сначала в реакцию вводят исследуемый АГ. Происходит образование комплекса АГ-АТ на поверхности сорбента. Сорбент отмывают, затем вводят меченый АГ, Чем больше содержание исследуемого АГ, тем меньше меченого АГ связывается с АТ-м на поверхности сорбента. Концентрацию меченого АГ определяют измерением радиоактивности реакции с помощью счетчиков. Величина радиоактивности реакции будет обратно пропорциональной количеству АГ в исследуемой пробе. 2) Неконкурентный метод. Компоненты реакции: а) определяемый АГ; б) специфический АТ-а известной концентрации, связан- ные на сорбенте; в) идентичные к связанному антителу антитела, меченые радиоизотопом; г) стандартный АГ; д) буферный раствор. К связанным АТ добавляют исследуемый АГ. В процессе инкубации на сорбенте образуются комплексы АГ-АТ. Сорбент отмывают от свободных компонентов и добавляют меченые АТ, которые связываются со свободными валентностями АГ-на в составе комплекса. Величина радиоактивности пропорциональна концентрации исследуемого АГ. 3) «Сэндвич-метод» (непрямой метод) — наиболее распространённый метод. Компоненты: а) исследуемая сыворотка (или исследуемый АГ); б) АГ-ы, связанные на сорбенте (или АТ-ла, связанные на сорбенте при определении АГ-а); в) диагностические АТ против иммуноглобулинов, меченые радиоизотопами; г) контрольные сыворотки (или АГ-ы); д) буферные растворы. Исследуемые АТ-а (или АГ-ы) реагируют с твердофазными АГ-ми (АТ-ми), после чего инкубат удаляется и в реакцию вводят меченые антиглобулиновые АТ, которые связываются со специфическими комплексами АГ-АТ на поверхности сорбента. Величина радиоактивности реакции прямо пропорциональна количеству исследуемого АТ (или АГ). Достоинства РИА: 1) высокая специфичность и чувствительность; 2) простота техники постановки; 3) точность количественной оценки результатов; 4) легко поддаётся автоматизации. Недостаток: использование радиоактивных изотопов. Нет сходных материалов( Иммуноферментный метод (ИФА) Метод используется для выявления антигенов с помощью соответствующих им антител, конъюгированных с ферментом-меткой ( пероксидазой хрена, b - галактозой или щелочной фосфатазой). После соединения антигена с меченной ферментом иммунной сывороткой в смесь добавляют субстрат и хромоген . Субстрат расщепляется ферментом, а его продукты деградации вызывают химическую модификацию хромогена. При этом хромоген меняет свой цвет - интенсивность окраски прямо пропорциональна количеству связавшихся молекул антигена и антител (рис. 9). Наиболее распространен твердофазный ИФА, при котором один из компонентов иммунной реакции (антиген или антитело) сорбирован на твердом носителе. В качестве твердого носителя используются микропанели из полистирола. При определении антител в лунки с сорбированным антигеном последовательно добавляют сыворотку крови больных, антиглобулиновую сыворотку, меченную ферментом и смесь растворов субстрата для фермента и хромогена. Каждый раз после добавления очередного компонента из лунок удаляют не связавшиеся реагенты путем тщательного промывания. При положительном результате изменяется цвет раствора хромогена. Твердофазный носитель можно сенсибилизировать не только антигеном, но и антителом. Тогда в лунки с сорбированными антителами вносят искомый антиген, добавляют иммунную сыворотку против антигена, меченную ферментом, а за тем - смесь растворов субстрата для фермента и хромогена. ИФА применяют для диагностики заболеваний, вызванных вирусными и бактериальными возбудителями.В качестве метки используются ферменты: пероксидаза, щелочная фосфатаза и др. Индикатором реакции является способность ферментов вызывать цветные реакции при действии на соответствующий субстрат. Например, субстратом для пероксидаза является раствор ортофенилдиамина. Наиболее широко применяется твердофазный ИФА. Сущность ИФА аналогична РИА. Результаты ИФА можно оценить визуально и измерением оптической плотности на спектрофотометре. К преимуществам ИФА следует отнести: - отсутствие контакта с радиоактивными веществами; - простота методов оценки реакции; - стабильность конъюгатов; - легко поддаётся автоматизации. Однако, по сравнению с РИА, отмечают более низкую чувствительность метода, но в некоторых случаях чувствительность превосходит РИФ и РИМ. В качестве примеров приводятся следующие типы ИФА: Конкурентный тип. Назначение. Предназначена для выявления поверхностного антигена вируса гепатита В (НВз Ад) в сыворотках и плазме крови при диагностике вирусного гепатита В и определения носительства НВ5 Ад. Компоненты: 1) исследуемый материал сыворотка или плазма крови; 2) антитела к НВз Ад, адсорбированные на поверхности лунки полистиролового микропланшета; 3) коньюгат — мышиные моноклониальные антитела к НВз Ад, меченые пероксидазой, 4) ортофенилендиамин (ОФД) -субстрат; 5) фосфатно-солевой буфер; 6) контрольные сыворотки: — положительная (сыворотка с НВе Ад); — отрицательная (сыворотка без НВз Ад). Ход работы 1) Внесение контрольных и исследуемых сывороток. 2) Инкубация 1 час при 37 «С. 3) Отмывание лунок. 4) Внесение конъюгата. 5) Инкубация 1 час при 37 «С. 6) Отмывание лунок. 7) Внесение ОФД. При наличии НВз Ад раствор а лунках желтеет. Учёт ИФА проводят по оптической плотности с помощью фотометра. Степень оптической плотности будет обратно пропорциональной концентрации исследуемых НВз Ад. Механизм Реакция протекает в три фазы: 1) НВз Ад исследуемой сыворотки (плазмы) связывается с гомологичными АТ, адсорбированными на поверхности лунки. Образуется ИК АГ-АТ. (НВз Ад — агл\ НВз АТ). 2) Антитела НВз Ад, меченые пероксидазой, связываются с оставшимися свободными детерминантами НВз Ад комплекса АГ-АТ. Образуется комплекс АТ-АГ-меченые АТ {ап!1 НВз АТ-НВз Ад-ап(1 НВз АТ, меченые пероксидазой). 3) ОФД взаимодействуют (с пероксидазой) комплекса АТ-АГ-АТ и происходит жёлтое окрашивание. Непрямой тип Является основной тестовой реакцией диагностики ВИЧ-инфекции. Цель: серологическая диагностика ВИЧ-инфекции — обнаружение антител к антигенам ВИЧ, Компоненты: 1) исследуемый материал — сыворотка крови; 2) синтетические |
