1. Понятие об инфекционном процессе. Механизмы, пути и факторы передачи инфекции. Входные ворота инфекции
 Скачать 0.68 Mb. Скачать 0.68 Mb.
|
|
8. Фагоцитоз. Клетки, участующие в фагоцитозе. Стадии и виды фагоцитоза. Кислород- зависимые и кислород-независимые механизмы бактерицидности. Опсонины. Методы изучения фагоцитарной активности клеток. Фагоцитоз ― процесс, при котором специально предназначенные для этого клетки крови и тканей организма (фагоциты) захватывают и переваривают твёрдые частицы. Осуществляется двумя разновидностями клеток: циркулирующими в крови зернистыми лейкоцитами (гранулоцитами) и тканевыми макрофагами. Стадии фагоцитоза: 1. Хемотаксис. В реакции фагоцитоза более важная роль принадлежит положительному хемотаксису. В качестве хемоаттрактантов выступают продукты выделяемые микроорганизмами и активированными клетками в очаге воспаления (цитокины, лейкотриен В4, гистамин), а также продукты расщепления компонентов комплемента (С3а, С5а), протеолитические фрагменты факторов свертывания крови и фибринолиза (тромбин, фибрин), нейропептиды, фрагменты иммуноглобулинов и др. Однако, «профессиональными» хемотаксинами служат цитокины группы хемокинов. Ранее других клеток в очаг воспаления мигрируют нейтрофилы, существенно позже поступают макрофаги. Скорость хемотаксического перемещения для нейтрофилов и макрофагов сопоставима, различия во времени поступления, вероятно, связаны с разной скоростью их активации. 2. Адгезия фагоцитов к объекту. Обусловлена наличием на поверхности фагоцитов рецепторов для молекул, представленных на поверхности объекта (собственных или связавшихся с ним). При фагоцитозе бактерий или старых клеток организма хозяина происходит распознавание концевых сахаридных групп ― глюкозы, галактозы, фукозы, маннозы и др., которые представлены на поверхности фагоцитируемых клеток. Распознавание осуществляется лектиноподобными рецепторами соответствующей специфичности, в первую очередь маннозосвязывающим белком и селектинами, присутствующими на поверхности фагоцитов. В тех случаях, когда объектами фагоцитоза являются не живые клетки, а кусочки угля, асбеста, стекла, металла и др., фагоциты предварительно делают объект поглощения приемлемым для осуществления реакции, окутывая его собственными продуктами, в том числе компонентами межклеточного матрикса, который они продуцируют. Хотя фагоциты способны поглощать и разного рода «неподготовленные» объекты, наибольшей интенсивности фагоцитарный процесс достигает при опсонизации, т. е. фиксации на поверхности объектов опсонинов к которым у фагоцитов есть специфические рецепторы - к Fc-фрагменту антител, компонентам системы комплемента, фибронектину и т. д. 3. Активация мембраны. На этой стадии осуществляется подготовка объекта к погружению. Происходит активация протеинкиназы С, выход ионов кальция из внутриклеточных депо. Большое значение играют переходы золь-гель в системе клеточных коллоидов и актино- миозиновые перестройки. 4. Погружение. Происходит обволакивание объекта. 5. Образование фагосомы. Замыкание мембраны, погружение объекта с частью мембраны фагоцита внутрь клетки. 6. Образование фаголизосомы. Слияние фагосомы с лизосомами, в результате чего образуются оптимальные условия для бактериолиза и расщепления убитой клетки. Механизмы сближения фагосомы и лизосом неясны, вероятно имеется активное перемещение лизосом к фагосомам. 7. Киллинг и расщепление. Велика роль клеточной стенки перевариваемой клетки. Основные вещества участвующие в бактериолизе: пероксид водорода, продукты азотного метаболизма, лизоцим и др. Процесс разрушения бактериальных клеток завершается благодаря активности протеаз, нуклеаз, липаз и других ферментов, активность которых оптимальна при низких значениях pH. 8. Выброс продуктов деградации. Фагоцитоз может быть: - завершённым (киллинг и переваривание прошло успешно); - незавершённым (для ряда патогенов фагоцитоз является необходимой ступенью их жизненного цикла, например, у микобактерий и гонококков). Кислородзависимая микробицидная активность реализуется через образование значительного количества продуктов с токсическим действием, повреждающих микроорганизмы и окружающие структуры. За их образование ответственны НЛДФ-оксидаза (флавопротедо-цитохромредуктаза) плазматической мембраны и цитохром b, в присутствии хинонов этот, комплекс трансформирует 02 в анион супероксида (02-). Последний проявляет выраженное повреждающее действие, а также быстро трансформируется в перекись водорода по схеме: 202 + Н20 = Н202 + О2 (процесс катализирует фермент супероксид дисмутаза). Опсонины - белки, усиливающие фагоцитоз: IgG, белки острой фазы (С-реакгивный протеин, маннансвязывающий лектин); липополисахаридсвязывающий протеин, компоненты комплемента - СЗb, С4Ь; сурфактантные протеины легких SP-A, SP-D. Методы изучения фагоцитарной активности клеток. Для оценки фагоцитарной активности лейкоцитов периферической крови к цитратной крови, взятой из пальца, в объеме 0,2 мл, добавляют 0,25 мл взвеси микробной культуры с концентрацией 2 млрд. микробов в 1 мл. Смесь инкубируют 30 мин при 37°С, центрифугируют при 1500 об/мин в течение 5-6 мин, удаляют надосадочную жидкость. Осторожно отсасывают тонкий серебристый слой лейкоцитов, готовят мазки, сушат, фиксируют, красят краской Романовского-Гимза. Препараты сушат и микроскопируют. Подсчет поглощенных микробов ведут в 200 нейтрофилах (50 моноцитов). Интенсивность реакции оценивают по следующим показателям: 1. Фагоцитарный показатель (фагоцитарная активность) — процент фагоцитов из числа сосчитанных клеток. 2. Фагоцитарное число (фагоцитарный индекс) — среднее число микробов, поглощенное одним активным фагоцитом. Для определения переваривающей способности лейкоцитов периферической крови готовят смесь взятой крови и суспензии микроорганизма и выдерживают в термостате при 37°С 2 часа. Приготовление мазков аналогично. При микроскопии препарата жизнеспособные микробные клетки увеличены в размерах, переваренные же менее интенсивно окрашены, меньших размеров. Для оценки переваривающей функции используют показатель завершенности фагоцитоза – отношение количества переваренных микробов к общему числу поглощенных микробов, выраженное в процентах. 9. Гуморальные факторы резистентности. Лизоцим, нормальные антитела, белки острой фазы. Гуморальные факторы неспецифической резистентности состоят из разнообразных белков, содержащихся в крови и жидкостях организма. Они сами могут обладать антимикробными свойствами или способны активизировать другие гуморальные и клеточные механизмы иммунитета. Эти вещества осуществляют функцию первичной защиты от чужеродных антигенных и неантигенных частиц. Количество этих гуморальных факторов значительно. К числу более активных, или наилучшим образом изученных, следует отнести нормальные антитела, лизоцим, комплемент, пропердин, лейкины, бета-лизины и др. По химической структуре лизоцим относится к полипептидам. Он растворим в слабокислой среде, устойчив к непродолжительному кипячению, к трипсину. Лизоцим (мурамидаза) способен расщеплять основное вещество клеточной стенки бактерии муреин путем разрушения связи между первым углеродным атомом n-ацетилмурамовой кислоты и четвертым углеродным атомом n-ацетилглюкозамина, входящего в состав клеточной стенки бактерий. В результате этого изменяется ее проницаемость. Лизоцим является мощным защитным фактором слизистой оболочки полости рта, глаза, содержится в слезах, слюне, крови, материнском молоке, тканях различных внутренних органов. Высокая концентрация лизоцима выявляется в околоплодных оболочках и водах плода. Основная масса лизоцима синтезируется, по-видимому, тканевыми макрофагами и нейтрофилами. Лизоцим выполняет в организме важные биологические функции: бактерицидное действие, стимулирующее воздействие на фагоцитоз, способность нейтрализовать некоторые микробные токсины, а также противовоспалительное действие. В сыворотке людей и животных выявляются нормальные антитела против различных микробных антигенов. Они обладают агглютинирующим, комплементсвязывающим, литическим, нейтрализующим влиянием на микробные антигены. Сыворотка крови может содержать иммуноглобулины даже по отношению к антигенам, о которых заведомо известно, что они никогда не поступали в данный организм. Такие антитела получили название естественных или «нормальных». Они обычно определяются в низких титрах, однако их иммунологическая роль довольно выражена, особенно по отношению к инфекционным агентам. Считается, что нормальные антитела появляются в результате так называемой неприметной иммунизации возбудителями или антигенами, поступающими с пищей, однако нельзя отрицать и спонтанный (генетически обусловленный) механизм их образования. Реакции антител по отношению к антигенам, о которых заведомо известно, что они не проникали в данный организм, могут расцениваться и как перекрестные, отсюда и их более низкие титры. Нормальные антитела могут поступать трансплацентарно или с молоком матери. Белки острой фазы – большая группа белков, обладающих антимикробным действием, способствующих фагоцитозу, активации комплемента, формированию и ликвидации воспалительного очага. Белки острой фазы продуцируются в печени под действием цитокинов. Основную массу белков острой фазы составляют С-реактивный белок и сывороточные амилоиды А и Р, а также – факторы свертывания крови, металлосвязывающие белки, ингибиторы протеаз, компоненты комплемента и некоторые другие.
10. Комплемент, понятие, роль в реакциях неспецифической резистентности, механизм действия. Классический и альтернативный пути активации комплемента. Комплемент представляет собой систему сывороточных белков. Известно не менее 18 белков, составляющих систему комплемента. Восемь из них являются индивидуальными белками, а один представляет комплекс: 4 белка системы пропердина , один - ингибитор фермента активатора. Согласно номенклатуре, принятой ВОЗ, система комплемента обозначается символом С , а ее индивидуальные компоненты символами Cl , C2 и т. д. Каждая белковая фракция обладает определенными свойствами. Комплемент находится в сыворотке крови различных животных и человека, но наибольшее его количество обнаружено в сыворотке крови морских свинок, поэтому в практике препарат «комплемент» отождествляется с сывороткой морской свинки. В норме фракции комплемента находятся в неактивном состоянии. Они становятся активными в процессе многоступенчатых превращений, разделяемых на классический и альтернативный пути активации. При классическом пути начальным активатором комплемента является комплекс антиген-антитело. Активируют систему комплемента IgM и большинство подклассов IgG (IgG1, IgG3) в большей степени, IgG2 - в меньшей. При альтернативном пути активаторами являются полисахариды, в том числе зимозан и инулин, липополисахариды (эндотоксины), агрегаты - IgA . Дальнейший ход активации аналогичен классическому пути. В активном состоянии комплемент участвует в специфических иммунологических реакциях организма, при бактериолизе, ускоряет специфическую агглютинацию, преципитацию, усиливает, фагоцитоз, участвует в реакциях нейтрализации. Активированные компоненты комплемента действуют в определенном порядке - в виде каскада ферментов, при этом продукт предшествующей реакции служит катализатором для включения в последующую реакцию компонента и субкомпонента. Комплемент является важным фактором гомеостаза и регулируется механизмами последнего. Комплемент отличается от иммуноглобулинов тем, что его концентрация в сыворотке крови не повышается в результате иммунизации. Содержание и уровень комплемента в крови можно использовать как тест, характеризующий состояние естественной резистентности макроорганизма : высокое содержание комплемента в крови считается благоприятным признаком; снижение уровня комплемента является отрицательным прогностическим показателем. Для определения титра комплемента исследуемую сыворотку разводят и добавляют гемолитическую систему (смесь равных объемов эритроцитов барана и гемолитической сыворотки). Пробирки инкубируют при 37 °С 30 минут, встряхивая каждые 10 минут. Для контроля готовят разведения эритроцитов и дистиллированной воды: 0,1мл + 2,9мл (соответствует 20% гемолизу); 0,25мл + 2,75мл (соответствует 50% гемолизу); 0,35мл + 2,65мл (соответствует 70% гемолизу). После инкубации содержимое пробирки центрифугируют при 1500 об / мин 5 минут и определяют пробирку, соответствующую 50% гемолизу. Количество комплемента, внесенное в эту пробирку, делят на исходное разведение и узнают какое количество неразведенной сыворотки дает этот феномен. Эта величина будет соответствовать 1 единице СН 50 . Вычисляют, сколько таких единиц будет в 1 мл неразведенной сыворотки. Пути активации и физиологические функции компонентов комплемента : 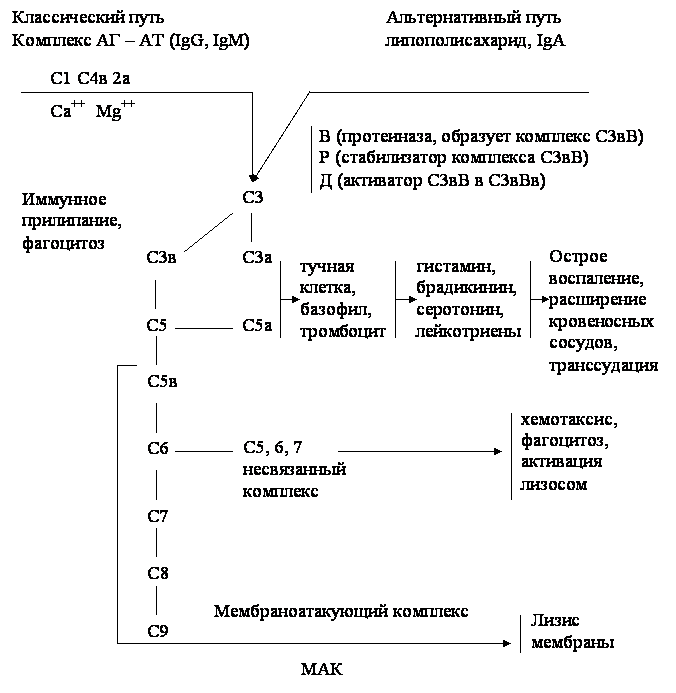 11. Интерфероны, природа, механизм действия, способы получения, применение. Понятие об интерфероногенах. Интерфероны – группа белков с противовирусным действием, вырабатываемых эукариотическими клетками в ответ на внедрение в них ряда биологических агентов – интерфероногенов. Представляет собой семейство белков-гликопротеидов с молекулярной массой от 15 до 70 кДа. В зависимости от того, какими клетками синтезируется интерферон, выделяют три типа: α, β и γ. Альфа-интерферон вырабатывается лейкоцитами, бета- фибробластами, гамма- вырабатывается активированными Т-лимфоцитами, макрофагами, естественными киллерами, т. е. иммунными клетками. Помимо противовирусного действия интерферон обладает противоопухолевой защитой, т к задерживает пролиферацию опухолевых клеток, а также иммуномодулирующей активностью, стимулируя фагоцитоз, естественные киллеры, регулируя антителообразование В-клетками, активируя экспрессию главного комплекса гистосовместимости. Механизм действия интерферона сложен. Интерферон непосредственно на вирус вне клетки не действует, а связывается со специальными рецепторами клеток и оказывает влияние на процесс репродукции вируса внутри клетки на стадии синтеза белков. Действие интерферона тем эффективнее, чем раньше он начинает синтезироваться или поступать в организм извне. Поэтому его используют с профилактической целью про многих вирусных инфекциях, например гриппе, а также с лечебной целью при хронических вирусных инфекциях( гепатиты, герпес, рассеянный склероз) Интерфероны обладают видоспецифичностью, т е интерферон человека менее эффективен для животных и наоборот. Получают интерферон двумя способами: а) путем инфицирования культуры лейкоцитов или лимфоцитов крови человека безопасным вирусом, в результате чего инфицированные клетки синтезируют интерферон, к-й затем выделяют и конструируют из него препараты интерферона. б) генно-инженерным способом – путем выращивания в производственных условиях рекомбинантных штаммов бактерий, способных продуцировать интерферон. Обычно используют рекомбинантные штаммы псевдомонад, кишечной палочки со встроенными в и ДНК генами интерферона. Рекомбинантный интерферон нашел широкое применение в медицине как профилактическое и лечебное средство при вирусных инфекциях и при иммунодефицитах. Интерфероногены - факторы, индуцирующие синтез интерферонов клетками позвоночных животных. Из природных факторов такими св-вами обладают РНК- и ДНК-геномные вирусы, некоторые виды бактерий, актиномицетов, риккетсий, хламидий, микоплазм, токсоплазмы, плазмодии, НК, липополисахариды бактерий, полисахариды грибов, природные полифенолы. Из синтетических веществ синтез интерферонов индуцируют полифосфаты, поликарбоксилаты, пропандиамин, основные красители. 12. Нормограмма резистентности. Механизмы противомикробной защиты 1. Понятие противомикробной резистентности 2. Неспецифическая микробная резистентность 3. Фагоцитоз 1. Одним из определяющих факторов, участвующих в развитии инфекции и соответственно инфекционных заболеваний,являетсявосприимчивый макроорганизм. Совокупность механизмов, определяющих невосприимчивость (устойчивость) организма к действию любого микробного агента, обозначается термином "противомикробная (антимикробная) резистентность". Это одно из проявлений общей физиологической реактивности макроорганизма, его реакции на своеобразный раздражитель — микробный агент. Противомикробная резистентность сугубо индивидуальна, ее уровень определяется генотипом организма, возрастом, условиями жизни и труда и т. д. Повышению широкого комплекса факторов неспецифической защиты, в частности, способствуют ранее прикладывание к груди и грудное вскармливание. По специфичности механизмы противомикробной зашиты делятся: -на неспецифические — первый уровень защиты от микробных агентов; -специфические — второй уровень защиты, обеспечиваемый иммунной системой. Реализуется следующим образом: -через антитела — гуморальный иммунитет; . - через функцию клеток-эффекторов (Т-киллеров и макрофагов) — клеточный иммунитет. Первый и второй уровни защиты тесно связаны между собой через макрофаги. Неспецифические и специфические механизмы противомикробной защиты могут быть тканевыми (связанными с клетками) игуморальными. 2.Неспецифическая микробная резистентность — это врожденное свойство макриорганизма, обеспечивается передаваемыми понаследству достаточно многочисленными механизмами, которые делятся на следующие типы: - тканевые; - гуморальные; - выделительные (функциональные). К тканевым механизмам неспецифической естественной противомикробной защиты относятся: • барьерная функция кожи и слизистых оболочек; • колонизационная резистентность, обеспечиваемая нормальной микрофлорой; • воспаление и фагоцитоз (может также участвовать в специфической защите); • барьерфиксирующая функция лимфоузлов; • ареактивность клеток; • функция естественных киллеров. Первым барьером на пути проникновения микробов во внутреннюю среду организма являются кожа и слизистые оболочки.Здоровая неповрежденная кожа и слизистые для большинства микроорганизмов непроницаемы. Однако некоторые виды возбудителей инфекционных заболеваний способны проходить и через них. Такие возбудители получили название особо опасных, к ним относят возбудителей чумы, туляремии, сибирской язвы, некоторых микозов и вирусных инфекций. Работа с ними проводится в специальных защитных костюмах и только в специально оборудованных лабораториях. Помимо чисто механической функции, кожа и слизистые оболочки обладают антимикробным действием — нанесенные на кожу бактерии (например, кишечная палочка) довольно быстро погибают. Бактерииидность кожи и слизистых оболочек обеспечивают: • ее нормальная микрофлора (функция колонизационной рези-стентности); • секреты потовых (молочная кислота) и сальных (жирные кислоты) желез; • лизоцим слюны, слезной жидкости и др. Если возбудитель преодолевает кожно-слизистый барьер, то он попадает в подкожную клетчатку/подслизистый слой, где реализуется один из основных неспецифических тканевых механизмов защиты — воспаление. В результате развития воспаления происходит: • отграничение очага размножения возбудителя от окружающих тканей; • его задержка в месте внедрения; • замедление размножения; • в конечном счете — его гибель и удаление из организма. 3. В ходе развития воспаления реализуется еще один универсальный тканевой механизм неспецифической защиты — фагоцитоз. Явление фагоцитоза было открыто и изучено великим русским ученым И. И. Мечниковым. Итогом этих многолетних работ стала фагоцитарная теория иммунитета, за создание которой Мечников был удостоен Нобелевской премии. Фагоцитарный механизм защиты слагается из нескольких последовательных фаз: • узнавание; • таксис; • аттракция; • поглощение; • киллинг; • внутриклеточное переваривание. Фагоцитоз со всеми стадиями называется завершенным.Если фазы киллинга и внутриклеточного переваривания не наступают, то фагоцитоз становится незавершенным. При незавершенном фагоцитозе микроорганизмы сохраняются внутри лейкоцитов и вместе с ними разносятся по организму. Таким образом, незавершенный фагоцитоз вместо механизма защиты превращается в его противоположность, помогая микроорганизмам защищаться от воздействия макроорганизма и распространяться в нем. |
