экзамен по гисте 2 курс. 1. Понятие прогенеза и эмбриогенеза. Периоды и основные стадии эмбриогенеза у человека. Половые клетки человека, их структурногенетическая характеристика
 Скачать 2.3 Mb. Скачать 2.3 Mb.
|
АнтигеныАнтигены — это сложные органические вещества, способные при поступлении в организм человека и животных вызывать специфический иммунный ответ. Свойствами антигенов обладают бактерии, вирусы, паразиты, чужеродные клетки и ткани, мутировавшие собственные клетки тела (например, раковые), продукты жизнедеятельности чужеродных клеток — белки, полисахариды, полипептиды, а также искусственные высокополимерные соединения. Другими словами, антигены – все те вещества, которые несут признаки генетической чужеродности и при введении в организм вызывают развитие специфических иммунологических реакций. Антитела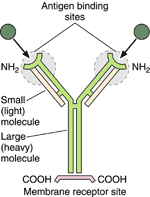 Антитела — это сложные белки, синтезируемые В-лимфоцитами и плазмоцитами, способные специфически соединяться с соответствующими антигенами (например, с бактериальными) и обезвреживать их. Обнаружение антител в глобулиновой (гамма-) фракции белков крови обусловило их название —иммуноглобулины (Ig). Выявлено несколько классов иммуноглобулинов — IgG, IgM, IgA, IgD, IgE. Молекула антитела имеет форму Y [рогатки] и состоит из четырех полипептидных цепей — двух идентичных тяжелых цепей — Н-цепей (heavy chains) и параллельно расположенных двух идентичных легких цепей — L-цепей (англ. light chains), соединенных дисульфидными (S—S) мостиками. Каждая Н- и L-цепь иммуноглобулиновой молекулы имеет вариабельные области V (variable), располагающиеся на обоих ветвях Н- и L-цепей [т.е. на обоих вершинах рогатки], и постоянные области С (constant) [в основании рогатки]. В двух вариабельных областях находятся антигенсвязывающие участки — два Fab-фрагмента (fragment antigen bilding) — места распознавания и связывания антигена. Постоянные области находятся в Fc-фрагменте (fragment crysralline), образованном лишь Н-цепями. Эти области обеспечивают связывание компонентов комплемента и/или клеточных рецепторов. Выявлено 5 типов тяжелых цепей (µ, γ, α, ε, δ ) и 2 типа легких цепей (κ, λ), различные сочетания которых обеспечивают образование множества разновидностей антител с уникальными участками связывания антигенов. Антитела в высоких концентрациях находятся в крови и лимфе, а также в жидких секретах (молоко, слезы, пот, вагинальный секрет, секрет предстательной железы и др.). Антитела инактивируют вирусы, токсины, бактерии. С их помощью на микроорганизмах фиксируются белки плазмы крови системы комплемента, что приводит к активации поглощения микробов фагоцитами и их последующей гибели. Фиксация антител на чужеродных клетках (например, на опухолевых) способствует уничтожению последних Т-лимфоцитами—киллерами. Система комплементаКомплементом является группа белков, содержащихся в свежей сыворотке крови человека и животных и активизирующихся в тех случаях, когда антитело связывается с антигеном. Этот процесс приводит к лизису определенных типов клеток (лизис, опосредованный комплементом) или к образованию биологически активных веществ из белков комплемента, которые, прикрепляясь к бактериям, облегчают их фагоцитоз нейтрофилами. Такие вещества называют опсонинами. Комплекс гистосовместимостиАнтигены гистосовместимости — это гликопротеины, существующие на поверхности всех клеток. Первоначально были определены как главные антигены-мишени в реакциях на трансплантат. Пересадка ткани взрослого донора особи того же вида (аллотрансплантация) или иного вида (ксенотрансплантация) приводит обычно к ее отторжению. Эксперименты по пересадке кожи между разными линиями мышей показали, что отторжение трансплантата обусловлено иммунной реакцией на чужеродные антигены, находящиеся на поверхности его клеток. Позднее было показано, что в этих реакциях участвуют Т-клетки. Реакции направлены против генетически «чужеродных» вариантов гликопротеинов клеточной поверхности, получивших название молекул гистосовместимости (т.е. совместимости тканей). 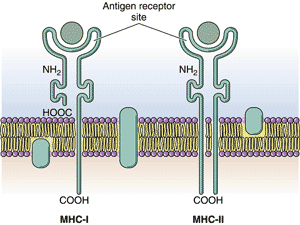 Главные молекулы гистосовместимости — семейство гликопротеинов, кодируемое генами, составляющими главный комплекс гистосовместимости (МНС — major histocompatibility complex). В пределах МНС локализованы гены, контролирующие главные трансплантационные антигены и гены, определяющие интенсивность иммунного ответа на тот или иной конкретный антиген, - так называемые Ir-гены (immune response). Молекулы МНС имеются на поверхности клеток всех высших позвоночных. Впервые они были найдены у мышей и названы антигенами Н2 (histocompatibility-2). У человека они носят название HLA (лейкоцитарных, human leucocyte-associated), так как были первоначально обнаружены на лейкоцитах. Существует два основных класса молекул МНС, каждый из которых представляет собой набор гликопротеинов клеточной поверхности. Молекулы МНС класса I экспрессируются практически на всех клетках, молекулы класса II — на клетках, участвующих в иммунных ответах (лимфоцитах, макрофагах). Молекулы класса I узнаются цитотоксическими Т-клетками (киллерами), которые должны взаимодействовать с любой клеткой организма, оказавшейся зараженной вирусом, тогда как молекулы класса II узнаются Т-хелперами (Тх), которые взаимодействуют в основном с другими клетками, участвующими в иммунных ответах, такими как В-лимфоциты и макрофаги (антигенпредставляющие клетки). Согласно клонально-селекционной теории иммунитета, в организме существуют многочисленные группы (клоны) лимфоцитов, генетически запрограммированные реагировать на один или несколько антигенов. Поэтому каждый конкретный антиген оказывает избирательное действие, стимулируя только те лимфоциты, которые имеют сродство к его поверхностным детерминантам. При первой встрече с антигеном (т.н. первичный ответ) лимфоциты стимулируются и подвергаются трансформации в бластные формы, которые способны к пролиферации и дифференцировке в иммуноциты. В результате пролиферации увеличивается число лимфоцитов соответствующего клона, «узнавших» антиген. Дифференцировка приводит к появлению двух типов клеток — эффекторных и клеток памяти. Эффекторные клетки непосредственно участвуют в ликвидации или обезвреживании чужеродного материала. К эффекторным клеткам относятся активированные лимфоциты и плазматические клетки. Клетки памяти — это лимфоциты, возвращающиеся в неактивное состояние, но несущие информацию (память) о встрече с конкретным антигеном. При повторном введении данного антигена они способны обеспечивать быстрый иммунный ответ большей интенсивности (т.н.вторичный ответ) вследствие усиленной пролиферации лимфоцитов и образования иммуноцитов. В зависимости от механизма уничтожения антигена различают клеточный иммунитет и гуморальный иммунитет. При клеточном иммунитете эффекторными клетками являются цитотоксические Т-лимфоциты, или лимфоциты-киллеры (убийцы). Они непосредственно участвуют в уничтожении чужеродных клеток других органов или патологических собственных (например, опухолевых) клеток, и выделяют литические вещества. Такая реакция лежит в основе отторжения чужеродных тканей в условиях трансплантации или при действии на кожу химических (сенсибилизирующих) веществ, вызывающих повышенную чувствительность (т.н. гиперчувствительность замедленного типа) и другие реакции. При гуморальном иммунитете эффекторными клетками являются плазматические клетки, которые синтезируют и выделяют в кровь антитела. Некоторые термины из практической медицины:
66. Хар-ка В-лимфоцитов. • В-лимфоциты являются основными клетками, участвующими в гуморальном иммунитете. У человека они образуются из СКК красного костного мозга, затем поступают в кровь и далее заселяют В-зоны периферических лимфоидных органов — селезенки, лимфатических узлов, лимфоидные фолликулы многих внутренних органов. В крови их содержится 10—30% от всей популяции лимфоцитов. • Для В-лимфоцитов характерно наличие на плазмолемме поверхностных иммуноглобулиновых рецепторов (SIg или MIg) для антигенов. Каждая В-клетка содержит 50000...150000 антигенспецифических молекул SIg. В популяции В-лимфоцитов находятся клетки с различными SIg: большинство (⅔) содержат IgM, меньшее число (⅓) — IgG и около 1—5 % — IgA, IgD, IgE. В плазмолемме В-лимфоцитов имеются также рецепторы для комплемента (С3) и Fc-рецепторы. • При действии антигена В-лимфоциты в периферических лимфоидных органах активизируются, пролиферируют, дифференцируются в плазмоциты, активно синтезирующие антитела различных классов, которые поступают в кровь, лимфу и тканевую жидкость. • Дифференцировка В-лимфоцитов • Предшественники В-клеток (пре-В-клетки) развиваются в дальнейшем у птиц в фабрициевой сумке (bursa), откуда произошло название В-лимфоциты, у человека и млекопитающих — в костном мозге. • Сумка Фабрициуса (bursa Fabricii) — центральный орган иммунопоэза у птиц, где происходит развитие В-лимфоцитов, находится в области клоаки. Для ее микроскопического строения характерно наличие многочисленных складок, покрытых эпителием, в которых расположены лимфоидные узелки, ограниченные мембраной. В узелках содержатся эпителиоциты и лимфоциты на различных стадиях дифференцировки. В период эмбриогенеза в центре фолликула формируется мозговая зона, а на периферии (снаружи от мембраны) — корковая зона, в которую, вероятно, мигрируют лимфоциты из мозговой зоны. В связи с тем что в сумке Фабрициуса у птиц образуются исключительно В-лимфоциты, она является удобным объектом для изучения строения и иммунологических характеристик этого вида лимфоцитов. Для ультрамикроскопического строения В-лимфоцитов характерно наличие в цитоплазме групп рибосом в виде розеток. Эти клетки имеют более крупные ядра и менее плотный хроматин, чем у Т-лимфоцитов, в связи с увеличением содержания эухроматина. • В-лимфоциты отличаются от других типов клеток способностью синтезировать иммуноглобулины. Зрелые В-лимфоциты экспрессируют Ig на клеточной мембране. Такие мембранные иммуноглобулины (MIg) функционируют как антигенспецифические рецепторы. • Пре-В-клетки синтезируют внутриклеточный цитоплазматический IgM, но не имеют поверхностных иммуноглобулиновых рецепторов. Костномозговые виргильные В-лимфоциты имеют IgM-рецепторы на своей поверхности. Зрелые В-лимфоциты несут на своей поверхности иммуноглобулиновые рецепторы различных классов — IgM, IgG и др. • Дифференцированные В-лимфоциты поступают в периферические лимфоидные органы, где при действии антигенов происходят пролиферация и дальнейшая специализация В-лимфоцитов с образованием плазмоцитов и В-клеток памяти (ВП). • В ходе своего развития многие В-клетки переключаются с выработки антител одного класса на выработку антител других классов. Этот процесс называется переключением класса. Все В-клетки начинают свою деятельность по синтезу антител с выработки молекул IgM, которые встраиваются в плазматическую мембрану и служат рецепторами для антигена. Затем, еще до взаимодействия с антигеном, большая часть В-клеток переходит к одновременному синтезу молекул IgM и IgD. Когда виргильная В-клетка переходит от выработки одного лишь мембраносвязанного IgM к одновременному синтезу мембраносвязанных IgM и IgD, переключение происходит, вероятно, благодаря изменению процессинга РНК. • При стимуляции антигеном некоторые из этих клеток активируются и начинают выделять антитела IgM, преобладающие в первичном гуморальном ответе. • Другие стимулированные антигеном клетки переключаются на выработку антител классов IgG, IgE или IgA; В-клетки памяти несут эти антитела на своей поверхности, а активные В-клетки их секретируют. Молекулы IgG, IgE и IgA в совокупности называются антителами вторичных классов, так как они, по-видимому, образуются только после антигенной стимуляции и преобладают во вторичных гуморальных ответах. • При помощи моноклональных антител удалось выявить определенные дифференцировочные антигены, которые еще до появления цитоплазматических µ-цепей позволяют отнести несущий их лимфоцит к В-клеточной линии. Так, антиген CD19 является самым ранним маркером, позволяющим отнести лимфоцит к В-клеточному ряду. Он присутствует на пре-В-клетках в костном мозге, на всех периферических В-клетках. • Антиген, выявляемый моноклональными антителами группы CD20, специфичен для В-лимфоцитов и характеризует более поздние стадии дифференцировки. • На гистологических срезах антиген CD20 выявляется на В-клетках герминативных центров лимфоидных узелков, в корковом веществе лимфатических узлов. В-лимфоциты несут также ряд других (например, CD24, CD37) маркеров. 67. Макрофаги играют важную роль как в естественном, так и в приобретенном иммунитете организма. Участие макрофагов в естественном иммунитете проявляется в их способности к фагоцитозу и в синтезе ряда активных веществ — пищеварительных ферментов, компонентов системы комплемента, фагоцитина, лизоцима, интерферона, эндогенного пирогена и др., являющихся основными факторами естественного иммунитета. Их роль в приобретенном иммунитете заключается в пассивной передаче антигена иммунокомпетентным клеткам (Т- и В-лимфоцитам), в индукции специфического ответа на антигены. Макрофаги также участвуют в обеспечении иммунного гомеостаза путем контроля над размножением клеток, характеризующихся рядом отклонений от нормы (опухолевые клетки). Для оптимального развития иммунных реакций при действии большинства антигенов необходимо участие макрофагов как в первой индуктивной фазе иммунитета, когда они стимулируют лимфоциты, так и в его конечной фазе (продуктивной), когда они участвуют в выработке антител и разрушении антигена. Антигены, фагоцитированные макрофагами, вызывают более сильный иммунный ответ по сравнению с теми, которые не фагоцитированы ими. Блокада макрофагов введением в организм животных взвеси инертных частиц (например, туши) значительно ослабляет иммунный ответ. Макрофаги способны фагоцитировать как растворимые (например, белки), так и корпускулярные антигены. Корпускулярные антигены вызывают более сильный иммунный ответ. Некоторые виды антигенов, например пневмококки, содержащие на поверхности углеводный компонент, могут быть фагоцитированы лишь после предварительнойопсонизации. Фагоцитоз значительно облегчается, если антигенные детерминанты чужеродных клеток опсонизированы, т.е. соединены с антителом или комплексом антитела и комплемента. Процесс опсонизации обеспечивается присутствием на мембране макрофага рецепторов, которые связывают часть молекулы антитела (Fc-фрагмент) или часть комплемента (С3). С мембраной макрофага у человека непосредственно могут связываться только антитела класса IgG, когда они находятся в комбинации с соответствующим антигеном. IgM могут связываться с мембраной макрофага в присутствии комплемента. Макрофаги способны «распознавать» растворимые антигены, например гемоглобин. В механизме распознавания антигена выделяют два этапа, тесно связанных друг с другом. Первый этап заключается в фагоцитозе и переваривании антигена. Во втором этапе в фаголизосомах макрофага накапливаются полипептиды, растворимые антигены (сывороточные альбумины) и корпускулярные бактериальные антигены. В одних и тех же фаголизосомах может быть обнаружено несколько введенных антигенов. Изучение иммуногенности различных субклеточных фракций выявило, что наиболее активное антителообразование вызывает введение в организм лизосом. Антиген обнаруживается также в мембранах клеток. Выделяемая макрофагами большая часть переработанного материала антигенов оказывает стимулирующее влияние на пролиферацию и дифференцировку клонов Т- и В-лимфоцитов. Небольшое количество антигенного материала может длительное время сохраняться в макрофагах в виде химических соединений, состоящих не менее чем из 5 пептидов (возможно, в связи с РНК). В В-зонах лимфатических узлов и селезенки имеются специализированные макрофаги (дендритные клетки), на поверхности многочисленных отростков которых сохраняются многие антигены, попадающие в организм и передающиеся соответствующим клонам В-лимфоцитов. В Т-зонах лимфатических фолликулов расположены интердигитирующие клетки, влияющие на дифференцировку клонов Т-лимфоцитов. Таким образом, макрофаги принимают непосредственное активное участие в кооперативном взаимодействии клеток (Т- и В-лимфоцитов) в иммунных реакциях организма. Участие тучных клеток и эозинофилов в иммунных реакцияхПри первичном и особенно при повторном введении антигенов наблюдаются увеличение числа тучных клеток, их контакт с макрофагами и массовая дегрануляция. Высказывается предположение, что дегрануляция обусловлена соединением антигена с антителами (IgE), фиксированными на цитолемме. При этом выделяются содержащиеся в гранулах биологически активные вещества (гистамин, серотонин, гепарин), которые могут оказывать неспецифическое стимулирующее влияние на процессы пролиферации и дифференцировки иммунокомпетентных клеток Т- и В-лимфоцитов. Появление в тканях избытка гистамина приводит к увеличению числа эозинофилов, которые участвуют в его разрушении (они выделяют гистаминазу). Введение в организм большинства антигенов сопровождается увеличением числа эозинофилов в тканях и регионарных лимфатических узлах. В ранней (индуктивной) фазе иммунной реакции, когда происходит «распознавание антигена», эозинофилы, как и тучные клетки, принимают участие в активизации макрофагов. В продуктивной фазе иммунитета (выработка антител) эозинофилы выполняют дезинтоксикационную функцию, участвуя в фагоцитозе и разрушении комплекса антиген — антитело. Механизмы интеграции элементов иммунной системыИммунная система функционирует как единое целое благодаря наличию центральных нейрогуморальных и местных факторов, регулирующих процессы пролиферации и дифференцировки клеток, упорядоченную миграцию, осуществляемую через кровь и лимфу. В эмбриональный период происходит переключение кроветворения из желточного мешка в печень и далее в костный мозг. У взрослых основным поставщиком СКК становится костный мозг, при этом в кровь мигрирует за сутки около 2% всех стволовых клеток костного мозга. При действии антигенов их число увеличивается в десятки раз. Предполагают, что процесс миграции СКК из костного мозга и их рециркуляция находятся под контролем гормонов гипофиза и надпочечников. Глюкокортикоидные гормоны коры надпочечников препятствуют избыточной миграции СКК и тем самым предохраняют их от «перерасходования». Циркуляция лимфоцитов зависит также от специфических взаимодействий между поверхностью лимфоцита и поверхностью специализированных эндотелианых клеток, выстилающих посткапиллярные венулы с высоким эндотелием — HEV (hight endothelial venulae) во вторичных лимфоидных органах: лимфоциты временно прикрепляются к ним, а затем мигрируют через посткапиллярные венулы. Моноклональные антитела, связываясь с поверхностью лимфоцитов и подавляя их способность присоединяться к специализированным эндотелиальным клеткам в срезах тканей, а также циркулировать in vivo, помогают определить различные «homing-рецепторы» на эндотелиоцитах, от которых зависят пути миграции лимфоцитов. Различают два типа миграции клеток иммунной системы: медленный и быстрый. Продолжительность медленной миграции измеряется неделями. Медленный тип миграции характерен для стволовых клеток и Т- и В-лимфоцитов, заселяющих периферические лимфоидные органы. Быстрый тип миграции (несколько часов) характерен для постоянно рециркулирующих долгоживущих лимфоцитов памяти. Они мигрируют из крови в периферические лимфоидные органы и из них обратно в кровь. Популяция быстро рециркулирующих лимфоцитов содержит главным образом Т-лимфоциты. Большинство медленно мигрирующих клеток относится к В-клеткам. При остром иммунном ответе происходит миграция предшественников эффекторных цитотоксических лимфоцитов и плазмоцитов через кровь и лимфу во все отделы иммунной системы и соединительную ткань, где обеспечиваются условия для иммунного ответа. Число рециркулирующих лимфоцитов в крови человека составляет около 1010. Рециркулирующие лимфоциты представляют собой основную часть популяции малых лимфоцитов, большинство из которых являются долгоживущими Т-лимфоцитами; меньшее число составляют В-лимфоциты. Рециркулирующие лимфоциты имеют оптимальную возможность к встрече с любой чужеродной мишенью, которую они сами непосредственно уничтожают, вырабатывая антитела. Лимфоциты при помощи рецепторов осуществляют «проверку» всех тканей организма, выявляя чужеродный материал. При попадании антигена в периферические лимфоидные органы в зонах его расположения концентрируются Т-лимфоциты. В этих же зонах несколько позднее появляются В-лимфоциты. Происходит взаимодействие макрофагов, Т- и В-лимфоцитов и кооперативное распознавание антигена, приводящее к дифференцировке из В-лимфоцитов — клеток памяти и плазмоцитов, продуцирующих антитела. Лимфоциты памяти живут в течение 20 лет и более. Считают, что приобретенное свойство памяти лимфоцитов наследуется. Таким образом, процессы миграции и рециркуляции клеток иммунной системы обеспечивают поддержание иммунного гомеостаза. 68. К системе органов кроветворения и иммунной защиты относят красный костный мозг, тимус (вилочковая железа), селезенку, лимфатические узлы, а также лимфатические узелки в составе слизистых оболочек (например, пищеварительного тракта - миндалины, лимфатические узелки кишечника, и других органов). Это совокупность органов, поддерживающих гомеостаз системы крови и иммунокомпетентных клеток. Различают центральные и периферические органы кроветворения и иммунной защиты. К центральным органам кроветворения и иммунной защиты у человека относятся красный костный мозг и тимус. В красном костном мозге образуются эритроциты, тромбоциты, гранулоциты и предшественники лимфоцитов. Тимус — центральный орган лимфопоэза. В периферических кроветворных органах (селезенка, лимфатические узлы, гемолимфатические узлы) происходят размножение приносимых сюда из центральных органов Т- и В-лимфоцитов и специализация их под влиянием антигенов в эффекторные клетки, осуществляющие иммунную защиту, и клетки памяти (КП). Кроме того, здесь погибают клетки крови, завершившие свой жизненный цикл. Органы кроветворения функционируют содружественно и обеспечивают поддержание морфологического состава крови и иммунного гомеостаза в организме. Координация и регуляция деятельности всех органов кроветворения осуществляются посредством гуморальных и нервных факторов организма, а также внутриорганных влияний, обусловленных микроокружением. Несмотря на различия в специализации органов гемопоэза, все они имеют сходные структурно-функциональные признаки. В основе большинства их лежит ретикулярная соединительная ткань, которая образует строму органов и выполняет роль специфического микроокружения для развивающихся гемопоэтических клеток и лимфоцитов. В этих органах происходят размножение кроветворных клеток, временное депонирование крови или лимфы. Кроветворные органы благодаря наличию в них специальных фагоцитирующих и иммунокомпетентных клеток осуществляют также защитную функцию и способны очищать кровь или лимфу от инородных частиц, бактерий и остатков погибших клеток. |
