1 Предмет и методы химической термодинамики. Взаимосвязь между процессами обмена веществ и энергии в организме. Химическая термодинамика как теоретическая основа биоэнергетики. Термодинамика
 Скачать 0.58 Mb. Скачать 0.58 Mb.
|
|
Раздел 6. 35) Свойства растворов ВМС. Особенности растворения ВМС как следствие их структуры. 36) Вязкость крови и других биологических жидкостей. Осмотическое давление растворов биополимеров. Уравнение Галлера. Полиэлектролиты. Изоэлектрическая точка и методы ее определения. Мембранное равновесие Доннана. Онкотическое давление плазмы и сыворотки крови. Биополимеры– природные высокомолекулярные соединения (ВМС). Растворы ВМС характеризуются термодинамическими свойствами, это связано с гибкостью цепей макромолекул, большим числом конформаций. В растворах ВМС возможны процессы ассоциации макромолекул. ВМС могут находиться в аморфном и кристаллическом состоянии. Набухание и растворение ВМС. При контакте полимера (ВМС) и растворителя (НМС) происходит набухание и затем растворение полимера. Набуханием называется проникновение растворителя в полимерное вещество, сопровождаемое увеличением объема и массы образца. Количественно набухание измеряется степенью набухания:ат = (m – m0)/m0 ,где m0 — начальная масса; Vo — начальный объем образца полимера; т — масса; V — объем набухшего образца. Степень набухания зависит от жесткости полимерных цепей. У жестких полимеров с большим числом поперечных связей между цепями степень набухания невелика. (Каучуки (резины) ограниченно набухают в бензине .Добавление бензола к на туральному каучуку приводит к неограниченному набуханию полимеров ). Зависимость набухания от факторов: Степень набухания полимера зависит от его природы и природы раство рителя. Полимер набухает лучше в растворителе, молекулярные взаимодействия которого с макромолекулами велики. Полярные полимеры набухают в полярных жидкостях (белок в воде), неполярные — в неполярных (каучук в бензоле). Ограниченное набухание аналогично ограниченной растворимости. В результате образуются студни. Кроме природы растворителя на набухание ВМС влияют присутствие электролитов, рН среды, температура. Степень набухания уменьшается с увеличением жесткости кислот-катионов в ряду: Cs–Rb–K–Na–Li;I–Br–Cl-F. Вязкость (внутреннее трение) — мера сопротивления среды движению. Эту величину характеризуют коэффициентом вязкости η . Ньютон для ламинарного (послойного) течения жидкости установил зависимость: где Р- напряжение, Па; η— коэффициент динамической вяз кости Па.с.dy/dt — скорость относительной деформации. Растворы полимеров не подчиняются закону Ньютона. Для небольших интервалов концентраций существует простая зависимость ηпр.=а + bс где а, в — постоянные коэффициенты. Величина а определяется экспериментально и называется характеристической вязкостью полимера. Характеристическая вязкость связана с молярной массой полимера формулой Штаудингера: где К — коэффициент пропорциональности, а — показатель степени. Формула Штаудингера используется при экспериментальном измерении молекулярной массы ВМС. Осмотическое давление л растворов ВМС определяется теоретически уравнением Вант-Гоффаπ=cRT, где с — концентрация раствора. Каждая макромолекула ведет себя как совокупность нескольких молекул меньшего размера. Это и проявляется в увеличении осмотического давле ния. Для расчета осмотического давления растворов ВМС Галлер предложил уравнение где с— концентрация раствора ВМС, г/л;М — молярная масса ВМС г/моль; β — коэффициент, учитывающий гибкость и форму макромолекулы в растворе. Если звено полимерной цепи содержит ионогенную группу, то полимер называют полиэлектролитом. Они растворимы в полимерных растворителях, электропроводны, и на их свой ствах сильно отражается кулоновское взаимодействие зарядов. К классу синтетических полиэлектролитов, имеющих широкую область применения, относятся полиамфолиты. В сильнощелочных средах (высокие рН) молекулы полиамфолитов приобретают суммарный отрицательный заряд. При некотором промежуточном значении кислотности (3 < рН < < 11 для белков) суммарный заряд макромолекулы становится равным нулю. Это значение называется изоэлектрической точкойполиамфолита. Изоэлектрическая точка может быть измерена однозначно с помощью электрофореза, может быть использованы данные по набуханию полиамфолитов в р-рах с разл.pH. Онкотическое давление– часть осмотического давления крови π(ВМС), создаваемая в ней белками(альбумин, глобулин). Мембранное равновесие Доннана –равенство электрохимических потенциалов частиц в левой и правой частях. 37) Устойчивость растворов биополимеров. Высаливание биополимеров из раствора. Денатурация биополимеров. Коацервация и ее роль в биологических системах. Застудневание растворов ВМС. Свойства студней: синерезис и тиксотропия. Застудневание. В результате ограниченного набухания ВМС или частичного испарения растворителя из раствора ВМС обра зуются студни. Студень можно рассматривать как ограниченно набухший полимер или концентрированный раствор полимера. Высаливание ВМС. Лиотропный ряд ионов, :Cs–Rb–K–Na–Li;I–Br–Cl-F. характеризует влияние ионов на набухание ВМС, имеет обратную последовательность по своему высали вающему действию. Под высаливанием понимают выделение ВМС из раствора при введении ионов или неэлектролитов. Наименьший высаливающий эффект будут проявлять мягкие основания-анионы IиNCS— слабо гидратирующиеся и хо рошо адсорбирующиеся на молекулах ВМС. Снижение устойчивости раствора ВМС наблюдается при уменьшении лиофильности полимера. Коацервация.При нарушении устойчивости раствора ВМС возможно образованиекоацервата — новой жидкой фазы, обо гащенной полимером. Коацерват может находиться в исходном растворе в виде капель или образовать сплошной слой. Коацервация происходит при изменении температуры или состава раствора и обусловлена понижением взаимной раствори мости компонентов раствора. Коацервацию используют при капсулировании лекарств. Студни- это гомогенные системы. При старении гомоген ность студней нарушается вследствиесинерезиса— постепенного сжатия полимерной сетки (матрицы) и выделения жидкой фазы. Синерезис сопровождается уплотнением пространственной струк турной сетки и уменьшением объема студня. Пример синере зиса — отделение сыворотки при свертывании крови. В отличие от гелей студни не обладают тиксотропией— спо собностью восстанавливать свою структуру во времени после ее механического разрушения. В студнях, как и в растворах, могут протекать химические реакции. Скорость диффузии ионов и молекул в студнях зависит от концентрации студня. Раздел 7. 38)Взаимное влияние атомов и способы его передачи в молекулах органических соединений. Поляризация связей и электронные эффекты. Электродонорные и электроакцепторные заместители в неароматических и ароматических соединениях. Сопряжённые и несопряжённые системы. Виды сопряжения. Взаимное влияние атомов в молекулах органических По числу частиц, принимающих участие в элементарной стадии. По этому признаку все реакции подразделяются на диссоциативные(мономолекулярные) и ассоциативные(бимолекулярные, тримолекулярные).Примеры мономолекулярных реакций SN1, E1. Бимолекулярные реакции - SN2, E2. Тримолекулярные реакции встречаются редко. Региоселективность –предпочтительное протекание реакции по одному из нескольких реакционных центров молекулы. Хемоселективность –предпочтительное протекание реакции по одной из родственных функциональных групп. Стереоселективность –предпочтительное образование в реакции одного из нескольких возможных стереоизомеров. Составляющие молекулу атомы испытывают взаимное влияние, передающееся с помощью электронных эффектов. Электронные эффекты характеризуют способность заместителей передавать свое влияние по цепи ковалентно связанных атомов. При этом заместитель также испытывает на себе влияние окружающих фрагментов молекулы. Различают два механизма электронного влияния атомов в молекуле: индуктивное влияние, или индуктивный эффект и мезомерное влияние или мезомерный эффект (эффект сопряжения). Индуктивный эффект (I-эффект) –это передача электронного влияния заместителей по цепи s-связей. Этот эффект наблюдается в случае, когда в молекуле есть более электроотрицательные атомы. Индуктивный эффект передается по цепи s-связей с постепенным затуханием и, как правило, затухает через три-четыре связи. Заместитель (Х), притягивающий электронную плотность s-связи сильнее, чем атом водорода, проявляет отрицательный индуктивный эффект (-I). Такие заместители снижают электронную плотность системы и их называют электроноакцепторными. К ним относятся большинство функциональных групп: галогены, ОН, NH2, NO2, COOH и др. и катионы. Если заместитель (У) смещает электронную плотность s-связи в сторону атома углерода цепи, то он проявляет положительный индуктивный эффект (+I).Такие заместители ведут к повышению электронной плотности в цепи и называются электронодонорными. К ним относятся алкильные группы (СН3, С2Н5), металлы с низкой электроотрицательностью (Li, Mg, Na) и анионы. Мезомерный эффект (М-эффект) –это передача электронного влияния по сопряженной системе. В сопряженных системах основную роль в передаче электронного влияния играют p-электроны делокализованных ковалентных связей. При этом заместитель сам является участником сопряженной системы. В отличие от индуктивного эффекта, мезомерный эффект передается по сопряженной системе без затухания. Заместители, повышающие электронную плотность в сопряженной системе, проявляют положительный мезомерный эффект (+М).К ним относятся заместители, содержащие гетероатом с неподеленной парой электронов или имеющие отрицательный заряд (ОН, галогены, NH2). Эти заместители являются электронодонорными и за счет включения в состав сопряженной системы своей пары электронов создают избыточность электронной плотности в цепи сопряжения. Заместители, понижающие электронную плотность в сопряженной системе, проявляют отрицательный мезомерный эффект (-М)и являются электроноакцепторными. К ним относятся заместители, содержащие кратные связи атома углерода с более электроотрицательным гетероатомом (NO2, COOH, >С=О, SO3H). Реакции присоединения Реакции электрофильного замещения. -алкилирование (в присутствии безводной соли: А1С13, FеС13 и т.д.) -нитрование(в присутствии концентрированной Н2SО4) -сульфирование(условия - Т = 25*С, SО3) -галогенирование(в присутствии безводной соли А1С13, FеС13 и т.д.) 2.реакции окисления. Арены устойчивы к окислению. - в жестких условиях(О2, V2О5, Т = 450*) → малеиновый ангидрид -в обычных условиях окисление боковой цепи (КМпО4, Н2SО4) → бензойная кислота, СО2 и Н2О. - гидрирование (восстановление)(в присутствии металлических катализаторов Ni, Pt, Pd при Т = 300*С) → циклогексан -галогенирование(в отсутствие катализатора, без доступа воздуха, Т = 20*) → гексахлорциклогексан 3.реакция боковой цепи – свободнорадикальное замещение (аналогично алканам) ПРАВИЛА ЗАМЕЩЕНИЯ В ПРОИЗВОДНЫХ БЕНЗОЛА (На1-, R-, NH2-, OH-) (-COH, –COOH, - SO3H, -NO2) способствуют протеканию реакции электрофильного замещения, усложняют протекане реакции электрофильного замещения, вновь вводимый заместитель направляется в орто- и пара-положения вновь вводимый заместитель направляется в мета-положение (образуется два изомерных соединений) (образуется одно соединение) ГАЛОГЕНПРОИЗВОДНЫЕ УГЛЕВОДОРОДЫ – это углеводороды, у которых один или несколько атомов водорода замещены на галогены. ПО ХАРАКТЕРУ РАДИКАЛА ПО ПРИРОДЕ УВ ХАРАКТЕРА ПО ЧИСЛУ АТОМОВ ГАЛОГЕНА фторсодержащие алифатические монозамещенные хлорсодержащие алициклические дизамещенные бромсодержащие ароматические тризамещенные иодсодержащие тетразамещенные и т.д. Различают первичные, вторичные, третичные галогенпроизводные, в зависимости с каким атомом С связан галоген. ИЗОМЕРИЯ: структурная (изомерия углеродной цепи, положение галогена, у непредельных положение - непредельных связей). ХИМИЧЕСКИЕ СВОЙСТВА (очень реакционноспособны, кроме фторсодержащих), характерны реакции нуклеофильного замещения. Сопряженные системы. Виды сопряжения. Важнейшим фактором, определяющим химические свойства молекулы, является распределение в ней электронной плотности. Характер распределения зависит от взаимного влияния атомов. Ранее было показано, что в молекулах, имеющих только ϭ-связи, взаимное влияние атомов в случае их различной Э,О. осуществляется через индуктивный эффект. В молекулах, представляющих собою сопряженные системы, проявляется действие другого эффекта – мезомерного, или эффекта сопряжения. Влияние заместителя, передающееся по сопряженной системе π-связей, называется мезомерным эффектом (М). Прежде, чем говорить о мезомерном эффекте необходимо разобрать вопрос о сопряженных системах. Сопряжение имеется в молекулах многих органических соединений (алкадиены, ароматические углеводороды, карбоновые кислоты, мочевина и др.). Соединения с чередующимся расположением двойных связей, образуют сопряженные системы. Сопряжение – образование единого электронного облака в результате взаимодействия неги негибридизованных рz- орбиталей в молекуле с чередующимися двойными и одинарными связями. Негибридизованные р – орбитали каждого атома углерода расположены перпендикулярно этой плоскости и параллельно друг другу. Это создаёт условия для их взаимного перекрывания. Перекрывание этих орбиталей происходит не только между атомами С-1 и С-2 и С-3 и С-4, но и частично между атомами С-2 и С-3. При перекрывании четырёх рz-орбиталей происходит образование единого π-электронного облака, т.е.сопряжениедвух двойных связей. Этот тип сопряжения называетсяπ, π-сопряжением, т. к взаимодействуют орбитали π-связей. Цепь сопряжения может включать большое число двойных связей. Чем она длиннее, тем больше делокализация π-электронов и тем устойчивее молекула. В сопряженной системе π-электроны уже не принадлежат определённым связям, ониделокализованы т. е равномерно распределены по всей молекуле. Делокализация π-электронов в сопряженной системе сопровождается выделением энергии, которая называетсяэнергией сопряжения.Такие молекулы более устойчивы, чем системы с изолированными двойными связями. Объясняется это тем, что энергия таких молекул ниже. В результате делокализации электронов при образовании сопряженной системы происходит частичное выравнивание длин связей: одинарная становится короче, а двойная – длиннее. Система сопряжения может включать и гетероатомы. Примером π,π-сопряженных систем с гетероатомом в цепи могут служить α и β – ненасыщенные карбонильные соединения. Например, в акролеине (пропен-2-аль) СН2= СН – СН = О. Цепь сопряжения включает три sp2-гибридизованных атома углерода и атом кислорода, каждый из которых вносит в единую π-систему по одному р-электрону. р,π-сопряжение. В р,π-сопряженных системах в образовании сопряжения принимает участие атомы с неподеленной донорной электронной парой. Это могут быть: Cl, O, N,Sи др. К таким соединениям относятся галогениды, эфиры, ацетамиды, карбкатионы. В молекулах этих соединений осуществляется сопряжение двойной связи с р-орбиталью гетероатома. Делокализованная трехцентровая связь образуется путем перекрывания двух р-орбиталейsp2-гибридизованных атома углерода и одной р-орбиталью гетероатома с парой электронов. СН2 = СН – О – СН3 Винилметиловый эфир 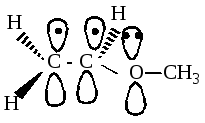 Образование аналогичной связи можно показать в амидной группе, являющейся важным структурным фрагментом пептидов и белков. Амидная группа молекулы ацетамида включает два гетероатома азот и кислород. В р, π-сопряженииучаствуют π-электроны поляризованной двойной связи карбонильной группы и донорная электронная пара атома азота. р, π-сопряжение 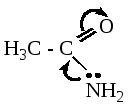 р, π-сопряжение р, π-сопряжение  Сопряжение может возникать и в циклических системах. К ним в первую очередь относятся арены и их производные. Простейшим представителем является бензол. Все атомы углерода в молекуле бензола находятся в sp2-гибридизации. Шесть sp-гибридных облака образуют каркас бензола. Все ϭ-связи (С – С и С – Н) лежат в одной плоскости. Шесть негидридизованных р-орбиталей расположены перпендикулярно плоскости молекулы и параллельно друг другу. Каждая р-орбиталь в равной степени может перекрываться с двумя соседними р-орбиталями. В результате такого перекрывания возникает единая делокализованная π-система, наибольшая электронная плотность в которой находится над и под плоскостью ϭ-скелета и охватывает все атомы углерода цикла. π-электронная плотность равномерно распределена по всей циклической системе. Все связи между атомами углерода имеют одинаковую длину (0,139 нм), промежуточную между длинами одинарной и двойной связей. 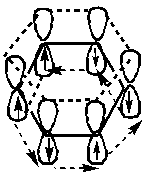  Ароматичность Это понятие, включающее различные свойства ароматических соединений ввёл немецкий физик Э. Хюккель (1931). Условия ароматичности: плоский замкнутый цикл все атомы С находятся в sp2– гибридизации образуется единая сопряженная система всех атомов цикла -электронов, гдеn= 1, 2, 3...выполняется правило Хюккеля: “В сопряжении участвуют 4n+2” Простейший представитель ароматических углеводородов – бензол. Он удовлетворяет всем четырем условиям ароматичности. Правило Хюккеля: 4n+2 = 6,n= 1.
39) Кислотность и основность органических соединений. Теории Бренстеда и Льюиса. Общие закономерности в изменении кислотных и основных свойств во взаимосвязи с природой атома в кислотном и основном центрах, электронными эффектами заместителей при этих центрах и сольватационными эффектами. Кислотность и основность органических соединений. Для оценки кислотности и основности органических соединений наибольшее значение имеют две теории – теория Бренстеда и теория Льюиса. По теории Льюиса кислотные и основ ные свойства соединений определяются их способностью принимать или отдавать пару электронов с образованием связи. В соответствии с принципом ЖМКО кислоты и основания Льюиса делятся на жесткие и мягкие. Кислотами Льюиса могут быть атомы, молекулы или катионы, обладающие вакантной орбиталью и способные принимать пару электронов с образованием ковалентной связи. Кислоты Льюиса – акцепторы пары электронов; основания Льюиса – доноры пары электронов. Основания Льюиса (атом, молекула или анион) должны обладать по крайней мере одной парой валентных электронов, которую они способны предоставить партнеру для образования ковалентной связи. Все основания Льюиса представляют собой нуклеофильные реагенты. По теории Бренстеда (протолитической теории) кислотность и основность соединений связывается с переносом протона Н+. Кислота и основание образуют сопряженную кислотно-основную пару, в которой чем сильнее кислота, тем слабее сопряжен ное ей основание, и напротив, чем сильнее основание, тем слабее сопряженная ему кислота. Кислоты Бренстеда (протонные кислоты) – нейтральные молекулы или ионы, способные отдавать протон (доноры протонов). Основания Бренстеда – нейтральные молекулы или ионы, способные присоединять протон (акцепторы протонов). Кислотность и основность являются не абсолютными, а относительными свойствами соединений: кислотные свойства обнаруживаются лишь в присутствии основания; основные свойства – только в присутствии кислоты. В качестве растворителя при изучении кислотно-основных равновесий обычно используется вода. В зависимости от природы элемента, с которым связан про тон, различают ОН- кислоты (карбоновые кислоты, фенолы, спирты), SH-кислоты (тиолы), NН-кислоты (амины, амиды, имиды), СН-кислоты (углеводороды и их произ водные). Элемент и связанный с ним атом водорода называют кислотным центром. Во всех случаях присутствует сдвиг электронной плотности от атома водорода к более электроотрицательному атому, протону более или менее легко отщепиться. Чем выше электроотрицательность элемента, с которым связан протон, тем больше кислотность соединения (так, карбоновые кислоты являются более сильными кислотами, чем тиолы или амины). Наличие в молекуле электроноакцепторных групп, обладающих отрицательными электронными эффектами, увеличивает положительный заряд на протоне, что приводит к усилению кислотных свойств. Для образования ковалентной связи с протоном основания Бренстеда должны предоставлять либо неподелениую пару электронов, либо электроны p-связи. В соот ветствии с этим основания Бренстеда делятся на п-основания и p-основания. n-основания могут быть нейтральными или отрицательно за ряженными. Как правило, анионы обладают более сильно выра женным основным характером, чем нейтральные вещества. То есть амид-ион NН2– или гидроксид-ион НО– по основности превосходят аммиак NН3 и воду Н2О. В p-основаниях, к которым относятся алкены, алкадиены, арены, центром основности, т.е. местом присоединения протона, являются электроны p-связи. Это очень слабые основания, так как протонируемые электронные пары несвободны. Наличие электронодонорных заместителей увеличивает основность органических соединений. 40)Водородная связь как специфическое проявление кислотно-основных свойств. Водородная связь — это химическая связь атома водорода одной молекулы с более электроотрицательным атомом (кислорода, азота, фтора) другой молекулы, имеющая частично донорно-акцепторный, частично электростатический характер. Любая химическая связь характеризуется энергией ее образования. По энергии водородная связь занимает промежуточное положение между ковалентной химической связью и слабыми ван-дер-ваальсовыми взаимодействиями. Энергия водородной связи находится в пределах 12—30 кДж/моль, в то время как энергия ковалентной связи составляет 200—400 кДж/моль. Рассмотрим несколько наиболее характерных примеров влияния водородных связей на свойства органических соединений. Прежде всего это так называемые прототропные процессы - превращения, связанные с переносом протона. Известно, что енольные структуры (гидроксильная группа находится при углероде с кратной связью =С-ОН) являются неустойчивыми. В то же время b -дикетоны и другие 1,3-дикарбонильные соединения способны существовать в двух формах: кетонной и енольной Образование энергетически менее выгодной енольной формы объясняется как формированием системы сопряженных связей С=С-С=О, что всегда является стабилизирующим фактором, так и тем обстоятельством, что между енольным гидрокси-лом и карбонильным кислородом образуется внутримолекулярная водородная связь. С учетом водородных связей не только объясняют реальность енольной структуры, но и количество этой формы в таутомерной системе. Карбоновые кислоты, как и спирты, могут участвовать в образовании Н-связей как в роли Н-доноров, так и Н-акцепторов. В первом случае кислотность снижается, во втором возрастает. Это ярко проявляется при ионизации двухосновных кислот: первая константа диссоциации (K1) аномально велика, а вторая (K2)аномально мала. Для объяснения наблюдаемых экспериментальных результатов кроме электронных эффектов большая роль придается вкладу Н-связей. В исходной структуре Н-связь сильно активирует карбоксильную группу, выступающую в роли Н-акцептора. В образовавшемся на первой стадии диссоциации моноанионе образуется прочная внутримолекулярная Н-связь, резко снижающая кислотность второго карбоксила. Межмолекулярные связи, возникающие между молекулами карбоновых кислот, настолько прочны, что Уксусная кислота (pKa=4,7) по кислотности на несколько порядков уступая трихлоруксусной (pKa=0,6), но при всех этих обстоятельствах образует более прочный димер. Основность протоноакцептора имеет приоритет перед кислотностью протонодонора. Известно, что геминальные дигидроксипроизводные являются нестабильными соединениями - дегидратируясь легко превращаются в соответствующие альдегиды или кетоны. Роль водородных связей в живой материи определяется не только тем, что без Н-связей нельзя себе представить структуру белков (носителей жизни) или двойную спираль нуклеиновых кислот. Без водородных связей совершенно иными были бы физические и химические свойства самого распространенного вещества на Земле - воды, в которой и зародилась жизнь. Значение водородных связей в формировании надмолекулярных структур Значение водородной связи, которая широко распространена, велико в биологических и химических процессах. Существование Н - связи в воде определяет благоприятные условия для жизни на Земле. Эта связь существенна для структуры белков и многих других веществ, необходимых для всего живого. Возможность образования Н - связи параллельно с обычными валентными связями необходимо всегда учитывать при изучении строения веществ и их реакционной способности. Возникновение Н - связей, которое облегчает перенос протона, имеет существенное значение в кислотно-основном катализе, окислительно-восстановительных и многих подобных и важных в науке и технике процессах. Не случайно так многочисленны в последние годы исследования, посвященные вопросам природы и механизма действия водородной связи. Водородная связь играет важную роль в неорганической и органической химии. Низкая энергия водородной связи, способность легко разрушаться и восстанавливаться при комнатной температуре вместе с ее огромной распространенностью обусловливаетзначение водородной связи в биологических системах. Упорядоченное расположение полипептидных цепей в структуре белка, поперечные связи в структуре целлюлозы и в двойной спирали дезоксирибонуклеиновой кислоты ( ДНК) объясняются наличием водородной связи. Кроме того, доказано образование водородной связи на некоторых стадиях почти всех биохимических процессов. 41)Изомерия биоорганических соединений. Изомерия– явление существования веществ с одинаковым качественным и количественным составом, но различными свойствами(1830 г. Берцелиус). Причина изомерии стала понятной лишь после появления теории химического строения А.М. Бутлерова (1861 г.) –различное строение молекул, обусловленное способностью атома углерода к образованию 4-хковалентных связей, в том числе и с др. атомами углерода. ИЗОМЕРИЯ - существование соединений, одинаковых по химическому составу, но разных по строению и свойствам. Такие соединения называют изомерами. Различают структурную и пространственную изомерию. Изомерия - одна из причин разнообразия и многочисленности органических соединений. В органической химии часто встречаются соединения с одинаковой молекулярной формулой (брутто-формулой), но с разными свойствами. Такие соединения зовутся изомерами (от грецьк. isos - ровный и meros - часть). Они содержат одинаковое количество одинаковых атомов, но эти атомы по-разному соединены друг с другом. То есть изомерия - это явление, при котором одной брутто-формуле отвечает несколько соединений разного строения и свойств. В некоторых случаях отличие строения, следовательно, и свойств, настолько значительная, что изомеры относят к разным классам органических соединений, как, например этиловый спирт С2Н5ОН и диметиловый эфир СНз-О-СНз (брутто-формула С2Н6О). В иных случаях отличие строения настолько незначительно, что ее можно описать только с помощью пространственных моделей. Все типы изомерии органических соединений можно классифицировать таким образом:
Динамическая структурная изомерия. Особым видом структурной Изомерия является таутомерия (равновесная динамическая Изомерия) - существование вещества в двух или более изомерных формах, легко переходящих друг в друга. Так, ацетоуксусный эфир существует в виде равновесной смеси кетонной (XXVIII) и енольной (XXIX) форм: Таутомери́я — явление обратимой изомерии, при которой два или более изомера легко переходят друг в друга. При этом устанавливается таутомерное равновесие, и вещество одновременно содержит молекулы всех изомеров (таутомеров) в определённом соотношении. Чаще всего при таутомеризации происходит перемещение атомов водорода от одного атома в молекуле к другому и обратно в одном и том же соединении. Классическим примером является ацетоуксусный эфир, представлющий собой равновесную смесь этилового эфира ацетоуксусной (I) и оксикротоновой кислот (II). Таутомерия сильно проявляется для целого круга веществ, производных циановодорода. Так уже сама синильная кислота существует в двух таутомерных формах: При комнатной температуре равновесие превращения циановодорода в изоциановодород смещено влево. Показано, что менее стабильный изоциановодород более токсичен. 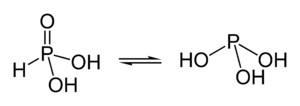 Таутомерные формы фосфористой кислоты Аналогичное превращение известно для циановой кислоты, которая известна в трёх изомерных формах, однако таутомерное равновесие связывает только две из них: циановую и изоциановую кислоты: Для обеих таутомерных форм известны сложные эфиры, то есть продукты замещения в циановой кислоте водорода на углеводородные радикалы. В отличие от указанных таутомеров третий изомер — гремучая (фульминовая) кислота не способна к самопроизвольному превращению в другие формы. С явлением таутомерии связаны многие химико-технологические процессы, особенно в области синтезалекарственных веществ и красителей (производство витамина С — аскорбиновой кислоты в др.). Очень важна роль таутомерии в процессах, протекающих в живых организмах. Кето-енольная таутомерия. Определенная протонная подвижность атома водорода у альфа-атома углерода в монокарбонильных соединениях (слабого СН-кислотного центра) проявляется в их способности к реакциям конденсации. Представим, что по каким-либо причинам подвижность такого атома водорода возросла настолько, что он оказался способным отщепиться в виде протона Н. Это должно привести к образованию мезомерного иона, отрицательный заряд которого рассредоточен между атомами углерода и кислорода. Обратное присоединение протона к этому иону в соответствии с его двумя граничными структурами может приводить либо к исходному карбонильному соединению, либо к енолу. 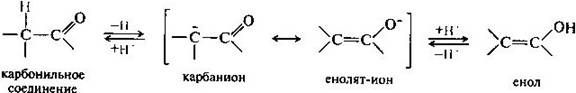 Поэтому, в принципе, карбонильное соединение в кетонной форме может существовать в равновесии с изомером — енольной формой. Такой вид изомерии называют кето-енольнойтаутомерией, а изомеры, находящиеся в состоянии подвижного равновесия, — таутомерами. В рассматриваемом случае между кетонной и енольной формами осуществляется перенос протона, поэтому такое равновесие называется прототропной таутомерией. В монокарбонильных соединениях (альдегидах, кетонах, сложных эфирах) равновесие практически полностью смещено в сторону кетонной формы. Например, содержание енольной формы в ацетоне составляет всего 0,00025%. При наличии второй электроноакцепторной группы у альфа-атома углерода (например, нитрогруппы —>NО2, карбонильной группы =С=О) содержание енольной формы резко возрастает. Так, в 1,3-дикарбонильном соединении ацетилацетоне енольная форма преобладает. 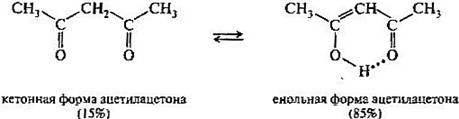 Многие реакции, включающие образование и превращения карбонильных соединен in >vivo, как будет показано в дальнейшем, протекают через промежуточные енольные формы или производные этих форм. Незамещенные по атому азота лактамы являются простейшими соединениями, для которых принципиально возможна лактам-лактимная таутомерия— динамическое равновесие между лактамной и лактимной формами.  Лактим-лактамная таутомерия особенно важна для ароматических гетероциклов с гетероатомами азота — азотистых оснований, входящих в состав нуклеиновых кислот. Взаимопревращение таутомерных форм связано с переносом протона от гидроксильной группы, напоминающей фенольную ОН-группу, к основному центру — пиридиновому атому азота и наоборот. Обычно лактамная форма в равновесии преобладает. Факторы, стабилизирующие таутомерные формы.Таутомерные превращения, при которых таутомеры могут быть выделены в индивидуальном состоянии или обнаружены в смеси аналитическими методами, предложено называть десмотропией. Равновесная смесь таутомеров называется аллелотропной смесью. Те случаи таутомерии (амиды кислот, фенолы, и т. п.), когда вторая форма содержится в смеси в столь ни чтожных количествах, что ее не удается не только выделить, но и. обнаружить аналитическими методами, было предложено называть псевдомерией. Естественно, что о псевдомерии в любом случае можно говорить только предположительно. Вероятно, в большинстве случаев, когда предполагается наличие псевдомерии, в действительности наблюдается двойственная реакционная способность. Превращения таутомеров друг в друга происходят в жидком состоянии или в растворах. Если, например, два индивидуальных таутомера А и В нагреть выше их температур плавления или растворить в каких-либо растворителях, то в результате протекающих обратимых реакций А ------> В и В ------> А как из таутомера А, так и из таутомера В образуется одна и та же равновесная смесь таутомеров: Таутомерное равновесие характеризуется его положением и скоростью установления. И положение таутомерногоравновесия, и скорость его установления весьма различны. Они зависят от строения таутомерного вещества, природы растворителя и температуры. 43)Пространственное строение органических соединений. Понятия- конформация и конфигурация. Пространственная изомерия (стереоизомерия)- Это существование изомеров, имеющих одинаковый состав и порядок соединения атомов, но отличающихся характером расположения атомов или групп атомов в пространстве относительно друг друга. Этот вид изомерии описали Л. Пастер (1848), Я. Вант-Гофф, Ле Бель (1874). В реальных условиях сама молекула и её отдельные части (атомы, группы атомов) находятся в состоянии колебательно - вращательного движения и это движение сильно изменяет взаимное расположение атомов в молекуле. В это время происходит растяжение химических связей и изменение валентных углов и таким образом возникают различные конфигурации и конформации молекул. Поэтому пространственные изомеры делятся на два вида: конформационные и конфигурационные. Конфигурации - это порядок расположения атомов в пространстве без учета различий, которые возникают в результате вращения вокруг одинарных связей. Эти изомеры существуют в виде различных конформаций. Конформации - очень неустойчивые динамические формы одной и той же молекулы, которые возникают в резцльтате вращения атомов или групп атомов вокруг одинарных связей, в результате чего атомы занимают различное пространственное положение. Каждая конформация молекулы характеризуется определённой конфигурацией. б-связь допускает вращение вокруг неё, поэтому одна молекула может иметь множество конформаций. Из множества конформаций во внимание принимают только шесть, т.к. за минимальный угол поворота считают угол равный 60о, который называется торсионным углом. Различают: Заслонённая конформация возникает в том случае, если одинаковые заместители расположены на минимальном расстоянии друг от друга и между ними возникают силы взаимного отталкивания, и молекула должна обладать большим запасом энергии, чтобы сохранить эту конформацию. Эта конформация энергетически невыгодна. Заторможенная конформация - возникает в том случае, если одинаковые заместители максимально удалены друг от друга и молекула обладает минимальным запасом энергии. Эта конформация энергетически выгодна. 44) Стереоизомерия моно- и полиенов, п-Диастереомеры ( цис- и транс- изомеры). Явление структурной изомерии вызвано различным порядком соединения атомов в молекуле. Пространственная изомерия основана на качественно ином принципе. Причина её в различном взаимном расположении атомов в пространстве. Изучению этого посвящён целый раздел органической химии – стереохимия. А также, эта область химии занимается изучением пространственного строения молекул и влияния этого строения на физические и химические свойства вещества (статическая, или конфигурационная стереохимия), на направление и скорость их реакций (динамическая стереохимия). Стереохимия – это "химия в пространстве". Под термином "пространственное строение" подразумевают расположение в пространстве ядер атомов, составляющих молекулу. Пространственное строение органических соединений связано, прежде всего, со стереохимическими особенностями атома углерода, которые зависят, в свою очередь, от его валентного состояния (типа гибридизации). Пространственная изомерия Как мы уже отметили, в трехмерном пространстве возникает явление, которое называется стереоизомерия. Стереоизомеры – это соединения, построенные из одинакового набора атомов с одинаковой последовательностью химических связей, но отличающиеся расположением атомов в трехмерном пространстве – конфигурацией. Под конфигурациями понимают разные пространственные расположения атомов или групп атомов в молекулах, которые не могут быть переведены друг в друга вращением вокруг простых связей. Нужно отличать конфигурации от конформаций (см. пред. раздел), которые могут превращаться друг в друга посредством вращения вокруг простых связей. Различают два вида пространственной изомерии: геометрическая (цис-транс изомерия) и оптическая изомерия. |