Вопросы. вопросы. 8. Виды изомерии органических соединений структурная и пространственная (конформационная, геометрическая и оптическая). Причины, обуславливающие наличие разных видов изомерии. Примеры. Изомерия
 Скачать 279.27 Kb. Скачать 279.27 Kb.
|
|
8. Виды изомерии органических соединений: структурная и пространственная (конформационная, геометрическая и оптическая). Причины, обуславливающие наличие разных видов изомерии. Примеры. Изомерия — это явление существования химических веществ, имеющих одинаковый количественный и качественный состав, но обладающих разными физическими и химическими свойствами. 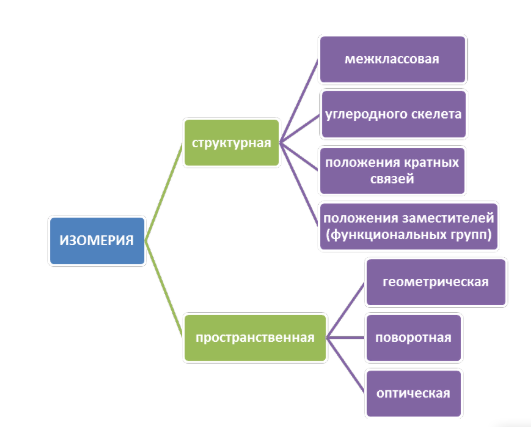 Структурная изомерия Межклассовая изомерия Межклассовыми изомерами являются Алкены и циклоалканы CnH2n Алкины и диены CnH2n-2 Предельные одноатомные спирты и простые эфиры Предельные карбоновые кислоты и сложные эфиры Изомерия углеродного скелета Строение органических веществ изображается в виде структурных формул, отражающих порядок соединения всех атомов в молекуле. Углеродный скелет молекулы отражает связи только между атомами углерода. Это помогает быстрее представить себе конфигурацию молекулы и определить первичные, вторичные, третичные и четвертичные атомы Например: Изомерия положения функциональных групп: Отражает место положения функциональной группы(заместителя) в молекуле, например пропанол-1 и пропанол-2 Изомерия положения кратных связей Отражает место расположения кратной связи в углеродной цепи. Например: бутен-2, бутен-1 Пространственная изомерия Пространственная изомерия (стереоизомерия) — вид изомерии, при котором молекулы веществ, обладающие одинаковым составом и одинаковым химическим строением, отличаются различным расположением заместителей в пространстве. Геометрическая изомерия Геометрическая, или цис-транс-изомерия отражает различное положение заместителей относительно двойной связи или цикла. Если заместители находятся по одну сторону двойной связи или цикла, то это цисизомер, а если по разные стороны, то это трансизомер. Геометрические изомеры отличаются своими физическими и химическими свойствами. Примеры изомеров относительно двойной связи: цис-бутен-2 и транс-бутен-2: 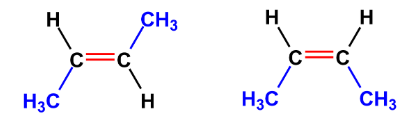 Транс-бутен-2 цис-бутен-2 Оптическая изомерия Оптические изомеры отличаются друг от друга порядком расположения четырех разных заместителей вокруг асимметричного центра. Этот порядок расположения называется конфигурацией. Оптическая изомерия возникает, когда хотя бы один атом углерода имеет четыре разных заместителя. Такой атом углерода называется асимметрическим (хиральным) центром. При наличии такого атома молекула становится асимметричной и может существовать в виде двух изомеров, которые относятся друг к другу как симметричный предмет к своему зеркальному отражению (например, правая и левая рука). Такие изомеры называют оптическими антиподами. Антиподы (зеркальные изомеры, энантиомеры) имеют противоположные конфигурации. Расстояния между различными заместителями и функциями в антиподах одинаковы, поэтому они обладают совершенно одинаковыми физическими и химическими свойствами. Они отличаются лишь по отношению к плоскополяризованному свету: один изомер плоскость поляризации вращает влево, другой — вправо. Явление оптической изомерии обнаруживают с помощью специального оптического прибора — поляриметра.(L И D ИЗОМЕРЫ) Поворотная изомерия (конформация) При переходе от простейшего органического углеводорода — метана к его ближайшему гомологу — этану возникает проблема пространственного строения, для решения которой недостаточно знать общие параметры (валентный угол, длину связи). Возникает вероятность образования множества геометрических форм молекулы этана, отличающихся друг от друга взаимным поворотом углеродных тетраэдров вокруг соединяющей их связи С–С. В результате такого вращения образуются поворотные изомеры (конформеры). Конформации — это различающиеся по внутренней энергии состояния молекулы, которые возникают при свободном вращении вокруг одинарной связи. Конформеры — это стереоизомерные структуры, находящиеся в подвижном равновесии и способные к взаимопревращению путем вращения вокруг простых связей. Энергия различных конформеров неодинакова, но энергетический барьер, разделяющий различные поворотные изомеры, для большинства органических соединений невелик. Поэтому при обычных условиях в равновесии сосуществуют несколько легко переходящих друг в друга поворотных форм. Для молекулы этана существуют две максимально различающиеся по энергии конформации — заслоненная и заторможенная. Для графического изображения конформаций используют перспективные проекции. Чаще всего они изображаются в виде формул Ньюмена. 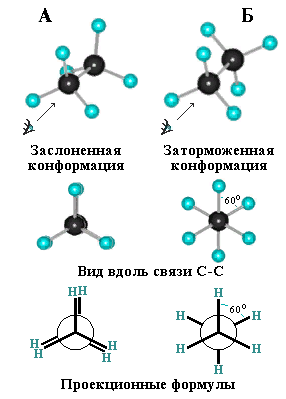 В проекции Ньюмена молекулу рассматривают вдоль связи С–С, если смотреть с торца молекулы (на рисунке стрелкой показано направление взгляда). Три линии, расходящиеся под углом $120^0$ из центра круга, обозначают связи ближайшего к наблюдателю углеродного атома (обозначен черной сферой); линии, «выглядывающие» из-за круга, — связи удаленного углеродного атома. Изображенную слева конформацию называют «заслоненной», так как атомы водорода обеих $СН_3$-групп находятся на одной линии. Конформацию, изображенную справа, называют «заторможенной», подразумевая, что свободное вращение вокруг связи С–С «тормозится» в этом положении, поскольку такое взаимное расположение атомов (групп) более энергетически выгодно, и молекула существует преимущественно в этой конформации. 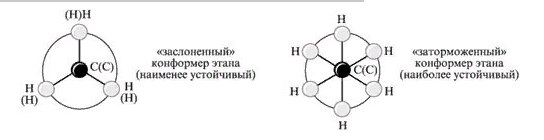 9.Классификация органических реакций. По направлению, по характеру реагирующих частиц или по типу разрыва связей. Примеры радикальных, нуклеофильных и электрофильных реагентов реакций. По направлению (по типу превращения) Замещение (S) - реакция, в ходе которой атом водорода или функциональная группа в органической молекуле замещается на другую группу. Исходные соединения в органических реакциях называют реагентами, а образующиеся соединения — продуктами. Для удобства один из реагентов принято называть субстратом, а другой — атакующим реагентом. Как правило, субстрат имеет более сложное строение, атакующий реагент часто имеет неорганическую природу. Символами над стрелкой кратко обозначают условия, требуемые для проведения реакции. 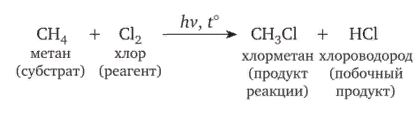 Присоединение (символ А от английского «addition» — присоединение) — реакция, в ходе которой реагент присоединяется по кратной связи (С=С, С=С, С=0) молекулы субстрата 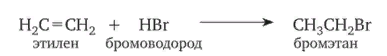 Элиминирование (символ Е от английского «elimination» — элиминирование, отщепление) — реакция, в ходе которой от субстрата отщепляется молекула или частица (вода, гало- генводород и т.д. 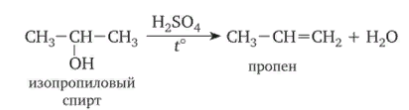 Элиминирование — основной путь образования кратных связей в органических молекулах. По характеру разрыва связи в исходной молекуле По характеру разрыва связи в исходной молекуле (субстрате) органические реакции бывают гомолитические (радикальные) и гетеролитические (ионные). Радикальные реакции характеризуются гомолитическим разрывом ковалентных связей в исходной молекуле и образованием радикалов — нейтральных частиц, содержащих неспаренные электроны. Такой разрыв характерен для неполярных или малополярных ковалентных связей. Активируют такие процессы облучение (/iv), повышенная температура (t°) или давление (р). Углеводородные радикалы являются нейтральными частицами. 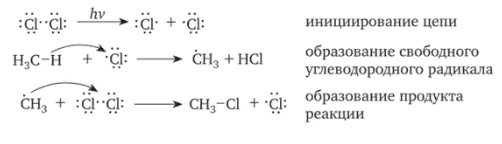 Представленная выше реакция является реакцией замещения по типу превращения (направлению) и радикальной по характеру разрыва связи в исходной молекуле — реакцией радикального замещения (символическое обозначение SR) Ионные реакции характеризуются гетеролитическим (ионным) разрывом ковалентной связи в субстрате. При этом связывающая электронная пара остаётся у одного из участников связи (обычно у более электроотрицательного атома) 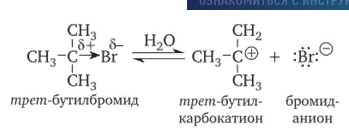 Гетеролитический разрыв связи характерен для полярных и легко поляризуемых связей. Ему способствуют полярные растворители. Заряженную частицу, имеющую вакантную р-орбиталь на атоме углерода, называют карбокатионом. Если в результате гетеролитического разрыва связи электронная пара останется у атома углерода, то заряженную частицу, содержащую неподелённую электронную пару на атоме углерода, называют карбанионом 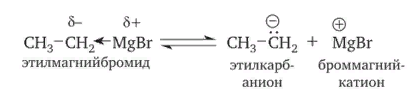 В ионных реакциях реагенты в зависимости от способности предоставлять или принимать электронную пару с последующим образованием ковалентной связи классифицируют на нуклеофильные и электрофильные. Реагенты, способные предоставлять пару электронов на образование связи с углеродом субстрата называются нуклеофильными или нуклеофилами. Реагенты, имеющие вакантную орбиталь и образующие связь с углеродом за счет электронов углерода субстрата, называются электрофильными или электрофилами. Нуклеофильными реагентами (символическое обозначение Nu) могут быть 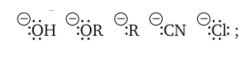 — отрицательно заряженные ионы (ионные нуклеофилы) — нейтральные молекулы, содержащие атомы с неподеленными парами электронов — молекулы, содержащие я-электроны: алкены, ароматические углеводороды. Электрофильными реагентами (символическое обозначение Е) могут быть: — положительно заряженные ионы 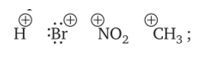 — положительно заряженные атомы нейтральной молекулы 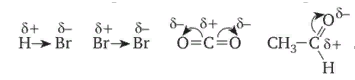 10. Источники получения лекарственных веществ. Классификация лекарственных веществ. К источникам получения лекарственных веществ можно отнести: Минеральные вещества, животное сырье, растительное сырье, продукты жизнидеятельности микроорганизмов и грибов, синтетические соединения. Минеральные источники – это очищенные различные химические соединения: железа, меди, йода, марганца, висмута, кобальта, натрия и.т.д Животного происхождения - это препараты получаемые из органов и тканей животных: адреналин, инсулин, гормонопрепараты надпочечников, гипофиза, ферментные препараты, яды змей, пауков, пчел (антибиотики животного происхождения). Растительные лекарственные вещества Источниками лекарственных веществ могут быть плоды, цветы, листья, кора, корни, корневища различных растений. По химической структуре это различные соединения: Алкалоиды (alcalos - щелочь). Это азотистые щелочеподобные вещества, которые могут содержать кислород и быть безкислододными - кофеин, никотин, атропин, стрихнин и др. Гликозиды - сложные эфироподобные вещества в состав которых входит несахаристая часть - агликон и сахаристая - гликон. Такие препараты получают из различных видов наперстянки, ландыша, черногорки, строфанта и др. Смолы - соединения нерастворимые в воде (растворимы в органических растворителях). Со щелочами образуют мыльноподобные соединения - сабур. Камеди - это слизи и слизеподобные вещества содержащие углеводы. При гидролизе дают сахара. В воде слизи действуют обволакивающе. Жирные масла - касторовое, подсолнечное, льняное и др. Эфирные масла - летучие ароматические соединения: укропные, тминные, горчичные, гвоздичные, мятные и т.д. (отхаркивающие, рвотные). Танины - безазотистые соединения, обладающие местным действием (кора дуба, черника, шалфей). Фитонциды - антибиотики растительного происхождения (лук, чеснок, черемша, черемуха, крапива и др.) Продуцентами многих лекарственных веществ являются микроорганизмы: антибиотики, ферментные препараты и др. Препараты грибкового происхождения также имеют широкое распространение - антибиотики. Синтетические лекарственные вещества - это препараты которые получают в лабораторных условиях путем химических реакций: ФОС, ХОС, карбаматы, антибиотики, сульфаниламиды, гормональные, ферментные и т.д. Классификация лекарственных веществ Классификация лекарственных веществ - один из основополагающих методологических принципов, обеспечивающих наиболее обоснованное деление их на группы по важнейшим показателям действия на здоровый и больной организм, а также научную, логическую обоснованность последовательности изучения отдельных групп лекарственных веществ. В историческом плане развития фармакологии классификация лекарственных веществ претерпела серьезные изменения. Изменения в классификации происходили одновременно и параллельно с изменениями арсенала лекарственных веществ и глубиной познания их фармакокинетики, фармакодинамики, механизма действия и фармакотерапевтической эффективности. В далеком прошлом лекарственные вещества излагались в алфавитном порядке. Данная упорядоченность изложения лекарственных веществ была одной из примитивных форм классификации. В допавловский период фармакологию как науку считали одной из разновидностей или веточкой неорганической и органической химии, поэтому и классификация лекарственных веществ была преимущественно химической. При такой классификации в группе производных любого неорганического и органического соединения можно было встретить фармакологические вещества с противоположной фармакодинамикой. Например, в группе производных метана находились хлороформ (наркотик), четыреххлористый углерод (антигельминтик), йодоформ (антимикробное вещество). Химическая классификация имеет место и в настоящее время, но применяется она преимущественно в фармацевтической химии, что помогает химикам осуществлять синтез лекарственных веществ по образу и подобию природных соединений или создавать новые с включением в молекулы природных соединений новых функциональных биохимических радикалов и групп с целью повышения фармакологической активности или отсечения активных функциональных радикалов и групп в целях снижения токсичности. Современному уровню развития фармакологии как биологической науки познания объективных закономерностей взаимодействия лекарственных веществ со здоровым и больным организмом должна соответствовать и научно обоснованная классификация. Наиболее научно обоснованными являются три классификации: В основе фармакодинамической классификации лекарственных веществ лежит главный, ведущий фармакодинамический профиль, который объединяет все фармакологические вещества, обеспечивающие ведущий фармакодинамический комплекс эффектов и обладающие определенной, но разной структурой. Например, можно выделить большой раздел фармакологических веществ под названием «нейротропные вещества». Основным фармакодинамическим эффектом, объединяющим многочисленные группы и подгруппы этих фармакологических веществ, является нейротропность, т. е. изменение функционального состояния нервной системы на всех уровнях. Это избирательное действие, откуда и проистекают все другие эффекты. Это не значит, что другие фармакологические вещества не изменяют функционального состояния нервной системы на соответствующих уровнях, но у других групп этот эффект не ведущий, не главный, а второстепенный и часто побочный. К числу нейротропных относятся две большие группы фармакологических веществ с разнонаправленным действием: усиливающие и угнетающие разные морфофункциональные образования нервной системы. Здесь также четко определяется два диаметрально противоположных фармакодинамических эффекта: усиление и угнетение нервных процессов в ЦНС. При более детальной классификации, например, фармакологических веществ, угнетающих центральную нервную систему, и по силе убывания этого эффекта выделяются группы: наркотические, снотворные, нейролептические, транквилизаторы и седативные. Дальше идут вещества, угнетающие отдельные центры. В основе фармакотерапевтической классификации лежат симптом, синдром, болезнь, группа болезней, а также этиологические биологические факторы - вирусы, микроорганизмы, простейшие, гельминты, накожные паразиты, т. е. группирование лекарственных веществ по специфичности и широте патологии, при которой с наибольшим терапевтическим эффектом применяется определенная группа лекарственных веществ. Фармакотерапевтическая классификация лекарственных веществ в основном применима в клинических дисциплинах с учетом симптомокомплекса болезни, этиологии и преимущественной локализации патологии, например лекарственные вещества, применяемые при болезнях пищеварительной, дыхательной, мочевой и других систем. Однако обоснованно применять лекарственные вещества для лечения больных животных с преимущественной локализацией патологии в определенном органе или системе можно только тогда, когда есть обстоятельные знания по патогенезу болезни и фармакодинамике лекарственного вещества. Поэтому в терапевтической практике сочетаются фармакотерапевтическая и фармакодинамическая классификации. Фармакотерапевтическая и фармакодинамическая классификации не являются абсолютными, поскольку тонизирующие, седативные, стимулирующие и угнетающие эффекты, свойственные отдельным фармакодинамическим и фармакотерапевтическим группам лекарственных веществ с разной степенью выраженности, могут регистрироваться в ряде групп, однако при сохранении того или иного эффекта у преимущественных групп фармакологических веществ. Противомикробная классификация включает вещества, преимущественно применяемые для уничтожения микроорганизмов, находящихся на поверхности кожи, инструментах, перевязочном материале и др., а также вне организма животного (в животноводческих помещениях, земле, навозе, кормах, на оборудовании). Для практикующих врачей удобна классификация, разработанная по нозологическому принципу: · средства для лечения тромбозов; · антигипотензивные средства и т.д. Наиболее широко применяется классификация по системному принципу, предложенная академиком М.Д. Машковским. По этой классификации в модификации В.Д. Соколова, Н.Л. Андреевой и др. все лекарственные средства подразделяют на 5 групп: - нейротропные; - регулирующие функции исполнительных органов и систем; - влияющие на процессы тканевого обмена; - корректирующие стрессы, продуктивность и иммунный статус; - противомикробные, антивирусные и противопаразитарные. Для удобства применения лекарственным средствам придается определенная лекарственная форма. По агрегатному состоянию различают 4 группы лекарственных форм: твердые, мягкие, жидкие и газообразные. С учетом силы действия лекарственных средств и их токсичности принято различать яды, сильнодействующие и малоядовитые препараты. 11. Неорганические лекарственные вещества. Соединения галогенов, кислорода, серы, азота, бора, магния, кальция, бария, цинка, ртути, меди, серебра, железа. Препараты галогенов. Гипохлориты — препараты солей хлорноватистой кислоты, получают при взаимодействии хлора с гидроксидами щелочных металлов: 2NаОН + Сl2 = NaClO + NаС1 + Н2O. Промышленный способ получения основан на электролизе хлоридов натрия или калия. Испытания на подлинность, количественное определение и применение основаны на окислительных свойствах этих веществ. Основные лекарственные средства: известь хлорная (дезин-фектант, антисептик, дезодорант), натрия гипохлорит, кальция ги-похлорит. Препараты йода получают из буровых вод и морских водорослей. В ГФ включен йод и раствор йода 5% -ный спиртовой. Йод летуч при обычной температуре, при нагревании возгоняется, образуя фиолетовые пары. Температура плавления 113-114°С, мало растворим в воде, растворим в органических растворителях. Подлинность йода и его лекарственных форм устанавливают реакцией взаимодействия йода и крахмального клейстера с образованием продукта синего цвета. Количественно йод определяют титрованием тиосульфатом натрия в присутствии индикатора крахмала: I2 + 2Na2S2O3 = 2NaI + Na2S4O6 Спиртовой раствор йода (5%) — одно из основных антисептических средств. На основе йода получены другие антисептики. Йодопирон — смесь комплекса поливинилпирролидона с йодидом калия. Содержит 6-8% йода. Используют в форме 0,1, 0,5 и 1% растворов. Йодонат сходен с йодопироном по составу и действию — водный раствор поверхностно-активных веществ, содержащий около 3% йода. Препараты галогенидов. В эту группу входят препараты бескислородных соединений галогенов: кислота хлористоводородная (соляная), натрия хлорид, калия хлорид, натрия бромид, калия бромид, натрия йодит и калия йодит (по терминологии ГФ XI). Кислота хлористоводородная (соляная) — продукт производства химической промышленности. Получают растворением в воде хлороводорода. В ГФ включены два препарата соляной кислоты: кислота хлористоводородная (плотность 1,222-1,224; объемная доля 24,8-25,2%) и кислота хлористоводородная разведенная (плотность 1,038-1,039; объемная доля 8,2-8,4%). Хлорид-ион можно обнаружить с помощью нитрата серебра или при нагревании с диоксидом марганца. Определяют содержание хлороводорода в препаратах методом нейтрализации, титруя раствором гидроксида натрия в присутствии индикатора метилового оранжевого, а также аргентометрическим методом по хлорид-иону. В терапевтических целях используют разведенную соляную кислоту при патологиях желудочно-кишечного тракта. Препараты хлоридов, бромидов, йодидов имеют много общего по физическим свойствам. Натрия хлорид получают из воды озер и морей выпариванием, источники калия хлорида — минералы сильвинит или карналлит, из которых выделяют препарат методом флотации с последующей очисткой. Бромиды получают различными способами, в том числе из бромида железа, являющегося отходом химических производств. Аналогично получают натрия и калия йод иды из йодида железа. По физическим свойствам галогениды представляют собой белые или бесцветные кристаллические вещества без запаха, соленого вкуса, легко (особенно йодиды) растворяющиеся в воде. Йодиды легко растворяются в этаноле и глицерине, хлориды и бромиды менее растворимы в этих растворителях. Испытания на подлинность галогенидов основаны на реакциях с соответствующими катионами и анионами (ГФ XI, вып. 1, с. 159). Катион натрия обнаруживают по окрашиванию бесцветного пламени горелки в желтый цвет и образованию зеленовато-желтого кристаллического осадка с цинкуранилацетатом в уксуснокислой среде. Соли калия окрашивают бесцветное пламя горелки в фиолетовый цвет; катион калия можно также обнаружить реакцией с винной кислотой по образованию белого кристаллического осадка. Галогенид-ионы также обнаруживают осадочной реакцией с раствором нитрата серебра в азотнокислой среде. При этом образуются труднорастворимые соли галогенидов серебра, которые отличаются по окраске и растворимости в растворе аммиака. Бромиды и йодиды также обнаруживают с помощью реакций окисления до свободных галогенов, используя различные окислители. Существуют и другие качественные реакции. При испытании на чистоту следует контролировать допустимые пределы примесей бромат-, йодат-, цианид-, тиосульфат-, сульфит- и нитрат-ионов. Примесь броматов обнаруживают добавлением серной кислоты (желтое окрашивание). Аналогично устанавливают примесь йодатов. Примесь тиосульфат- и сульфит-ионов обнаруживают реакцией с раствором йода (в присутствии крахмала — синее окрашивание). Нитрат-ионы регистрируют по реакции образования аммиака с цинковыми или железными опилками в щелочной среде (аммиак окрашивает влажную красную лакмусовую бумагу в синий цвет). Количественное определение препаратов галогенидов по ГФ выполняют аргентометрическим методом, титруя в нейтральной среде (индикатор хромат калия) хлориды и бромиды. Йодиды определяют методом фаянса в уксуснокислой среде, используя титрант 0,1 М раствор нитрата серебра и адсорбционный индикатор эозинат натрия. Галогениды широко используют в лечебной практике. Натрия хлорид — основная часть солевых и коллоидно-солевых растворов, применяемых в качестве плазмозамещающих жидкостей; препарат применяют наружно и внутривенно при различных патологиях. Калия хлорид — антиаритмическое средство и источник ионов калия (при гипокалиемии). Он также входит в состав плазмозамещающих Жидкостей. Натрия и калия бромиды назначают в качестве седативных средств. Йодиды применяют при недостатке йода в организме (эндемическом зобе) и некоторых воспалительных патологиях. Препараты кислорода, водорода и серы. Кислород. В промышленности его получают путем фракционного разделения предварительно сжиженного воздуха и электролизом воды. Как лекарственное средство кислород включен в ГФ. Представляет собой газ. Перед использованием с лечебной целью его подвергают очистке, пропуская через раствор щелочи, а затем через воду. Для отличия кислорода от других газов, например азота закиси, его смешивают с оксидом азота. Смесь газов окрашивается в оранжево-красный цвет (азота закись окраски не дает). Все способы количественного определения кислорода основаны на взаимодействии с легко окисляющимися веществами. ГФ рекомендует для этого медь (ГФ XI, с. 350), которая, окисляясь кислородом, образует оксид меди, реагирующий с содержащимися в растворе хлоридом аммония и аммиаком. В аптеках кислород хранят в баллонах объемом 27-50 л, вмещающих 4-7,5 м3 газа под давлением 10-15 Па (100-50 тм). Баллоны, содержащие кислород, окрашены в синий цвет. Резьбу редуктора баллона нельзя смазывать жиром или органическими маслами (возможна вспышка от взаимодействия струи кислорода с органическим веществом). Смазкой служит тальк. Из аптек кислород отпускают в специальных подушках. Применяют для вдыхания при болезнях, сопровождающихся кислородной недостаточностью, однако используют в виде карбогена — смесь 95% кислорода и 5% диоксида углерода. Вода. В фармацевтической практике используют: воду очищенную, воду для инъекций и воду для инъекций в ампулах (рН 5,0-7,0). Воду очищенную получают дистилляцией, ионным обменом, обратным осмосом и другими способами. Ее испытывают на чистоту в соответствии с требованиями ФС; рН определяют потенциометрическим методом. Сухой остаток не должен превышать 0,001%. Его устанавливают выпариванием досуха 100 мл воды. Затем высушивают при 100-150°С до постоянной массы, взвешивают и рассчитывают его массовую долю (%). Испытание на восстанавливающие вещества выполняют путем кипячения в течение 10 мин смеси, состоящей из 100 мл воды, 2 мл разведенной серной кислоты и 1 мл 0,01 М свежеприготовленного раствора перманганата калия. Должно сохраняться розовое окрашивание. Содержание нитратов и нитритов регистрируют по отрицательной реакции с 1 мл дифениламина в концентрированной серной кислоте (не должно появляться голубое окрашивание). При проведении испытания к 5 мл воды осторожно прибавляют указанный объем реактива. Испытания на хлориды, сульфаты, соли кальция и тяжелые металлы проводят в соответствии с требованиями ГФ XI (вып. 1, с. 165) «Испытания на чистоту и допустимые пределы примесей». Воду очищенную применяют для приготовления неинъекционных лекарственных средств. Используют свежеприготовленной или хранят в закрытых емкостях, не изменяющих свойств воды и защищающих от микробного загрязнения. Согласно инструкции МЗ СССР № 96 от 03.04.1991 г. вода очищенная, простерилизованная в течение 8 мин при 120°С, имеет срок годности 30 сут. при 25°С. Вода для инъекций должна выдержать испытания для воды очищенной и быть апирогенной, не содержать антимикробных веществ и других добавок. Ее подвергают испытанию на пирогенность (ГФ XI, вып. 2, с. 183) и механические включения (инструкция И 42-3-85). Срок хранения не более 24 ч. Воду для инъекций выпускают в емкостях (ампулах) из нейтрального стекла по 1, 2, 3, 5, 10, 20 мл, которые стерилизуют при 120°С 20 мин. НТД предъявляют самые высокие требования к ее качеству. Она не должна давать положительных реакций на хлориды, сульфаты, кальций, тяжелые металлы. Требования к рН среды, содержанию сухого остатка, восстанавливающих веществ, диоксида углерода, нитратов и нитритов, аммиака такие же, как для воды очищенной. Испытания на пирогенность и механические включения выполняют по аналогии с водой для инъекций. Кроме того, устанавливают стерильность и соблюдают другие требования к ампулированным инъекционным растворам (ГФ XI, вып. 2, с. 140). Используют для тех же целей, что и воду для инъекций. Срок годности 4 года. В ряде случаев, в том числе и при получении воды очищенной, определяют не каждую из органических примесей, а используют унифицированный показатель чистоты в отношении органических растворителей, названный «общий органический углерод». Для этого применяют специальные анализаторы углерода, принцип работы которых основан на высокотемпературном каталитическом окислении пробы до диоксида углерода и последующем его восстановлении до метана, количество которого измеряют на пламенно-ионизационном детекторе (используют в Японии). Препараты пероксида водорода. Различают жидкие (3% -ный раствор) и твердые (магния пероксид, гидроперит) препараты пероксида водорода. В ГФ включены: раствор водорода пероксида и магния пероксид, применяют и гидроперит. Магния пероксид выделяет пероксид водорода при растворении в растворах минеральных кислот: МgO2 + 2НС1 = МgСl2 + Н202; гидроперит образует водорода пероксид в воде. Производство водорода пероксида осуществляют электролизом 40-68% растворов серной кислоты при 5-8°С. Таким образом получают разбавленные растворы препарата, которые при перегонке в вакууме при 70°С доводят до концентрации 30-60%. Мировое промышленное производство (до 80%) водорода пероксида осуществляют путем автоокисления воздухом производных алкилантрагидрохи-нонов — 2-этил-, 2-третбутил- и 2-пентилантрагидрохинонов. Магния пероксид получают при взаимодействии оксида магния с водорода пероксидом, а гидроперит — при взаимодействии эквимолекулярных количеств мочевины и водорода пероксида с добавлением 0,08%-ного раствора лимонной кислоты (консервант). Водорода пероксид — очень слабая кислота, проявляющая как окислительные, так и восстановительные свойства. Устойчива в чистом виде в водных растворах, однако присутствие солей тяжелых металлов, диоксида марганца, следов щелочей, окислителей и восстановителей, даже попадание пылинок и соприкосновение с шероховатой поверхностью резко ускоряют процесс ее разложения и, если растворы имеют высокую концентрацию, может произойти взрыв. Для установления подлинности препаратов водорода пероксида используют реакцию образования окрашенных в синий цвет перекисных соединений (смеси надхромовых кислот и пероксида хрома), растворимых в эфире. Количественную оценку твердых и жидких препаратов проводят, используя либо восстановительные, либо окислительные свойства водорода пероксида. Количественное определение водорода пероксида выполняют пер-манганатометрическим методом в кислой среде или йодометрическим методом. Препарат должен содержать 2,7-3,3% водорода пероксида. Для количественного определения магния пероксида проводят пер-мангаяатометрическое титрование. Препарат должен содержать 25% магния пероксида. Содержание водорода пероксида в таблетках гидроперита устанавливают йодометрическим титрованием. Таблетка массой 1,5 г должна содержать не менее 0,48 г водорода пероксида. Хранят препараты водорода пероксида в хорошо укупоренной таре в защищенном от света месте. Раствор водорода пероксида и гидроперит используют как антисептики, а магния пероксид — при желудочно-кишечных заболеваниях. Натрия тиосульфат. Источник получения натрия тиосульфата — сульфиды и полусульфиды, которые подвергают окислению диоксидом серы или кислородом. Получают и путем сплавления его кальциевой соли с сульфатом натрия. Фармакопейный натрия тиосульфат представляет собой кристаллогидрат. Он очень легко растворим в воде, практически нерастворим в этаноле. Препарат дает характерные реакции на натрий-ион, его обнаруживают по образованию опалесценции (вследствие выделения серы) и появлению запаха (диоксида серы) при добавлении к раствору препарата соляной кислоты. Для испытания подлинности и количественного определения используют окислительно-восстановительную реакцию натрия тиосульфата с йодом. Поскольку препарат назначают, в том числе внутривенно, в высоких дозах, его тщательно проверяют на чистоту. В соответствии с требованиями ГФ и ФС устанавливают прозрачность и цветность 30% -ного раствора, щелочность 10%-ного раствора, допустимое количество примесей хлоридов, сульфидов, сульфитов и сульфатов, кальция, тяжелых металлов, железа, мышьяка и селена. Хранят в хорошо укупоренной таре, учитывая, что в сухом тяжелом воздухе он выветривается, а во влажном слегка расплывается, при 50°С плавится в кристаллизационной воде. Препарат используют как противотоксическое (антидотное) и десенсибилизирующее средство при отравлениях цианидами, ртутью, мышьяком, таллием, свинцом и при аллергических состояниях. Сера. Встречается в свободном состоянии (самородная сера) и в виде минералов, содержащих помимо серы и другие элементы. В лечебной практике применяют серу очищенную и серу осажденную. Серу очищенную получают из серного цвета (самородная руда) путем тщательной очистки от примесей, особенно от токсичных — сульфида мышьяка, сернистой и серной кислот. Серу осажденную получают путем тщательного размалывания очищенной серы или кипячением в присутствии гидроксидов. Сера очищенная нерастворима в воде, мало растворима в эфире, а сера осажденная нерастворима в воде, растворима в жирных маслах (при нагревании на водяной бане) и при кипячении в смеси с раствором гидроксида натрия и этанола. Установить подлинность серы можно по запаху оксида серы, образующегося при горении, и характерной (синей) окраски пламени. Раствор серы в горячем пиридине от добавления нескольких капель раствора гидрокарбоната натрия после кипячения окрашивается в голубой или зеленый цвет. Препарат подвергают испытанию на наличие мышьяка, селена, сульфидов и др. Количественное определение серы основано на растворении навески в избытке 0,5 М спиртового раствора гидроксида калия (образуется полисульфид калия). При добавлении пергидроля последний окисляется до сульфата, который затем титруется 0,5 М раствором соляной кислоты. Хранят в хорошо укупоренной таре в сухом месте. Используют наружно в виде мазей, присыпок при лечении различных кожных заболеваний. Действие серы основано на взаимодействии с органическими веществами. Образующиеся при этом сульфиды и пентатиновая кислота проявляют противомикробную и противопаразитарную активность. Внутрь назначают в качестве противоглистного средства при энтеробиозе и как легкое слабительное. Препараты натрия и висмута. Натрия нитрит. Промышленный способ получения натрия нитрита основан на использовании отходов азотной кислоты, а также на восстановлении расплавленного нитрата натрия свинцом. Препарат легко растворим в воде, трудно — в этаноле. Водные растворы слабощелочной реакции (рН 9,0) проявляют как окислительные, так и восстановительные свойства. Препарат дает положительные реакции на натрий-ион, для этого используют дифениламин в кислой среде. От действия разведенной серной кислоты растворы препарата разлагаются с выделением красно-бурых паров диоксида азота. Количественное определение основано на восстановительных свойствах препарата при взаимодействии с избытком титрованного раствора перманганата калия в кислой среде. Препарат гигроскопичен, легко окисляется на воздухе, поэтому требует соответствующих условий хранения. Назначают внутрь, подкожно, внутривенно как коронарорасши-ряющее средство при стенокардии. Препараты соединений висмута. Висмута нитрат основной получают окислением свободного от примесей металлического висмута концентрированной азотной кислотой. Фармакопейный препарат практически нерастворим в воде и этаноле, окрашивает синюю лакмусовую бумагу в красный цвет вследствие гидролиза с образованием азотной кислоты и гидроксида висмута. Растворим в кислотах (азотной, соляной). Подлинность препарата устанавливают прокаливанием, которое приводит к разложению с образованием желто-бурых паров (диоксида азота) и желтого остатка (оксида висмута). Количественное определение выполняют комплексонометрическим методом в нагретой азотной кислоте, титруя 0,05 М раствором трилона Б в присутствии индикатора пирокатехинового фиолетового. Учитывая непостоянство состава препарата, расчет содержания проводят по оксиду висмута, которого должно быть 79-82%. Хранят в хорошо укупоренной таре, в темном месте. При доступе влаги и света он постепенно гидролизуется с образованием азотной кислоты и оксидов азота. Применяют как вяжущее и частично антисептическое средство при желудочно-кишечных заболеваниях. Уголь, карбонаты и гидрокарбонаты. Уголь активированный. Уголь получают сжиганием органических веществ при слабом доступе воздуха. При сжигании дерева получают древесный, а при сжигании животных тканей (костей и др.) — животный уголь. Первый содержит до 90% углерода, второй — 7-10% углерода и до 80% золы (в основном фосфата кальция). Для получения угля активированного, применяемого для лечения, его обрабатывают перегретым паром (при 900°С). Высокая адсорбционная способность угля активированного обусловлена наличием пор, которые классифицируют на супермикропоры (0,6-0,7 нм), микропоры (0,8-1,6 нм), мезопоры (1,7-200 нм) и макропоры (более 200 нм). В микропорах и супермикропорах, соизмеримых с размерами адсорбируемых молекул, механизм адсорбции сводится к объемному заполнению. Вмезопорах происходит последовательное образование адсорбционных слоев, которое завершается заполнением пор по типу капиллярной конденсации. Макропоры служат транспортными каналами, подводящими молекулы поглощаемых веществ к адсорбционному пространству зерен угля. В целом адсорбционная поверхность 1 г угля активированного высокого качества достигает 1000 м2. К препарату предъявляют высокие требования по чистоте. Устанавливают нейтральность водного извлечения из препарата, допустимое содержание необуглившихся веществ: растворимых в воде — не более 1%, растворимых в разведенной соляной кислоте — не более 3%. Не допускается содержание сульфидов и цианидов. Нормируют допустимое содержание примесей хлоридов (0,008%), сульфатов (0,02%), тяжелых металлов (0,001%), железа (0,01%), мышьяка (0,0001 %), а также степень измельчения, потерю массы при высушивании (не более 10%), остаток после прокаливания (не более 4%). Качество угля активированного обусловлено его адсорбционной способностью, которую по ГФ устанавливают с помощью 0,15%-ного раствора метиленового синего. Этот раствор (16 мл) смешивают с 0,1 г высушенного при 120°С до постоянной массы угля, взбалтывают в течение 5 мин и фильтруют. Фильтрат должен быть бесцветным или почти бесцветным. Карбонаты и гидрокарбонаты. В лечебной практике нашли применение калиевые, натриевые и литиевые соли угольной кислоты. Угольная кислота образует два ряда солей: средние (карбонаты) и кислые (гидрокарбонаты). В ГФ включен натрия гидрокарбонат. Испытания этих солей на подлинность основаны на химической Реакции разложения минеральной кислотой (например, соляной). Бывает важно в условиях аптеки отличить натрия карбонат от натрия гидрокарбоната, учитывая сходство физических и химических свойств. Для этого к раствору соли добавляют индикатор фенолфталеин. При этом 0,1 М раствор карбонатов приобретает красное окрашивание, а аналогичный раствор натрия гидрокарбоната остается бесцветным или становится слабо-розовым. Получают гидрокарбонат при насыщении очищенного кристаллического карбоната натрия диоксидом углерода. Подлинность натрия гидрокарбоната устанавливают по наличию иона натрия и гидрокарбонат-иона. Последний обнаруживают по реакции разложения разведенной кислотой и выделению пузырьков газа. Количественное определение проводят титрованием (предварительно прокипяченного раствора препарата) 0,1 М раствором соляной кислоты (индикатор метиловый оранжевый). Аналогичные способы используют для испытания на подлинность и для количественного определения карбонатов (калия, лития). Натрия гидрокарбонат хранят в хорошо укупоренных банках. Во влажном воздухе он медленно теряет диоксид углерода и переходит в карбонат натрия. Применяют как антацидное средство и наружно для полосканий и ингаляций (0,5-2%-ные растворы). Используют и лития карбонат. Способы его испытаний аналогичны гидрокарбонатам. Применяют для лечения подагры и для растворения почечных камней, а также как нейролептическое средство. Препараты бора. В качестве лечебных средств из этих элементов применяют соединения бора: кислоту борную и натрия тетраборат. Источник их получения — природные минералы, которые либо сами содержат борную кислоту (сассолин) и натрия тетраборат (бура, кернит), либо разрушаются с их образованием. Лекарственный препарат кислоты борной обычно получают разложением буры или борокаль-цита горячим раствором соляной кислоты. Натрия тетраборат получают действием раствора карбоната натрия (при нагревании) на кислоту борную или минерал борокальцит. Оба препарата растворимы в воде, кислота борная еще и в этаноле. Подлинность препаратов бора устанавливают по реакции образования в присутствии этанола борноэтилового эфира. Если смесь поджечь, этанол горит пламенем, окаймленным зеленым цветом. Для количественного определения используют кислотные свойства растворов кислоты борной в глицерине и щелочные свойства водных растворов натрия тетрабората, применяя методы титрования. Препараты назначают в качестве антисептических средств. 12. Органические лекарственные вещества. Галогенпронзводные. спирты, альдегиды, алифатические и ароматические кислоты, аминокислоты, гидроксикислоты. Простые и сложные эфиры, амиды угольной и сульфаниловой кислоты, фенолы, аминоспирты. Гетероциклические соединения: производные фурана, пиразола, имидазола, пиридина, пиримидина, хинолина, изохинолина, фенотиазнна. Производные алифатических соединений: 1. Галогенопроизводные алканов. 2. Спирты. 3. Альдегиды и их производные. 4. Соли карбоновых кислот. 5. Аминокислоты алифатического ряда. 6. Углеводы. 7. Производные полиоксикарбоновых и полиаминополикарбоновых кислот. Производные ароматических соединений: 1. Фенолы и их производные. 2. Полиоксиполикарбонильные производные ароматического ряда. 3. Ароматические кислоты и их соли. 4. Производные фенолокислот. 5. Производные пара-аминофенола. 6. Производные фенилуксусной и фенилпропионовой кислот. 7. Аминокислоты ароматического ряда и их производные. Производные алициклических соединений: 1. Терпены. 2. Статины. 3. Производные циклогексана. 4. Стероидные гормоны и их полусинтетические аналоги. 5. Гликозиды. 6. Антибиотики-гликозиды. Гетероциклические соединения: 1. Производные фурана. 2. Производные 1,2- и 1,4-бензопирана. 3. Производные тиофена. 4. Производные пирролидина. 5. Производные пирролизидина. 6. Производные пиразола. 7. Гистамин и противогистаминные лекарственные вещества. 8. Производные пиридина. 9. Производные хинолина. 10. Витамины пиримидинотиазолового ряда и их производные. 11. Конденсированные производные азепина и диазепина. 12. Конденсированные производные β-лактамидов тиазолидина и дигидротиазина (пенициллины и цефалоспорины). 13. Конденсированные производные коррина и нуклеотида бензимидазола (кобаламины). 13.Использование проблемного подхода при изучении естественнонаучных дисциплин химико-фармацевтического профиля. |
