1 Предмет и методы химической термодинамики. Взаимосвязь между процессами обмена веществ и энергии в организме. Химическая термодинамика как теоретическая основа биоэнергетики. Термодинамика
 Скачать 0.58 Mb. Скачать 0.58 Mb.
|
Геометрическая изомериявнутреннее вращение вокруг двойной связи С-С затруднено. Такие атомы углерода находятся в sp2-гибридном состоянии и лежат в одной плоскости, как, например, в этилене: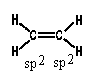 Двойную связь С -С можно рассматривать как состоящую из σ-связи (перекрывание гибридных орбиталей атомов углерода) и π-связи, образованной боковым перекрыванием р-орбиталей: 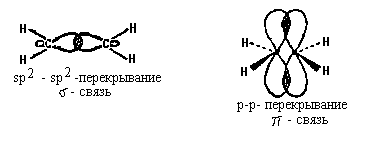 Поворот CН2-групп молекулы этилена друг относительно друга должен привести к нарушению перекрывания р-орбиталей, то есть к разрыву π-связи. Энергетический барьер такого поворота по разным оценкам, составляет 60-65 ккал/моль и при обычных условиях такой поворот не происходит (поворот возможен при фотохимическом возбуждении молекулы). Сказанное в полной мере относится и к другим молекулам с двойной связью С=С. Поэтому для алкенов возможна стереоизомерия, обусловленная различным взаимным расположением заместителей при двойной связи. Такие изомеры имеют одинаковое химическое строение (одинаковый порядок химической связи), различаясь по пространственному расположению атомов, по конфигурации. Это различие и создает разницу в физических и химических свойствах. Изомеры бутена-2 и их различия Геометрические изомеры, в отличие от конформаций, могут быть выделены в чистом виде и существуют как индивидуальные, устойчивые вещества. Для их взаимного превращения необходима обычно энергия порядка 125-170 кДж/моль (30-40 ккал/моль). Эту энергию можно сообщить нагреванием или облучением. Конечно, этот вид изомерии невозможен, если хотя 6ы у одного из атомов углерода, образующих двойную связь, два заместителя одинаковы: 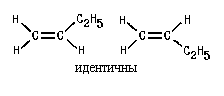 В школе нас учили называть геометрические изомеры по цис-транс-номенклатуре. Здесь всё легко и понятно: тот изомер, у которого одинаковые заместители лежат по одну сторону π-связи (т. е. плоскости, проходящей через оба атома двойной связи и перпендикулярной плоскости молекулы) мы обозначали как цис-изомер, а тот, в котором эти заместители находятся по разные стороны π-связи – транс-изомером. Так, изомер, изображённый в таблице слева, имеет цис-конфигурацию, а слева — транс-конфигурацию. Однако в ряде случаев нельзя было решить, какой изомер обозначить как цис, а какой – как транс. Например, если все четыре заместителя при двойной связи разные. Какой, например, изомер изображен ниже: цис-или транс-? 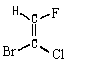 Чтобы избежать таких трудностей, были предложены новые обозначения. Согласно этим обозначениям, сначала для каждого атома углерода двойной связи нужно определить, какой заместитель при этом атоме старший, а затем, в зависимости от взаимной ориентации старших заместителей, обозначить изомер как Z (от немецкого zusammen – вместе) или как E (от немецкого entgegen – напротив) – Z, E-номенклатура. В Z-изомере старшие заместители расположены по одну сторону от плоскости π-связи, а в E-изомере – по разные стороны. При этом старшинство заместителя определяется, прежде всего атомным номером элемента, атом которого непосредственно связан с атомом углерода двойной связи, а затем атомными номерами следующих элементов вдоль цепи заместителя. Если атомы, непосредственно связанные с ненасыщенными углеродами, одинаковы, то переходят ко "второму слою", в случае необходимости – к "третьему слою" и т.д. 45) Оптическая изомерия. Оптическая активность. Прибор поляриметр. Среди органических соединений встречаются вещества, способные вращать плоскость поляризации света. Это явление называют оптической активностью, а соответствующие вещества - оптически активными. Оптическая изомерия появляется тогда, когда в молекуле присутствует асимметрический атом углерода; так называют атом углерода, связанный с четырьмя различными заместителями. Возможны два тетраэдрических расположения заместителей вокруг асимметрического атома. Обе пространственные формы нельзя совместить никаким вращением; одна из них является зеркальным изображением другой:  Так же этот вид изомерии называют оптической изомерией , зеркальной изомерией или энантиомерией . Обе зеркальные формы составляют пару оптических антиподов или энантиомеров . Оптическая активность - это способность среды (кристаллов, растворов, паров вещества) вызывать вращение плоскости поляризации проходящего через нее оптического излучения (света). Впервые оптическая активность была обнаружена в 1811 г.Д. Араго в кристаллах кварца. В 1815 г.Ж. Бои открыл оптическую активность чистых жидкостей (скипидара), а затем растворов и паров многих, главным образом органических веществ. Ж.Био установил, что поворот плоскости поляризации происходит либо по часовой стрелке, либо против нее, если посмотреть навстречу ходу лучей света и в соответствии с этим разделил оптически активные вещества на правовращающие (вращающие положительно, т.е. по часовой стрелке) и левовращающие (отрицательно вращающие) разновидности. Наблюдаемое значение угла поворота плоскости поляризации в случае раствора связано с толщиной образца и концентрацией оптически активного вещества. Оптически активными веществами называют лишь те вещества, которые проявляют естественную оптическую активность. Существует также и искусственная или наведенная оптическая активность. Ее проявляют оптически неактивные вещества при помещении в магнитное поле (эффект Фарадея). Различить оптические изомеры можно с помощью поляриметра - прибора, измеряющего угол поворота плоскости поляризации. Для растворов этот угол линейно зависит от толщины слоя и концентрации оптически активного вещества (закон Био). Для разных веществ оптическая активность может изменяться в очень широких пределах. Так, в случае водных растворов разных аминокислот при 25° С удельная активность (она обозначается как D и измеряется для света с длиной волны 589 нм при концентрации 1 г/мл и толщине слоя 10 см) равна - 232° для цистина, - 86,2° для пролина, - 11,0° для лейцина, +1,8° для аланина, +13,5° для лизина и +33,2° для аспарагина. Современные поляриметры позволяют измерять оптическое вращение с очень высокой точностью (до 0,001°). Подобные измерения позволяют быстро и точно определить концентрацию оптически активных веществ, например, содержание сахара в растворах на всех стадиях его производства - начиная от сырых продуктов и кончая концентрированным раствором и патокой. Оптическую активность кристаллов физики связывали с их асимметричностью; полностью симметричные кристаллы, например, кубические кристаллы поваренной соли оптически неактивны. Причина же оптической активности молекул долгое время оставалась совершенно загадочной. Первое открытие, проливавшее свет на это явление, сделал в 1848 никому тогда не известный Луи Пастер. Пастер, который выделил два антипода винной кислоты, которые получили название энантиомеров (от греч. enantios - противоположный). Хиральные и ахиральные молекулы. Хиральность — свойство молекулы не совмещаться в пространстве со своим зеркальным отражением[1]. Термин основан на древнегреческом названии наиболее узнаваемого хирального предмета — руки. Так, левая и правая руки являются зеркальными отражениями, но не могут быть совмещены друг с другом в пространстве. Подобным образом, свойством хиральности обладают молекулы, в которых отсутствуют зеркально-поворотные оси симметрии Sn, что эквивалентно наличию в молекуле элементов хиральности (центра, оси, плоскости хиральности и др.). Такие зеркально-симметричные формы химических соединений называются энантиомерами. Поскольку хиральность является геометрической характеристикой, её можно определить путём отнесения молекулы к той или иной группе симметрии. Очевидно, не являются хиральными молекулы с центром инверсии (i) или плоскостью симметрии (s), поскольку эти молекулы состоят из двух одинаковых частей, которые при отражении превращаются друг в друга, и отражение является эквивалентным исходной молекуле. Ранее геометрический критерий хиральности формулировали так: «у хиральной молекулы не должно быть плоскости симметрии и центра инверсии». В настоящее время пользуются более точным критерием, который предполагает отсутствие у хиральной молекулы также зеркально-поворотных осей Ахиральная молекула - молекула, совместимая со своим зеркальным изображением. Такая молекула симметрична и характеризуется наличием центра или плоскости симметрии. Значение изомерии в проявлении токсических свойств ксенобиотиков по отношению к организму человека. Ксенобиотики – чужеродные для организмов соединения (пестициды, ПАВ, красители, лекарственные вещества и пр.), которые практически не включаются в элементные циклы углерода, азота, серы или фосфора. Ксенобиотики временно или постоянно накапливаются в окружающей среде и вредно влияют на все живое. Широкое и повсеместное применение пестицидов, в том числе неразлагаемых, накопление различных отходов в огромных количествах привело к широкому распространению загрязнения окружающей среды – недр, воды, воздуха. Накопление ксенобиотиков представляет огромную опасность для человека, употребляющего в пищу крупную рыбу или высших животных Токсичность разных веществ не одинакова. Поскольку она проявляется во взаимодействии ксенобиотика с биологической системой, ее величина зависит от свойств как самого токсикан та, так и биосистемы, и в конечном итоге определяется: 1. Способностью вещества достичь структуры-мишени, взаимодействие с которой инициирует токсический процесс; 2. Характером и прочностью связи, образующейся между токсикантом и структурой-мишенью; 3. Значением структуры-мишени для поддержания гомеостаза в организме . Строение вещества определяет размеры молекулы, ее мас су, растворимость, летучесть, агрегатное состояние при нор мальных условиях и химическую активность. Все эти свойства влияют на токсичность вещества, вместе с тем ни одно из них не является единственно значимым 46) Проекционные формулы Фишера Проекция Фишера (проекционная формула Фишера, формула Фишера) — способ изображения трёхмерной молекулы в видепроекции, в которой вертикальные связи удаляются за проекционную плоскость, а горизонтальные связи выступают перед этой плоскостью[1]. Данные формулы были предложены Э. Фишером в 1891 году для изображения структур углеводов. Проекция Фишера (проекционная формула Фишера, формула Фишера) — способ изображения трёхмерной молекулы в виде проекции, в которой вертикальные связи удаляются за проекционную плоскость, а горизонтальные связи выступают перед этой плоскостью. Данные формулы были предложены Э. Фишером в 1891 году для изображения структур углеводов. Использование проекций Фишера для неуглеводных молекул может ввести в заблуждение и не рекомендуется ИЮПАК. В проекции Фишера химические связи изображаются в виде горизонтальных и вертикальных линий, на перекрестьях которых находятся стереоцентры. Углеродный скелет изображают вертикально, при этом сверху находится атом углерода, с которого начинается нумерация скелета (например, альдегидный С-атом для альдоз). Кроме того, в проекции Фишера все горизонтальные связи направлены в сторону наблюдателя, а вертикальные — удалены от наблюдателя. Данное условие важно для правильного построения проекции Фишера, а также при восстановлении трёхмерной структуры молекулы из её проекции. По этой причине проекцию Фишера нельзя вращать на 90° или 270°, так как это приведёт к изменению конфигурации стереоцентров. Согласно рекомендациям ИЮПАК, атомы водорода следует изображать в явном виде, однако структуры без атомов водорода также считаются приемлемыми. D,L-номенклатура (Связана с проекцией Фишера). Если функциональная группа при хиральном центре находится справа , то это D-изомер, если слева – L-изомер. Энантиомеры отличаются способностью вращать плоскополяризованный свет: справа (+) D, слева (-) L. ГЛИЦЕРИНОВЫЙ АЛЬДЕГИД (альдотриоза), простейший моносахарид. Существует в виде D-( + )- и L-( — )-изомеров (ф-лы I и II соотв.). В кристаллич. состоянии - циклич. 6-членный димер, в водном растворе - мономер. Для рацематадимера т. пл. 145°С, т. кип. 140-150°С/0,8 мм рт. ст. Хорошо растворим в воде, плохо -в этаноле, эфире, не растворим в бензоле, гептане. Легко изомеризуется в дигидроксиацетон (НОСН2)2СО, при окислении превращ. в глицериновую к-ту, при восстановлении - в глицерин. Под действием щелочей конденсируется с образованием гексоз. С дигидроксиацетоном образует гексулозы, с фенилгидразином - озазон. Рацемат глицеринового альдегида получают окислением глицерина (напр., р-ром Н2О2 и FeCl2, HNO,) или акролеина(надбензойной к-той, Н2О2 или др.). L-( — )-Изомер удобно синтезировать окислением L-сорбозы с послед. кислотнымгидролизом образовавшегося продукта, D-(+)-изомер-окислением D-фруктозы, 1,2 :5,6-ди-О-изопропилиден-D-маннита или D-маннита. 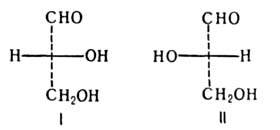 Производное глицеринового альдегида-D-глицеральдегид - 3 - фосфат образуется в зеленых растениях в тем-новой фазе фотосинтеза, является промежут. продуктом при гликолизе, спиртовом брожении и биосинтезе Сахаров. По сходству абс. конфигураций асимметрич. центров моносахаридов (в этом случае наиб. удаленного от карбонильной группы), гидроксикислот и аминокислот с конфигурацией асимметрич. центра L- или D-глицериновогоальдегида соответствующее соединение ОТНОСЯТ, К L- ИЛИ D-рЯДу Энантиомеры, диастереомеры, мезоформы Диастереомеры — стереоизомеры, не являющиеся зеркальными отражениями друг друга. Диастереомерия возникает, когда соединение имеет несколько стереоцентров. Если два стереоизомера имеют противоположные конфигурации всех соответствующих стереоцентров, то они являются энантиомерами. Однако, если конфигурация различается лишь у некоторых (а не у всех) стереоцентров, то такие стереизомеры являются диастереомерами. Если диастереомеры отличаются конфигурацией лишь одного стереоцентра, то они называются эпимерами. К диастереомерам также относят соединения с различной конфигурацией двойной связи (геометрические изомеры). В отличие от энантиомеров, диастереомеры различаются по физическим свойствам и реакционной способности. Энантиомеры — пара стереоизомеров, представляющих собой зеркальные отражения друг друга, не совмещаемые в пространстве[1]. Классической иллюстрацией двух энантиомеров могут служить ладони, имеющие одинаковую структуру, но различную пространственную ориентацию. Существование энантиомерных форм связано с наличием у молекулы хиральности — свойства не совпадать в пространстве со своим зеркальным отражением. В ахиральной (симметричной) среде энантиомеры имеют одинаковые химические и физические свойства, кроме способности вращать плоскость поляризации плоскополяризованного света на одинаковую величину угла, но в противоположных направлениях. Данное свойство энантиомеров получило название оптической активности. Большинство хиральных природных соединений (аминокислоты, моносахариды) существует в виде одного энантиомера. Понятие энантиомерии играет важную роль в фармацевтике, поскольку разные энантиомерылекарственных веществ, как правило, имеют различную биологическую активность. Мезоформаявляется диастереоизомером по отношению к каждому из зеркальных изомеров и поэтому отличается от них по температуре плавления и некоторым другим свойствам. Ее следует отличать от оптически неактивного рацемического соединения: последнее может быть разделено на оптически активные изомеры, тогда как для мезоформы этого сделать нельзя, ибо ее оптическая неактивность является свойством ее молекул. Рацемические смеси При синтезе органических веществ в лабораторных условиях всегда получается равномерная смесь обеих форм стереоизомеров, называемая рацемической смесью. В этом проявляется принципиальное различие между синтезами органических веществ, происходящими в живой клетке и в лабораторных условиях. В первом случае продукт биосинтетической реакции представляет собой вещество в определенной оптической форме, во втором - продуктом реакции является смесь обеих оптических форм синтезированного вещества. |
