1 Предмет и методы химической термодинамики. Взаимосвязь между процессами обмена веществ и энергии в организме. Химическая термодинамика как теоретическая основа биоэнергетики. Термодинамика
 Скачать 0.58 Mb. Скачать 0.58 Mb.
|
|
47) Механизмы биоорганических реакций. Под механизмомреакции подразумевается подробное описание процесса, в результате которого реагенты превращаются в продукты. Изучение механизма реакции включает в себя исследование( или умозрительное предположение): - этапов реакции - электронного и пространственного строения промежуточных частиц, которые образуются во время реакции. Механизм реакции должен быть подтвержден экспериментально с использованием нескольких соединений гомологического ряда или веществ, отличающихся только заместителями. В процессе познания представления о механизме реакции могут изменяться или даже полностью отвергаться. Стоит сказать, что для некоторых реакций на данном этапе развития науки, должна быть предложено несколько механизмов, каждый из которых имеет свои подтверждения. Реакционная способность- тип реакции и электронная природа промежуточных активных частиц- зависит от строения биоорганического соединения, типа связей. КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙ ПО РЕЗУЛЬТАТУ Существуют разные системы классификации органических реакций, которые основаны на различных признаках. Среди них можно выделить классификации по конечному результату реакции и по механизму ее протекания. В основе этой классификации лежит сопоставление числа, состава и строения исходных и конечных продуктовпо уравнению реакции. В соответствии с конечным результатом различают следующие типы органических реакций: · замещение; · присоединение; · отщепление (элиминирование); · изомеризация (перегруппировка); · разложение. Если процесс сопровождается изменением степени окисления атома углерода в органическом соединении, то выделяют также реакции окисления и восстановления. Окисление и восстановление органических веществ может проходить по какому-либо из названных выше типов реакций. Реакции замещения Атом или атомная группировка в молекуле органического соединения замещается на другой атом (или атомную группировку): АВ + С→ АС + В Реакции этого типа можно рассматривать как реакции обмена, но в органической химии предпочтительней термин "замещение", поскольку в обмене участвует (замещается) лишь меньшая часть органической молекулы. Примеры: C2H6 + Cl2 (на свету)→CH3CH2Cl + HCl хлорирование этана CH3CH2Cl + KOH (водн. р-р) → CH3CH2OH + KCl щелочной гидролиз хлорэтана Реакции присоединения В реакциях присоединения молекула органического соединения и молекула простого или сложного вещества соединяются в новую молекулу, при этом другие продукты реакции не образуются: А + В→С Примеры: CH2=CH-CH3 + Br2 →CH2Br-CHBr-CH3 бромирование пропена CH2=CH2 + H2O→CH3CH2OH гидратация этилена К реакциям присоединения относятся также реакции полимеризации: n A → An Например, образование полиэтилена: n CH2=CH2→(-CH2-CH2-) n Реакции отщепления В реакции отщепления (элиминирования) происходит отрыв атомов или атомных групп от молекулы исходного вещества при сохранении ее углеродного скелета. А→ В + С Например: · отщепление хлороводорода (при действии на хлоралкан спиртовым раствором щёлочи) CH3-CH2Cl →CH2=CH2 + HCl · отщепление воды (при нагревании спирта с серной кислотой) CH3-CH2OH→CH2=CH2 + H2O дегидратация этанола · отщепление водорода от алкана (в присутствии катализатора) CH3-CH3 →CH2=CH2 + H2 дегидрирование этана Реакции изомеризации или перегруппировки В органическом соединении происходит переход (миграция) отдельных атомов или групп атомов от одного участка молекулы к другому без изменения ее качественного и количественного состава: А→В В этом случае исходное вещество и продукт реакции являются изомерами (структурными или пространственными). Например, в результате перегруппировки может изменяться углеродный скелет молекулы: 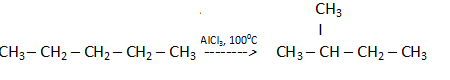 Реакции разложения В результате реакции разложения из молекулы сложного органического вещества образуется несколько менее сложных или простых веществ: А→ В + С + . . . К этому типу реакций относится процесс крекинга – расщепление углеродного скелета крупных молекул при нагревании и в присутствии катализаторов: CnH2n+2→ CmH2m+2 + CpH2p (n = m + p) Например C10H22→ C5H12 + C5H10 Реакции разложения при высокой температуре называют пиролизом, например: СН4 → C + 2H2 пиролиз метана (1000 oC) Реакции окисления и восстановления Окислительно-восстановительные реакции - реакции, в ходе которых меняется степень окисления атомов, входящих в молекулу. Для органических реакций этого типа применимы те же законы, что и для неорганических. Отличием является то, что в органической химии окислительно-восстановительные процессы рассматриваются прежде всего по отношению к органическому веществу и связываются с изменением степени окисления углерода, являющегося реакционным центром молекулы. Эти реакции могут проходить по типу реакций присоединения, отщепления, замещения и т.п. Если атом углерода в органической молекуле окисляется (отдает электроны более электроотрицательному атому), то этот процесс относят к реакциям окисления, т.к. продукт восстановления окислителя (обычно неорганическое вещество) не является конечной целью данной реакции. И наоборот, реакцией восстановления считают процесс восстановления атома углерода в органическом веществе. Часто в органической химии ограничиваются рассмотрением реакций окисления и восстановления как реакций, связанных с потерей и приобретением атомов водорода и кислорода. Вещество окисляется, если оно теряет атомы H и (или) приобретает атомы O. Кислородсодержащий окислитель обозначают символом [O]:  Вещество восстанавливается, если оно приобретает атомы H и (или) теряет атомы O. Восстановитель обозначают символом [H]: Степень окисления углерода в его соединениях изменяется в диапазоне от -4 (например, в метане CH4) до +4 (в CO2). В органических соединениях атомы углерода в одной и той же молекуле могут иметь разные степени окисления: -3CH3--1CH2-OH КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙ ПО МЕХАНИЗМУ В зависимости от способа разрыва ковалентной связи в реагирующей молекуле органические реакции подразделяются на радикальные и ионные реакции. Ионные реакции в свою очередь делятся по характеру реагента, действующего на молекулу, на электрофильные и нуклеофильные. Разрыв ковалентной связи может происходить двумя способами, обратными механизмам ее образования. Разрыв связи, при котором каждый атом получает по одному электрону из общей пары, называется гомолитическим: В результате гомолитического разрыва образуются сходные по электронному строению частицы, каждая из которых имеет неспаренный электрон. Такие частицы называются свободными радикалами. Электрофильные реакции Электрофильной называется реакция, в которой молекула органического вещества подвергается действию электрофильного реагента. Электрофильные ("любящие электроны") реагенты или электрофилы – это частицы (катионы или молекулы), имеющие свободную орбиталь на внешнем электронном уровне. Примеры электрофильных частиц: H+, CH3+ и другие карбокатионы, NO2+, ZnCl2, AlCl3. Незаполненность внешнего электронного уровня в электрофиле показана на примере AlCl3. Электрофильное присоединение: CH2=CH2 + HCl → CH3CH2Cl (электрофил – H+ в составе HCl) Стадии: I. CH2=CH2 + Hδ+Clδ→ CH3CH2+ + Cl(медленная) II. CH3CH2+ + Cl→CH3CH2Cl (быстрая) Механизм электрофильного присоединения обозначается символом AdE (по первым буквам английских терминов: Ad – addition [присоединение], E – electrophile [электрофил]). Электрофильное замещение: C6H6 + NO2+→ C6H5NO2 + H+ (электрофил - NO2+) Катион NO2+ образуется в смеси конц. кислот HNO3 и H2SO4. Обозначение механизма – SE (S – substitution [замещение]). Нуклеофильные реакции Нуклеофильной называется реакция, в которой молекула органического вещества подвергается действию нуклеофильного реагента. Нуклеофильные ("любящие ядро") реагенты, или нуклеофилы - это частицы (анионы или молекулы), имеющие неподеленную пару электронов на внешнем электронном уровне. Примеры нуклеофильных частиц: OH, Cl, Br, CN, H2O, CH3OH, NH3. Строение некоторых нуклеофильных реагентов 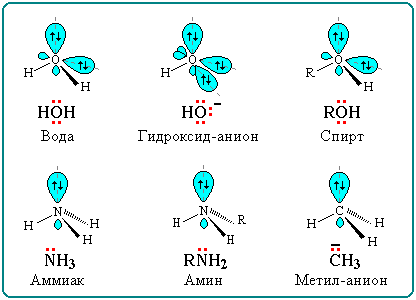 Благодаря подвижности π-электронов, нуклеофильными свойствами обладают также молекулы, содержащие π-связи: CH2=CH2, CH2=CH–CH=CH2, C6H6 и т.п. (Между прочим, это объясняет, почему этилен CH2=CH2 и бензол C6H6, имея неполярные углерод-углеродные связи, вступают в ионные реакции с электрофильными реагентами). Примеры нуклеофильных реакций Нуклеофильное замещение: 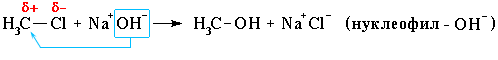 Механизм нуклеофильного замещения обозначается символом SN (по первым буквам английских терминов: S – substitution [замещение], N – nucleophile [нуклеофил]). Нуклеофильное присоединение: 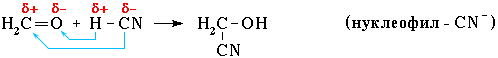 ПОНЯТИЯ- СУБСТРАТ, РЕАГЕНТ, РЕАКЦИОННЫЙ ЦЕНТР Субстрат -химическое вещество, подвергающееся превращению под действием фермента. Реагент -это вещества, которые принимают участие в химической реакции, но при этом сами не являются объектом обработки. реакционный центр -атом, у которого происходит разрыв или образование связей. 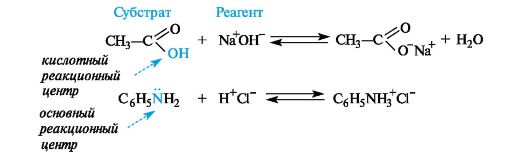 Продукт реакции– образующиеся в ходе реакции вещество. Энергия активации -минимальное количество энергии, которое требуется сообщить системе (выражается в джоулях на моль), чтобы произошла реакция. Скорость реакции -изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Механизм реакции -это детальное описание всех стадий химического процесса. Типы реагентов: радикальные, кислотные, основные, электрофильные, нуклеофильные. Способы разрыва ковалентной связи в органических соединениях и образующиеся при этом частицы: свободные радикалы (гомолитический разрыв), карбкатионы и карбанионы (гетеролитический разрыв). Электронное и пространственное строение этих частиц и факторы, обусловливающие их относительную устойчивость. Типы реагентов: Радикальные реагенты(радикалы) - свободные атомы или частицы с неспаренным электроном. Примеры радикальных реагентов: гидроксильные НОˑ, гидропероксильные HOOˑ, алкильные Rˑ радикалы, атомы галогенов Сˑ, Brˑ. Электрофильные реагенты(электрофилы) - частицы, образующие новую ковалентную связь за счет электронной пары реакционного партнера. Электрофильные частицы обозначаются символом Е+ или Е. Они могут нести положительный заряд - протон Н+, карбокатионы R3C+, ацилий-катионы R-C=O - или быть электронейтральными, например триоксид серы SO3. Кислотные реагенты(кислоты) - полностью или частично ионизированные в водных растворах нейтральные молекулы (CH3COOH, HCl) либо положительно заряженные частицы (катионы аммония NH4+, гидроксония H3O+), способные быть донором протона для реакционного партнера. Нуклеофильные реагенты(нуклеофилы) - частицы, образующие новую ковалентную связь с реакционным партнером, предоставляя для этого свою электронную пару. Нуклеофильные частицы обозначаются символами Nu или Nu и могут быть отрицательно заряженными - гидрид-ион Н-, гидроксид-ион НО-, алкоксид-ион RO- , карбанион R3C- , хлорид-ион Cl- или быть электронейтральными. В этом случае их нуклеофильность обусловлена р- или π-электронами (NH3, H2O, CH2=CH2, C6H6). Основные реагенты(основания) - отрицательно заряженные частицы (НО-, RO-) или нейтральные молекулы (NH3, H2O), способные оторвать протон от кислотного реакционного центра. Основные реагенты обозначаются символами B- или B. В соответствии с характером разрыва связи в субстрате и природой реагента различают реакции радикальные и ионные. 48)СОПРЯЖЕННЫЕ СИСТЕМЫ С ЗАМКНУТОЙ ЦЕПЬЮ. АРОМАТИЧНОСТЬ, КРИТЕРИИ АРОМАТИЧНОСТИ. Сопряженные системы с замкнутой цепью сопряжения – это арены, гетероциклические соединения и небензоидные ароматические структуры, более термодинамически устойчивы по сравнению с открытыми. Сопряженные системы с замкнутой цепью сопряжения – это арены, гетероциклические соединения и небензоидные ароматические структуры. Простейшие замкнутые сопряженные структуры – арены, родоначальником которых является бензол. Бензол был известен издавна, однако долгое время эго структура была не доказана и только в 1865 А.Кекуле предложил изображать строение молекулы бензола в виде правильного шестиугольника с системой чередующихся двойных и простых связей. Изображать формулу бензола принято таким образом и сейчас. Все атомы углерода в бензольном цикле находятся в sр2- гибридизации, все связи С–С равны между собой, имеют длину 1,40 А° и занимают как бы промежуточное положение между простой (1,54 А°) и двойной (1,33 А°) связями, При этом каждый атом углерода образует три s- связи (одну связь С–Н и две s-связи С–С), лежащих в одной плоскости , т.е. у каждого атома углерода осталось по одному р-электрону, орбитали которых, за счет двукратного перекрывания друг с другом образуют замкнутую p-электронную систему, которая охватывает все атомы углерода. p-Электронная плотность в такой системе распределена равномерно. Замкнутый секстет электронов представляет собой связь, которая отличается от других типов, и ее часто называют ароматической. Электронное строение молекулы бензола можно описать с помощью теории резонанса, согласно которой молекула бензола рассматривается как резонансный гибрид двух предельных (граничных структур) Понятие ароматичности возникло более ста лет тому назад. В настоящее время к ароматическим системам относятся любые плоские замкнутые циклы, отвечающие критериям ароматичности. Критерии ароматичности 1. Молекула имеет плоское циклическое строение. 2. Все атомы в цикле в состоянии sp2- гибридизации (следовательно s-скелет плоский и все рz-орбитали параллельны. 3. В молекуле существует делокализованная p-электронная система, содержащая 4n + 2 p-электрона , где n = 0,1,2, – натуральный ряд чисел. Это правило получило название правила Хюккеля, предложено в 1931 на основании метода молекулярных орбиталей). Правило Хюккеля применимо не только для моноциклических p-электронных систем, но и для плоских конденсированных систем. Нафталин Антрацен Фенантрен 4n+2=10 p-эл-нов 4n+2=14 p-эл-нов 4n+2=14 p-эл-нов n = 2 n = 3 n = 3 Однако не все замкнутые ароматические структуры являются ароматическими. Так, например, циклооктатетраен-1,3,5,7 не относится к ароматическим, т.к. не удовлетворяется правило Хюккеля, 4n + 2 = 8 p-электронов, n = 1,5. Циклооктатетраен-1,3,5,7 Ароматическим характером обладают и гетероциклические соединения. При замене в молекуле бензола –СН= на –N= образуется гетероциклическое соединение пиридин. Пиридиновое ядро входит в состав многих природных веществ: витамины РР, В6, кофермент НАД, никотин и другие, а также входит в состав лекарственных препаратов (фтивазид). Пиридин удовлетворяет всем критериям ароматичности. 1. Имеет циклическое строение.2. Все атомы углерода в цикле в состоянии sp2 -гибридизации, пиридиновый атом азота также находится sp2 –гибридизации; электронное строение пиридиновогоатома углерода. 3. Правило Хюккеля 4n + 2 = 6 p-электронов, n = 1. Все критерии ароматичности соблюдены, пиридин является ароматическим соединением. Пиридиновый атом азота поставляет в ароматическое p-электронное облако Рz-орбиталь с одним электроном, остальные четыре электрона располагаются на трех sp2-гибридных орбиталях, причем две из них участвуют в образовании двух s-связей, а третья с неподеленной электронной парой определяет его свойства как основания. В молекуле пиридина имеет место p,p-сопряжение. Пиридиновый азот из-за большей электроотрицательности по сравнению с углеродом смещает к себе единую p-электронную плотность, в целом понижая электронную плотность ароматического кольца. Поэтому такие системы с пиридиновым азотом называют p-недостаточными. При замене фрагмента –СН=СН– на >NН возникает пятичленный цикл – пиррол. 1.Молекула пиррола имеет циклическое строение.2.Все атомы углерода в цикле находятся в sp2-гибридизации, атом азота также находится в sp2-гибридизации, при этом пиррольный атом азота поставляет в единое p-электронное облако двухэлектронную Рz-орбиталь. Правило Хюккеля. Правило Хюккеля: ароматической является плоская моноциклическая сопряженная система, содержащая (4n + 2) p-электронов (где n = 0,1,2...). Таким образом, ароматическими будут плоские циклические сопряженные системы, содержащие 2, 6,10, 14 и т.д. p-электронов. Плоские циклические сопряженные системы, содержащие 4n p-электронов (n=1,2…), неустойчивы, так как обладают незамкнутой электронной оболочкой с частично заполненными несвязывающими орбиталями. Такие системы относят к антиароматическим. Критерии ароматичности Правило Хюккеля представляет собой теоретический обоснованный метод, позволяющий предсказать, будет ли моноциклическая система ароматической. Для проверки правильности предсказания необходимо располагать экспериментальными критериями ароматичности Важнейшими из физических критериев ароматичности являются энергетические, магнитные и структурные свойства сопряженных циклических систем. Энергетические критерии  Основной признак ароматического характера соединения – повышенная термодинамическая устойчивость, которая является следствием циклической делокализации p-электронов. Выигрыш в энергии за счет делокализации называют энергией делокализации или энергией резонанса. Энергия делокализации не является измеряемой физической величиной, так как для ее определения необходимо сравнивать бензол с реально не существующим гипотетическим 1,3,5-циклогексатриеном, имеющим локализованные простые и двойные связи. Полициклические ароматические соединения -токсичные факторы окружающей среды Тип воздействия ПАУ на живые организмы ключевым образом зависит от структуры самого углеводорода и может изменяться в очень широких пределах. Многие полициклические ароматические углеводороды являются сильными химическими канцерогенами. Такие соединения, как бенз[a]антрацен, бензпирен и овален, обладают ярко выраженными канцерогенными, мутагенными и тератогенными свойствами. По оценкам 2002 года жители некоторых развитых стран получают с пищей, в среднем, около 1-5 мкг ПАУ ежедневно. При частом употреблении копченых продуктов или пищи, приготовленной на древесном угле (например, барбекю), суточное количество ПАУ может возрастать до 6-9 мкг. Еще около 0,16 мкг ПАУ в день (от 0,02 до 3 мкг) поступает в организм с наружным воздухом, и 0,006 мкг с питьевой водой (0,0002 - 0,12 мкг). |
