химия. 1 Предмет и методы химической термодинамики. Взаимосвязь между процессами обмена веществ и энергии в организме. Химическая термодинамика как теоретическая основа биоэнергетики. Термодинамика
 Скачать 0.58 Mb. Скачать 0.58 Mb.
|
|
Раздел 2. 16)Понятие биогенности химических элементов. Теория Вернадского. Классификация биогенных элементов по их функциональной роли. Основные источники поступления примесных элементов в организм человека. Химические аспекты охраны окружающей среды. Химия биогенных элементов s-,p-,d-блоков: определение, положение в ПС, биологическая роль. Понятие о ксенобиотиках. Хелатотерапия. Биогенные элементы – элементы, необходимые для построения и жизнедеятельности различных клеток и организмов. Существуют: Макроэлементы - биогенные элементы, содержание которых превышает 0,01% от массы тела. Микроэлементы - биогенные элементы, суммарное содержание которых составляет величину порядка 0,01%. Ультрамикроэлементы - элементы, содержание которых меньше чем 10^-5%. Биосфера – часть земной оболочки, занятая растительными и животными организмами. Среда, организованная определённым образом, переработанная живыми организмами и космическими излучениями и приспособленная к жизни (по В. И. Вернадскому). Характеризуя природу и происхождения веществ биосферы, В.И. Вернадский выделял следующие основные группы: Живое вещество. Под живым веществом Вернадский понимал совокупность всех живых организмов, выраженную через массу, энергию или химический состав. Живое вещество составляет порядка 0.01 - 0.02 % от массы всей биосферы. Косное вещество. Так Вернадский называл вещества, образуемые без участия живых организмов. Это, например, горные породы, продукты извержения вулканов и т.п. Биокосное вещество. Вещество отнесенную в промежуточную группу, свойства которой так или иначе обусловлены воздействием жизни. По сути, это функционально неделимая совокупность живого и косного веществ. Это, например, почва. Биогенное вещество. Это вещество, образованное в результате жизнедеятельности живых организмов, в том числе и находящееся в ископаемом состоянии. Углеводороды недр, руды металлов, и весь осадочный слой в целом можно отнести к биогенным веществам. В настоящее время данную классификацию необходимо дополнить еще и веществом, образующимся в процессе деятельности человечества – так называемыми антропогенными веществами. И хотя некоторые из них могут включаться в естественный круговорот веществ, значительное количество антропогенных веществ не утилизируются живым веществом, представляя серьезную опасность для биосферы. Классификация биогенных элементов по их функциональной роли: Органогены – систем (C, Н, О, N, Р, S) только 6 элементов, составляющих основу живых. Они составляют в организме 97,4% Элементы электролитного фона (Na, К, Ca, Mg, Сl). Данные ионы металлов составляют 99% общего содержания металлов в организме. Микроэлементы – (I, Cu, As, F, Br, St, Ba, Co) их содержание в организме находится в пределах от 10-3 до 10-5 %. Примесные элементы - биологическая роль не выяснена до конца. Их делят на аккумулирующиеся (Hg, Pb, Cd) и не аккумулирующиеся (Al, Ag, Go, Ti, F). Токсичные элементы (тяжелые металлы) – это химические элементы, оказывающие отрицательное влияние на живые организмы, которое проявляется только при достижении некоторой концентрации, определяемой природой организма. Многие тяжелые металлы проявляют высокую токсичность в следовых количествах и концентрируются в живых организмах. В отличие от органических загрязняющих веществ, подвергающихся в природной среде процессам разложения, металлы способны лишь перераспределяться между природными средами. Поступление тяжелых металлов в окружающую среду имеет как естественное, так и техногенное происхождение. В результате воздействия загрязненной окружающей среды, а также при нарушении технологической обработки или условий хранения в пищевых продуктах могут появиться токсичные химические элементы, которые чрезвычайно токсичны даже в микроскопических дозах. Поэтому важной задачей является постоянный контроль пищевого сырья и готовой продукции, для того, чтобы обеспечить выпуск безвредных для здоровья продуктов питания. Химические загрязнения и их последствия: Парниковый эффект Кислотные осадки Разрушение озонового слоя Общее загрязнение атмосферы Радиоактивное загрязнение Биогенные элементы подразделяют на три блока: s-, р-, d– блоки. Химические элементы, в атомах которых заполняются электронами, s-подуровень внешнего уровня, называют s-элементами. Строение их валентного уровня ns1-2. Небольшой заряд ядра, большой размер атома способствуют тому, что атомы s-элементов – типичные активные металлы; показателем этого является невысокий потенциал их ионизации. Катионы IIА группы имеют меньший радиус и больший заряд и обладают, следовательно, более высоким поляризующим действием, образуют более ковалентные и менее растворимые соединения. Атомы стремятся принять конфигурацию предшествующего инертного газа. При этом элементы IA и IIA групп образуют соответственно ионы М+ и М2+. Химия таких элементов является в основном ионной химией, за исключением лития и бериллия, которые обладают более сильным поляризующим действием. Элементы d–блока – это элементы, у которых происходит достройка d–подуровня предвнешнего уровня. Они образуют В – группы. Электронное строение валентного уровня d–элементов: (n-1)d1-10, ns1-2. Они расположены между s– и р–элементами, поэтому получили название «переходные элементы», d-элементы образуют 3 семейства в больших периодах и включают по 10 элементов (4-й период семейство Sc21 – Zn30, 5-й период – Y39 - Cd48, 6-й период - La57 – Hg80, 7-й период Ас89 – Mt109). 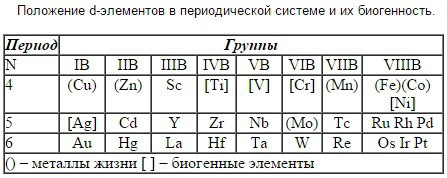 Элементы у которых происходит достройка р-подуровня внешнего валентного уровня называют р-элементами. Электронное строение валентного уровня ns2p1-6. Валентными являются электроны s- и р-подуровней. 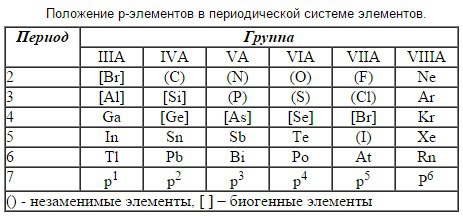 Ксенобиотики — условная категория для обозначения чужеродных для живых организмов химических веществ, естественно не входящих в биотический круговорот. Как правило, повышение концентрации ксенобиотиков в окружающей среде прямо или косвенно связано с хозяйственной деятельностью человека. К ним в ряде случаев относят: пестициды, некоторые моющие средства (детергенты), радионуклиды, синтетические красители, полиароматические углеводороды и др. Попадая в окружающую природную среду, они могут вызвать повышение частоты аллергических реакций, гибель организмов, изменить наследственные признаки, снизить иммунитет, нарушить обмен веществ, нарушить ход процессов в естественных экосистемах вплоть до уровня биосферы в целом. Изучение превращений ксенобиотиков путём детоксикации и деградации в живых организмах и во внешней среде важно для организации санитарно-гигиенических мероприятий по охране природы. Хелатотерапия представляет собой химический процесс, в котором синтетический раствор ЕДТА (этилендиаминтетраацетиловой кислоты) вводят в кровь при помощи инъекции для удаления тяжелых металлов/минералов из организма. Слово «Chelation» означает «схватить» или «связывать». Когда раствор ЭДТА вводится в вену, он «связывает» тяжелые металлы и минералы (такие как свинец, ртуть, медь, железо, мышьяк, алюминий и кальций) и выводит их из организма. Хелатотерапия является отличным средством для лечения отравления свинцом. Польза от лечения других заболеваний с помощью хелатотерапии весьма спорна и бездоказательна. Раздел 3 17)Кислоты и основания. Основные положения теории кислот и оснований Бренстеда-Лоури: молекулярные и ионные кислоты и основания, сопряжённая протолитическая пара, амфолиты. Изоэлектрическая точка. Гидролиз солей: степень гидролиза. В настоящее время трактовка кислотно-основных свойств соединений производится с позиций трёх основных теорий: теория Аррениуса, Бренстеда-Лоури, Льюиса. Согласно теории Аррениуса: Кислоты - это электролиты при диссоциации которых в качестве катионов образуются только H+ Гидроксиды - это электролиты при диссоциации которых в качестве аниона образуются только ионы OH-. Теория кислот и оснований Аррениуса не имеет всеобщего характера и не может объяснить как свойства веществ в неводных растворителях, так и свойства веществ, не подвергающихся диссоциации (NH3, CaO, CO2). Более общий характер имеет созданная в 1923 году протолитическая теория кислот и оснований Бренстеда-Лоури (теория сопряжённых пар). Согласно этой теории: Кислоты - это молекулы или ионы, способные отдавать протон, то есть доноры протонов. Основания - это молекулы или ионы, способные присоединять протон, то есть акцепторы протонов. Согласно протолитической теории, кислоты, основания и амфолиты являются протолитами, а процесс перехода протона от кислоты к основания называется протолизом. Подобный подход позволяет оценивать кислотно-основные свойства ионов. Например, карбонат-ион может присоединить протон и, следовательно, является основанием, а гидрокарбонат-ион может отдать протон, и значит, является кислотой: (CO3-)основание + (H+) ⇆ (HCO3-)кислота Кислоты Бренстеда-Лоури делят на 3 типа: Нейтральные кислоты: HCl, H3PO4, HNO3, HClO Катионные кислоты: NH4+, H3O+ Анионные кислоты: H2PO4-, HCO3-, HSO4- На такие же три группы делятся основания: Нейтральные основания: NH3, H2O Анионные основания: OH-, F- Катионные основания: (NH2-NH3)+ Согласно протолитической теории, отдавая протон, кислота превращается в частицу, которая называетсясопряжённым основанием. Соответственно, основание, присоединяя протон, превращается в сопряжённую кислоту. Кислота и сопряжённое ей основание (или основание с сопряжённой кислотой) образуют сопряжённую кислотно-основную пару, в которой чем сильнее кислота, тем слабее сопряжённое с ней основание и наоборот. Молекулы воды (H2O), аммиака (NH3 жидк.), анионы многоосновных кислот могут быть как донорами, так и акцепторами протонов, т.е. являются веществами-амфолитами. Изоэлектрическая точка (ИЭТ): характеристика состояния р-ра амфотерного электролита (амфолита), способного присоединять или отщеплять протоны, превращаясь либо в положительно, либо в отрицательно заряженные ионы, при котором суммарный электрический заряд амфолита равен нулю. В ИЭТ амфолит не перемещается в электрическом поле. Соответствует рН раствора, при котором одинаковы концентрации положительно и отрицательно заряженных форм (для аминокислот) или числа ионизированных кислотных и основных групп (для макромолекул белков и др. полиамфолитов). Значение рН в ИЭТ (обозначают рI, или рНI) определяется величинами констант диссоциации кислотной и основной ф-ций: pI = 0,5(рК1+рK2). Гидролизом солей называют взаимодействие солей и воды с образованием слабых электролитов. В итоге гидролиза обычно происходит изменение реакции среды. Гидролиз является обратимым процессом, протекает в крайне незначительной степени, поэтому в схемах реакций ставят знак обратимости. Принято выделять следующие типы гидролиза солей: -Гидролиз по аниону (сильное основание и слабая кислота); -Гидролиз по катиону (слабое основание и сильная кислота); -Гидролиз по катиону и по аниону (слабое основание и слабая кислота); -Не гидролизуются (сильное основание и сильная кислота). Способность солей вступать в реакции гидролиза характеризуется степенью гидролиза. Степенью гидролиза hг называют отношение концентрации гидролизованной части соли Сг к её общей концентрации С0: hг = Сг/С0. Факторы, влияющие на степень гидролиза: -Температура; -Концентрация продуктов гидролиза; -Концентрация соли; -Разбавление; -Добавки посторонних веществ. 18)Основные положения теории кислот и оснований Льюиса. Принцип ЖМКО. Более общей теорией, трактующей кислотно-основные свойства соединений, является теория Льюиса. Она опирается на строение внешних электронных оболочек атомов и позволяется объяснить свойства соединений, не содержащих H+. Кислотой Льюиса называют вещества, имеющие вакантные орбитали, и способные принимать электронные пары, то есть быть акцептором электронов. К ним относятся H+, Na+, K+, Mg+2, Ca+2, Mn+2, Al+3, Ag+, Cu+, Hg+2 и т.д. Основание Льюиса - вещества, имеющие неподелённые электронные пары и способные их отдавать для образования химической связи, то есть быть донорами электронов. К ним относятся H2O, OH-, ROH, NH3, RNH2, ROR, Cl-, F- и т.д. По Льюису отличительной способностью кислот и оснований является их взаимная нейтрализация путем образования ковалентной связи: Cl3Br+: NH3 Cl3Br: NH3; O3S+:OH2 O3S:OH2. Согласно теории Льюиса, различают жёсткие и мягкие кислоты и основания. В соответствии с принципом ЖМКО (жёстких и мягких кислот и оснований) жёсткие кислоты преимущественно реагируют с жёсткими основаниями, а мягкие кислоты - с мягкими основаниями. Классификация кислот и оснований в рамках принципа ЖМКО: Жёсткие кислоты (H+, Li+, Na+, K+, Mg2+, Ca2+, Al3+, Cr3+, Fe3+, BF3, B(OR)3, AlR3, AlCl3, SO3, BF3, RCO+, CO2, RSO2+); Жёсткие основания (OH-, RO-, F-, Cl-, RCOO-, NO3-, NH3, RNH2, H2O, ROH, SO42-, CO32-, R2O, NR2-, NH2-); Промежуточные кислоты (Cu2+, Fe2+, Zn2+, SO2, R3C+, C6H5+, NO+); Промежуточные основания (Br-, C6H5NH2, NO2-, C5H5N); Мягкие кислоты (Ag+, Cu+, Hg2+, RS+, I+, Br+, Pb2+, BH3, карбены); Мягкие основания (RS-, RSH, I-, H-, R3C-, алкены, C6H6, R3P, (RO)3P). Рассмотренные теории кислот и оснований не противоречат, а дополняют друг друга и имеют глубокую внутреннюю связь. Так, кислоты, по Бренстеду, можно рассматривать как частный случай льюисовских кислот, поскольку протон характеризуется большим сродством к электронной паре и может рассматриваться, по Льюису, как кислота. 19)Буферное действие - основной механизм протолитического гомеостаза организма. Механизм действия буферных систем. Зона буферного действия и буферная ёмкость. Расчёт рН протолитических систем. Кислотно-основный гомеостаз. Общая, активная, потенциальная кислотность. Алкалоз, ацидоз. Одним из характерных свойств внутренней среды организма человека является постоянство концентрации водородных ионов (изогидрия). Большинство ферментов активны только при определённом значении рН; рН крови человека 7,36 и смещение больше чем на 0,4 единицы в любую сторону от нормального значения может привести к летальному исходу. Сохранение этого показателя обеспечивается совместным действием ряда физико-химических и физиологических механизмов, среди которых важная роль принадлежит буферным системам: бикарбонатной, гемоглобиновой, белковой, фосфатной. Буферными системами (буферами) называют растворы, обладающие свойством сохранять постоянство концентрации водородных ионов как при добавлении небольшого количества кислот или щелочей, так и при разбавлении. По составу различают: Кислотные буферы, состоящие из слабой кислоты и её соли, образованной сильным основанием; Основные буферы, состоящие из слабого основания и её соли, образованной сильной кислотой; Амфотерные буферы; Солевые буферы, состоящие из двух кислых или кислой и средней солей. Механизм буферного действия можно понять на примере ацетатной буферной системы. СН3СОО-/СН3СООН в основе действия которой лежит кислотно-основное равновесие: Главный источник ацетат-ионов – сильный электролит CH3COONa: CH3COONa→ СН3СОО- + Na+ При добавлении сильной кислоты сопряженное основание СН3СОО- связывает добавочные ионы Н+, превращаясь в слабую уксусную кислоту: СН3СОО- + Н+↔ СН3СООН (кислотно-основное равновесие смещается влево, по Ле-Шателье). Уменьшение концентрации анионов СН3СОО- точно уравновешивается повышением концентрации молекул уксусной кислоты. В результате происходит небольшое изменение в соотношении концентраций слабой кислоты и ее соли, а, следовательно, и незначительно изменяется рН. При добавлении щелочи протоны уксусной кислоты (резервная кислотность) высвобождаются и нейтрализуют добавочные ионы ОН-, связывая их в молекулы воды: СН3СООН + ОН-↔ СН3СОО- + Н2О (кислотно-основное равновесие смещается вправо, по Ле-Шателье). В этом случае также происходит небольшое изменение в соотношении концентраций слабой кислоты и ее соли, а, следовательно, и незначительное изменение рН. Уменьшение концентрации слабой уксусной кислоты точно уравновешивается повышением концентрации анионов СН3СОО- . Аналогичен механизм действия и других буферных систем. Буферное действие раствора обусловлено смещением кислотно-основного равновесия за счет связывания добавляемых в раствор ионов Н+ и ОН- в результате реакции этих ионов и компонентов буферной системы с образованием малодиссоциированных продуктов. Буферное действие сохраняется в определенном интервале значений рН. Рабочий участок буферной системы, т.е. способность противодействовать изменению рН при добавлении кислот и щелочей, имеет протяженность одну единицу рН с каждой стороны. Вне этого интервала буферная емкость быстро падает до 0. Интервал рН = рК ± 1 называетсязоной буферного действия. Таким образом, на основе кислоты, имеющей определенное значение рК, можно приготовить буферные растворы, поддерживающие значение рН в диапазоне от рК – 1 до рК + 1. Где рК = –lgК. рН буферной системы рассчитывают по уравнению Гендерсона-Гассельбаха: pH = pKa + lg[соль]/[кислота] - для кислотного буфера; pH = 14 - pKb - lg[соль]/[основание] - для основного буфера. Способность буферной системы противодействовать смещению реакции среды измеряется буферной ёмкостью. Буферную ёмкость выражают количеством моль-эквивалентов сильной кислоты или основания, которое следует добавить к одному литру буферного раствора, чтобы сместить на единицу: B = nэ/|pH1-pH2|⋅Vб.р., где: B - буферная ёмкость; nэ - количество моль-эквивалентов кислоты или щёлочи; pH1 - водородный показатель до добавления сильной кислоты или щёлочи; pH2 - водородный показатель после добавления сильной кислоты или щёлочи. Кислотно-основный гомеоста В процессах обмена веществ in vivo образуется большое количество кислых продуктов. Сохранение постоянства кислотности биологических сред организмов обеспечивается наличием в них буферных систем, обладающих превалирующим буферным действием по кислоте. Таким образом организм освобождается от избытка кислоты; накапливающиеся соли и вода удаляются с мочой и потом, а убыль бикарбоната пополняется в процессе тканевого дыхания. Основания также связываются буферами крови и выделяются с мочой в виде, главным образом, одно- и двухзамещённых фосфатов. Различают общую, активную и потенциальную кислотности: Общая кислотность соответствует максимально возможной концентрации ионов Н+ в данном растворе, если теоретически предположить, что все имеющиеся в нем молекулы кислоты полностью распадутся на ионы, а гидролиз имеющейся соли можно не учитывать. Общая кислотность численно равна молярной концентрации химического эквивалента кислоты в растворе и определяется опытным путем (например, с помощью титриметрического метода анализа); Активная кислотность равна концентрации (или активности) содержащихся «свободных» ионов Н+ (Н3О+), образовавшихся в результате диссоциации некоторого количества молекул кислоты; Потенциальная кислотность определяется совокупностью присутствующих в системе недиссоциированных молекул кислоты. Потенциальная кислотность может быть вычислена вычитанием из общей кислотности активной. Кислотно-щелочное состояние внутренней среды принято характеризовать по содержанию в ней количества водородных ионов, зависящего от поступления и выделения, т.е. баланса. В этой связи выделяют две формы сдвига кислотно-щелочного состояния: ацидоз и алкалоз. Ацидоз — это сдвиг кислотно-щелочного состояния в связи с положительным балансом водородных ионов, т.е. при накоплении Н-ионов в крови. Алкалоз — это сдвиг кислотно-щелочного состояния в связи с отрицательным балансом водородных ионов, т.е. при уменьшении Н-ионов в крови. Концентрация водородных ионов определяется: Во-первых, [Н2СО3] или РCO2, выводимого в большей или меньшей степени через легкие, что позволяет называть числитель формулы — дыхательной или респираторной компонентой. Во-вторых, -содержание Н-ионов определяется концентрацией бикарбоната (НСО3 ), не выделяемого через легкие, что дает основание называть знаменатель формулы — недыхательной или нереспираторной компонентой. Иногда эту компоненту называют метаболической, но это не совсем верно, т.к. сдвиг уровня бикарбоната в крови происходит не только при изменениях метаболизма, но и при изменениях выделения через почки, желудочно-кишечный тракт или поступлении в организм извне. Таким образом, как ацидозы, так и алкалозы можно представить в двух видах: Дыхательные или респираторные ацидозы и алкалозы; Недыхателъные или нереспираторные ацидозы и алкалозы. Дыхательный ацидоз у здоровых людей может возникать при длительном пребывании в среде с повышенным содержанием углекислого газа, например, в замкнутых помещениях малого объема, шахтах, подводных лодках. Недыхательный ацидоз у здоровых людей бывает при длительном употреблении кислой пищи, углеводном голодании, усиленной мышечной работе, особенно у нетренированных людей. Дыхательный алкалоз формируется у здоровых людей при нахождении в условиях сниженного атмосферного давления и, соответственно, парциального давления СО2, например, при пребывании высоко в горах, полетах в негерметизированных летательных аппаратах. Гипервентиляция легких также способствует потере двуокиси углерода и дыхательному алкалозу. Недыхательный алкалоз развивается у здоровых людей при длительном приеме щелочной пищи или минеральной воды типа «Боржоми». 20)Буферные системы крови: гидрокарбонатная, фосфатная, гемоглобиновая, протеиновая. Понятие о кислотно-основном состоянии организма. Применение реакции нейтрализации в фармакотерапии: лекарственные средства с кислотными и основными свойствами. Основными буферными системами человеческого организма являются: гидрокарбонатная (бикарбонатная), фосфатная, гемоглобиновая, белковая (протеиновая): Гидрокарбонатная. Одна из самых мощных и вместе с тем самая управляемая система[2] внеклеточной жидкости и крови, на долю которой приходится около 53 % всей буферной ёмкости крови. Представляет собой сопряжённую кислотно-основную пару, состоящую из молекулы угольной кислоты H2CO3, являющейся источником протона, и бикарбонат-аниона HCO3−, выполняющего роль акцептора протона. Фосфатная. В крови ёмкость фосфатной буферной системы невелика (составляет около 2% общей буферной ёмкости), в связи с низким содержанием фосфатов в крови. Фосфатный буфер выполняет значительную роль в поддержании физиологических значений рН во внутриклеточных жидкостях и моче. Буфер образован неорганическими фосфатами. Роль кислоты в этой системе выполняет однозамещённый фосфат (NaH2PО4), а роль сопряженного основания — двузамещённый фосфат (Na2HPО4). Гемоглобиновая. Занимает второе место после бикарбонатной буферной системы (35% буферной ёмкости).Играет важную роль как в процессе дыхания(транспортная функция по переносу кислорода к тканям и органам и удалению из них метаболической CO2), так и в поддержании постоянства pH внутри эритроцитов, а в результате и в крови в целом. Белковая (протеиновая). В сравнении с другими буферными системами имеет меньшее значение для поддержания кислотно-основного равновесия.( 7-10% буферной ёмкости). Белки плазмы крови благодаря наличию кислотно-основных групп в молекулах белков (белок—H+ — кислота, источник протонов и белок — сопряжённое основание, акцептор протонов) образуют буферную систему, наиболее эффективную в диапазоне pH 7,2—7,4. Кислотно-основное состояние (КОС) — один из весьма важных компонентов гомеостаза организма, непременное условие оптимальной активности ферментов-катализаторов обменных процессов. В процессе обмена веществ образуются различные кислоты и основания, кроме того они вводятся извне. Расстройства различных органов могут привести к нарушению КОС, что в свою очередь вызывает различные патологические сдвиги в организме. Поэтому необходимо знать механизмы физиологической регуляции и нарушений КОС, уметь оценить их состояние и правильно проводить профилактику и коррекцию нарушений. Для проведения коррекции кислотно-основного состояния необходимо выявить, какое звено в его регулировке нарушено. Для этого необходимо определить значения рН биологических жидкостей и содержание буферных оснований. В основе фармакологических действий лежит реакция нейтрализации. Например, в качестве экстренной меры при ацидозе применяется внутривенное вливание раствора гидрокарбоната натрия 4,5%, а в острых случаях – 8,4%. Второе эффективное средство – трисамин 3,66%, который связывает избыточные протоны. Он эффективен только при внутривенном введении. Также в качестве средства, коррегирующего ацидоз, используют лактат натрия 11% раствор. Для устранения явления алкалоза в некоторых случаях используют раствор аскорбиновой кислоты 5%. В гастроэнтерологии применяют средства, нормализующие секреторную функцию желудка. При пониженной кислотности желудочного сока назначают разбавленную соляную кислоту, при повышенной кислотности – различные антацидные препараты: оксид магния, основной карбонат магния, карбонат кальция, гидрокарбонат натрия. 21)Гетерогенные реакции в растворах электролитов. Константа растворимости. Условия образования и растворения осадков. Гетерогенныминазываются системы, которые состоят из гомогенных частей, на границе которых свойства характеризуются разрывами непрерывности. Гетерогенная система состоит из нескольких фаз. Под фазой понимается совокупность гомогенных ограниченных поверхностями раздела частей системы, термодинамические свойства которых одинаково зависят от параметров состояния. Многие биологические процессы связаны с растворением или образованием малорастворимых ионных соединений, преимущественно солей. Формирование неорганического вещества костной ткани, образование почечных камней, регуляция концентрации ионов кальция в плазме и многие другие процессы объясняются теорией гетерогенных равновесий в растворах электролитов. Ks - константа равновесия взаимодействия малорастворимого вещества ионного типа с водой, при котором часть ионов переходит в жидкую фазу. Константа растворимости – константа равновесия процесса, описанного выше. Ks=Mx*Ay, где: Mx - металл с коэффициентом х, Ay - анион с коэффициентом y. Условия образования/растворения в системе осадка: Пс > Кs - пересыщенный раствор, осадок выпадает. Пс < Ks - раствор ненасыщенный, осадок в системе не образуется или происходит частичное растворение осадка. Пс = Ks - в системе имеется равновесие (раствор насыщенный). 22)Реакции, лежащие в основе образования неорганического вещества костной ткани гидроксидфосфата кальция. Механизм функционирования кальций-фосфатного буфера. Явления изоморфизма: замещение в гидрофосфате кальция гидроксид-ионов на ионы фтора, ионов кальция на ионы стронция. Остеотропность металлов. Реакции, лежащие в основе образования конкрементов: уратов , оксалатов, карбонатов. В организме человека образование костной ткани это наиболее важный гетерогенный процесс с участием неорганических соединений. Основным минеральным компонентом костной ткани является гидроксифосфат кальция Ca5(PO4)3OH. Часть ионов Ca2+ замещена ионами Mg2+, а очень незначительная часть ионов OH– замещена ионами фтора, которые повышают прочность кости. Образование Ca5(PO4)3OH из слабощелочных растворов в опытах «in vitro» можно объяснить следующим образом. Известно, что при физиологическом значении рН крови в системе сосуществуют ионы: НРО42- и Н2РО4-. Сопоставление значений констант растворимости Ks (СаНPO4) = 2,7×10–7 и Ks Ca(Н2PO4)2= 1×10–3, указывает на то, что в первую очередь в присутствии ионов Ca2+ образуется осадок CaHPO4: Ca2+ + НРО42- ⇄ CaHPO4 Затем образующееся соединение претерпевает следующие изменения: 3CaHPO4 + 2OH– + Ca2+ ⇄ Ca4Н(PO4)3 + 2H2O Са3(РО4)2×СаНРО4 Ca4H(PO4)3 + 2OH– + Ca2+⇄ Ca5(PO4)3ОН + Н2О Растворимость в ряду CaHPO4→Ca4H(PO4)3→Ca5(PO4)3OH постоянно понижается, что и способствует образованию последнего соединения: Ks Са3(РО4)2 = 2×10–29, Ks Са5(РО4)3ОН = 1,6×10–58 В плазме крови концентрация ионов кальция составляет 0,0025М, а фосфатов – 0,001М. В плазме только половина кальция находится в ионизированном состоянии, другая половина связана с белками. Если учесть, что при рН=7,4 только 30% фосфатов находится в форме НРО42-и 70% в форме Н2РО4-, то легко можно вычислить, что произведение концентраций ионов Са2+ и НРО42- в плазме крови практически совпадает с величиной Ks (CaHPO4). Иными словами, плазма крови представляет собой почти насыщенный раствор гидрофосфата кальция (CaHPO4), который находится в динамическом равновесии с неорганическими составными частями костной ткани. Если произведение концентраций ионов Са2+ и НРО42- в крови повышается, то происходит обызвествление, если оно понижается, то уменьшается содержание неорганических компонентов в костях. Клетки костной ткани могут легко ускорять либо отложение либо растворение минеральных компонентов при локальных изменениях рН, концентрации ионов Са2+ или НРО42- и комплексообразующих соединений. Так, при увеличении концентрации ионов Са2+ в плазме крови наблюдается сдвиг равновесия, приводящий котложению кальция в костной ткани. Наоборот, снижение концентрации ионов Са2+ в плазме кровитакже вызывает сдвиг равновесия, но сопровождающийся уже растворением минеральных компонентов костной ткани. Например, при рахите из-за недостаточности всасывания ионов Са2+ из желудочно-кишечного тракта концентрация ионов Са2+ в плазме крови поддерживается постоянной за счет мобилизации (высвобождения) ионов Са2+ из неорганических компонентов костей. Благодаря такому явлению, как изоморфизм (замены в кристаллической решетке минерала одних химических элементов другими), вместе с кальциевыми солями могут осаждаться в костной ткани соли и других катионов, близких по своим свойствам иону кальция: бериллия, стронция, бария. Для явления изоморфизма необходимы следующие условия: Ионные радиусы изоморфно замещающихся элементов должны быть близки. Близость химических свойств элементов, замещающих друг друга. Сохранение электронейтральности кристаллической структуры минерала. Конкременты — камни, плотные образования, встречающиеся в полостных органах и выводных протоках желёз человека. Могут быть разной величины, формы и консистенции. Механизм образования камней весьма сложен и связан с потерей коллоидной системой (кровь) устойчивости, сопровождающейся коагуляцией взвешенных частиц твёрдой фазы. Различные виды заболеваний связаны с образованием различных солей: Ураты - соли мочевой кислоты, накапливаются в крови при некоторых болезнях, например при подагре, нефритах, лейкемиях; могут откладываться в тканях. Оксалаты (от греч. oxalís — щавель), кислые и средние соли щавелевой кислоты, например HOOC—COOK, NaOOC—COONa. Карбонаты - соли и эфиры угольной кислоты Н2СО3. Различают нормальные (средние) соли с анионом CO32- (напр., К2СО3) и кислые (гидрокарбонаты) с анионом НСО3- (напр., КНСО3). 23)Реакция замещения лигандов. Константа нестойкости комплексного иона. Конкуренция за лиганд или за комплексообразователь. Представления о строении металлоферментов и других биокомплексных соединений (гемоглобин, цитохромы, кобаламины). Реакции замещения лигандов по своему характеру нуклеофильные, так как замещаемый лиганд уносит электронную пару, ранее образовывавшую σ-связь металл-лиганд, а замещающий лиганд приносит пару электронов и поэтому занимает положение с низкой электронной плотностью. По аналогии с органическими соединениями эти процессы обозначаются как SN-процессы (нуклеофильное замещение). Константы нестойкости комплексных ионов являются мерой их относительной устойчивости, подобно тому как константы диссоциации слабых электролитов являются мерой их относительной силы. Чем меньше константа нестойкости, тем прочнее комплекс. Константы нестойкости позволяют прогнозировать направление процессов комплексообразования. Константа нестойкости (Кн) - это отношение равновесных концентраций ионов, образующихся при диссоциации комплексного иона, к равновесной концентрации самого комплексного иона в степени коэффициентов гомогенного равновесия. Константа устойчивости: Ку = 1/Кнест Если в системе несколько лигандов с одним ионом металла или несколько ионов металла с одним лигандом способных к образованию комплексных соединений, то наблюдаются конкурирующие процессы: в первом случае лигандообменное равновесие - конкуренция между лигандами за ион металла, во втором случае металлообменное равновесие - конкуренция между ионами металла за лиганд. Преобладающим будет процесс образования наиболее прочного комплекса. Гемоглобин - дыхательный пигмент, придающий крови красный цвет. Гемоглобин состоит из белка и железопорфирина и переносит кислород от органов дыхания к тканям тела и углекислый газ от них к дыхательным органам. Цитохромы - сложные белки (гемопротеиды), осуществляющие в живых клетках ступенчатый перенос электронов и/или водорода от окисляемых органических веществ к молекулярному кислороду. При этом образуется богатое энергией соединение АТФ. Кобаламины - природные биологически активные кобальторганические соединения. Структурной основой К. является корриновое кольцо, состоящее из 4 пиррольных ядер, у которых атомы азота связаны с центральным атомом кобальта. 24 Окислители и восстановители. Сопряжённые редокс-системы. ОВР- химические процессы, сопровождающиеся переносом электронов от одних молекул к другим, протекающие с изменением степени окисления атомов элементов, входящих в состав реагирующих веществ Окисление– потеря электрона Восстановление– присоединение электрона Восстановители (Red)– отдают электрон. Малую СО. ОЭО<1,5 Окислители (Ox)– присоединяют е. Большая СО. ОЭО>3.0 Степень окисления (СО)– формальный заряд атома. Редокс-системы второго типа, в которых переносeсопровождается переносом Н+. В них наблюдается совмещённое редокс-протолитическое равновесие. Для расчёта их RTa(Ox) редокс-потенциала: φ = φ0 + nF ln a(Red) am(H+) RTa(Ox) φ = φ0+nFlna(Red)уравнение Нернстадля редокс-потенциала(когда и окислитель и восстановитель находятся в растворённом состоянии). RT φ = φ0+nFlnai–уравнение Нернста для электродного потенциала(на границе раздела металл-раствор) Межмолекулярные редокс-реакции. Атом-окислитель и атом-восстановитель находятся в составе разных реагентов 2KNO2+ 2KI + 2H2SO42NO + I2+ 2K2SO4+ 2H2O Диспропорционирования– одна часть атомов одного и того же вещества выступает в роли окислителя, а друга (в той же степени окисления) – в роли восстановителя 2NO2 + 2OH-NO2-+NO3-+ H2O Внутримлекулярного окисления-восстановления- атом-окислитель и атом-восстановитель находятся в составе одной формульной единице: 2KClO33O2+ 2KCl 25) Физико-химические принципы транспорта кислорода гемоглобином. Металло-лигандный гомеостаз и причины его нарушения. Механизм токсического действия тяжёлых металлов и мышьяка на основе теории жёстких и мягких кислот и оснований (ЖМКО). Термодинамические принципы хелатотерапии. Механизм цитотоксического действия соединений платины. Если в системе несколько лигандов с одним ионом металла или несколько ионов металла с одним лигандом способных к образованию комплексных соединений, то наблюдаются конкурирующие процессы: в первом случае лигандообменное равновесие - конкуренция между лигандами за ион металла, во втором случае металлообменное равновесие - конкуренция между ионами металла за лиганд. Преобладающим будет процесс образования наиболее прочного комплекса. Нарушения металлолигандного гомеостазавызывают нарушения процесса обмена веществ, ингибируют активность ферментов, разрушают важные метаболиты, такие как АТФ, клеточные мембраны, нарушают градиент концентрации ионов в клетках. Поэтому создаются искусственные системы защиты. Должное место в этом методе занимает хелатотерапия (комплексонотерапия). Хелатотерапия– это выведение токсичных частиц из организма, основанное на хелатировании их комплексонатами s–элементов. С практическими целями часто пользуются величиной, обратной константе устойчивости -константой нестойкостиКн: где β- константа устойчивости. Чем меньше константа нестойкости, тем прочнее комплекс. Константы нестойкости позволяют прогнозировать направление процессов комплексообразования. Основные термодинамические принципы хелатотерапии можно сформулировать в двух положениях. 1. Детоксикант (Lg): должен эффективно связывать ионы токсиканты (Мт, Lт), вновь образующиеся соединения (МтLg),должны быть прочнее, чем те, которые существовали в организме. Ку(МтLg) > Ку (МбLт), Ку(МбLтLg) > Ку (МбLт), где Ку – константа устойчивости; 2. Детоксикант не должен разрушать жизненно необходимые комплексные соединения (МбLб); соединения, которые могут образовываться при взаимодействии детоксиканта и ионов биометаллов (MбLq), должны быть менее прочными, чем существующие в организме. Гемоглобин- дыхательный пигмент, придающий крови красный цвет. Гемоглобин состоит из белка и железопорфирина и переносит кислород от органов дыхания к тканям тела и углекислый газ от них к дыхательным органам. Цитохромы- сложные белки (гемопротеиды), осуществляющие в живых клетках ступенчатый перенос электронов и/или водорода от окисляемых органических веществ к молекулярному кислороду. При этом образуется богатое энергией соединение АТФ. Кобаламины- природные биологически активные кобальторганические соединения. Структурной основой К. является корриновое кольцо, состоящее из 4 пиррольных ядер, у которых атомы азота связаны с центральным атомом кобальта. Физико-химические принципы транспорта кислорода гемоглобином- Атом (Fe (II)) (один из компонентов гемоглобина) способен образовывать 6 координационных связей. Из них четыре используются для закрепления самого атома Fe(II) в геме, пятая связь - для связывания гема с белковой субъединицей, а с помощью шестой связи происходит связывание молекулы О2или СО2. Реакция, лежащая в основе переноса кислорода гемоглобином. HHb+ + O2 <=> HbO2 + H+ Токсичность солей тяжелых металлов. Хорошо известно, что загрязнение окружающей среды соединениями токсичных элементов — тяжелых металлов: ртути, свинца, кадмия, хрома, никеля — может приводить к отравлениям. Ядовитость или токсичность таких соединений во многих случаях объясняется взаимодействием катионов тяжелых металлов Мт с бионеорганическими комплексами. Реакция, описывающая это взаимодействие, может быть записана в виде Здесь MбL— комплекс иона биогенного металла Мб (Fe,Zn, Сu, Со) с биоорганическим лигандомL(например, порфирином); Мт— ион тяжелого металла. 26 Окислительно-восстановительные (редокс) реакции. Механизм возникновения электродного и редокс-потенциалов. Уравнения Нернста-Петерса. Сравнительная сила окислителей и восстановителей. Прогнозирование направления редокс-процессов по величинам редокс-потенциалов. Константа окислительно-восстановительного процесса. ОВР- химические процессы, сопровождающиеся переносом электронов от одних молекул к другим, протекающие с изменением степени окисления атомов элементов, входящих в состав реагирующих веществ Окисление– потеряe Восстановление– присоединение е Восстановители (Red)– отдаютe. Малую СО. ОЭО<1,5 Окислители (Ox)– присоединяют е. Большая СО. ОЭО>3.0 Степень окисления (СО)– формальный заряд атома. Редокс-системы второго типа, в которых переносeсопровождается переносом Н+. В них наблюдается совмещённое редокс-протолитическое равновесие. Для расчёта их RTa(Ox) редокс-потенциала: φ = φ0 + nF ln a(Red) am(H+) RTa(Ox) φ = φ0+nFlna(Red)уравнение Нернстадля редокс-потенциала(когда и окислитель и восстановитель находятся в растворённом состоянии). RT φ = φ0+nFlnai–уравнение Нернста для электродного потенциала(на границе раздела металл-раствор) Межмолекулярные редокс-реакции. Атом-окислитель и атом-восстановитель находятся в составе разных реагентов 2KNO2+ 2KI + 2H2SO42NO + I2+ 2K2SO4+ 2H2O Диспропорционирования– одна часть атомов одного и того же вещества выступает в роли окислителя, а друга (в той же степени окисления) – в роли восстановителя 2NO2 + 2OH-NO2-+NO3-+ H2O Внутримлекулярного окисления-восстановления- атом-окислитель и атом-восстановитель находятся в составе одной формульной единице: 2KClO33O2+ 2KCl 27 Изменение электродных потенциалов. Электроды сравнения и индикаторные электроды. Потенциометрическое титрование. Ионоселективные электроды, их использование в медицине. Потенциометрией называют совокупность физико-химических методов исследования, в основе которых лежит измерение электродвижущей силы цепей, составленных из индикаторного электрода и электрода сравнения. Потенциометрические методы основаны на определении концентрации физиологич. активных ионов (Na,Ca,Cl,Br), измерении потенциалов электродов, явл-щихся функцией активности ионов в растворе. Поскольку измерить абсолютное значение потенциала отдельно взятого электрода невозможно, для практических целей измеряют разницу между потенциалом измерительного электрода, который зависит от активности определяемого электрода, и электрода сравнения, потенциал которого известен и постоянен. Наиб. употребимые электроды -каломельный и хлорсеребряный. Основная задача– правильный выбор измерительного электрода, который отражает св-ва раствора. По механизму возникновения различают ионно-металлические электроды, редокс электроды, мембранные электроды. Ионно-металлическийэлектрод, представляющий собой металл, опущенный в раствор соли этого металла, функционирует какэлектродпервого рода, если его потенциал зависит от активности катиона в раствора. Если же металлический электрод покрыт электролитически нанесенным слоем малорастворимой соли этого металла, то он функционирует как электродвторого рода,т.к. отражает активность аниона, образующего эту малорастворимую соль. В силу многих причин не все металлы могут быть использованы для изготовления электродов, измеряющих активность их катионов. В атом случае часто используются мембранные электроды, способные давать потенциалы, зависящие от активности ограниченного числа ионов, а в некоторых случаях - только одного типа ионов. Такие электроды называют ионоселективными электродами. Примером ионоселективного электрода является стеклянный электрод, потенциал которого зависит от активности ионов Н3О+. Силикат натрия, входящий в состав стеклянной мембраны подвергается гидролизу до кремниевой кислоты. Протоны, возникающие при диссоциации кремниевой кислоты, способны к обмену о катионами, содержащимися в растворе, контактирующем с мембраной .При низких значениях рН, т.е. при большой концентрации ионов Н3О+, они переходят в состав мембраны, в результате чего возникает скачок потенциала на границе раздела стекло-раствор. При высоких значениях рН ионы Н3О+наоборот переходят в раствор. Потенциометрическое титрование– имеет ряд преимуществ: возможность титрования мутных и окрашенных биологич. жидкостей, легкость автоматизации анализа. |
