1 Схема Структурные компоненты бактериальной клетки Обязательные
 Скачать 4.86 Mb. Скачать 4.86 Mb.
|
|
1.47. Схема «Репарация ДНК» 1 - схема темновой репарации ДНК 2 - двойная ДНК с тиминовым димером, сформировавшимся при повреждении У Ф-светом 3 - восстановление разрушенного участка ДНК с помощью экндо- и экзонуклеаз 4 - этапы темновой репарации ДНК: участок ДНК с тиминовым димером (1); разрезание повреждённой нити ДНК эндонуклеазой (2), удаление тиминового димера и прилежащей части ДНК экзонуклеазой - эксцизия (3), ресинтез удаленного участка ДНК зашивание однонитевого разрыва ДНК с помощью ДНК-лигазы 5 - восстановление генофонда хромосом, увеличение продолжительности «жизни» ДНК  1.48. Схема «Трансформация у бактерий» 1 - схема трансформации с включением в хромосому клетки реципиента фрагмента одноцепочечной ДНК донора 2 - фрагмент ДНК донора, ДНК реципиента 3 - приобретение новых генотипических признаков клеткой реципиент 4 - трансформация включает следующие этапы: адсорбция выделившийся трансформирующей ДНК из клетки донора на рецепторах бактерии - реципиента Выделение ДНК из клетки донора может происходить в результате разрушения бактерий во внешней среде под действием различных химических и физических факторов, а также их аутолиза (1), разрезание двунитевой молекулы ДНК, адсорбированной на поверхности бактерий, ферментом эндонуклеазой на отдельные двунитевые фрагменты (2), на поверхности бактерий экзонуклеаза вызывает деградацию одной из нитей двунитевых фрагментов трансформирующей ДНК; в результате формируются однонитевые отрезки ДНК (3), синтез белка-лоцмана, который соединяется с однонитевыми фрагментами трансформирующей ДНК. На поверхности бактерий существует электрическое поле. Учитывая это белок-лоцман можно рассматривать в качестве ротора, а белки мембраны как статор. Под действием потока ионов Н* через статор происходит вращение ротора и продвижение в цитоплазму бактерий вместе с трансформирующей ДНК (4). Далее происходит интеграция поступившего в цитоплазму трансформирующего однонитевого фрагмента ДНК в образовавшуюся в одной из нитей ДНК реципиента брешь, которая возникает в результате удаления аллельного гена. Затем происходит репликация ДНК и формирование клона рекомбинантных бактерий (5). 5 - передача генов резистентности к антибиотикам, кодирующих синтез ферментов, факторов вирулентности 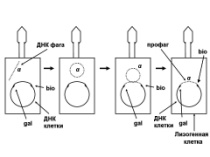 1.49. Схема «Лизогенная конверсия у бактерий» 1 - интеграция ДНК фага лямда в бактериальную ДНК и формирование лизогенной бактерии (лизогенная конверсия) 2 - умеренный бактериофаг, бактериальная клетка, процесс лизогении 3 - репродукция умеренного бактериофага в бактериальной клетке с привнесением в бактерии новой генетической информации (на модели фага лямбда и его хозяина -кишечной палочки; перенос гена, кодирующего биосинтез биотина) 4 - этапы специфической трансдукции: умеренный фаг впрыскивает ДНК в цитоплазму бактерии, где она принимает кольцевую структуру, которая накладывается на ДНК бактерии между генами gal (ген, отвечающий за утилизацию галактозы в клетке) и bio (ген, кодирующий синтез биотина в бактерии). Именно в этом месте находится специфический участок бактериальной хромосомы, который спаривается с участком фага, затем нуклеазы клетки разрезают обе ДНК, т.е. Имеет место их разрыв, и далее происходит перекрестное воссоединение свободных концов обеих нуклеиновых кислот, В результате ДНК фага включается в ДНК бактерий между генами gal и bio. Включенная ДНК фага в ДНК бактерии называется профаг. Клетка, имеющая профаг, называется лизогенной бактерией. При делении бактериальных клеток профаг передается дочерним по наследству. Такая наследственная передача профага может быть неограниченно долгой. Возникающее лизогенное состояние бактерий (лизогения) представляет собой интегративную форму инфекции. 5 - присутствие профага в ДНК бактерий приводит к появлению у них новых свойств. Приобретение лизогенными бактериями новых свойств называется лизогенной конверсией (превращением). 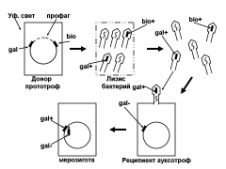 1.50. Схема «Трансдукции у бактерий» 1 - механизм специфической трансдукции на модели умеренного фага лямбда и его хозяин кишечная палочка. Донорные лизогенные бактерии облучаются УФ-светом, чтобы разрушить белок репрессор, удерживающий профаг в составе ДНК донора. В результате ликвидации белка репрессора происходит выход профага в цитоплазму и начинается продуктивный цикл его развития. 2 - профаг в бактериальной клетке и процессы перехода к продуктивной инфекции под действием ультрафиалетового облучения 3 - приобретение новых генотипических свойств в результате лизогенной специфической трансдукции трансдуцирующим фагом лямда 4 - профаг лямбда включен на хромосоме кишечной палочки между генами gal (отвечающим за утилизацию галактозы) и bio (контролирующем синтез биотина), т.е. Эти гены соприкасаются с концами профага. При выходе профага из состава ДНК донора в него в результате рекомбинации может включиться либо ген gal, либо ген bio. Трансдуцирующий бактериофаг может перенести в клетку реципиент только один из указанных генов. В случае если необходимо перенести из клетки донора (клетка дикого типа, т.е. Все гены работающие), ген gal, то в качестве реципиента используют бактерии, в которых имеется мутировавший галактозный ген gal". Трансдуцирующий бактериофаг переносит gal ген в цитоплазму реципиента. При этом он не замещает свой аллель gal", а прикрепляется рядом. Образуется мерозигота. Так как ген gal* является доминантным, то образовавшаяся частично диплоидная клетка (gal* / gal") будет утилизировать галактозу 5 - приобретение трансдуцирующего фага бактериями реципиентами приводит к появлению у них новых генов и новых фенотипических признаков (свойств) 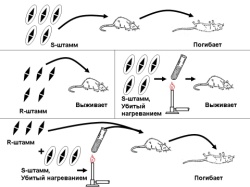 1.51. Схема «Трансформация у бактерий. Опыты Гриффита» 1 - открытие явления трансформации - передачи генетической информации из разрушенных бактерий-доноров в виде неповрежденной молекулы ДНК в клетки реципиенты 2 - варианты опытов Грифита на модели пневмококковой инфекции у белых мышей; представлены высоковирулентные пневмококки (клетки образуют полисахаридную капсулу, колонии блестящие, гладкие, т.е. Находятся в S форме (от английского слова smooth - гладкий) и авирулентные (не имеют капсулы, их колонии шероховатые (от английского слова rought - шероховатый) 3 - включение фрагмента ДНК разрушенной клетки донора в живую клетку реципиент с приобретением последней новых признаков 4 - Опыт Гриффита заключался в следующем. Для заражения он использовал 4 партии мышей. Опытная партия была инфицирована смесью убитых нагреванием пневмококков в S форме с живыми бактериями в R форме. Контрольные группы мышей заражали следующим образом: одной группе вводили живых в S форме пневмококков другой -убитых нагреванием пневмококков в S форме, третьей - живых в R форме бактерий. При учете полученных данных в контрольных экспериментах были отмечены ожидаемые результаты, т.е. Мыши погибли при заражении их только живыми в S форме пневмококками, а две другие контрольные группы остались живыми. Мыши, входившие в состав опытной группы, т.елараженные смесью убитых нагреванием пневмококков в S форме и живых бактерий в R форме погибли. Гриффит выделил из погибших мышей возбудителя. Это были живые пневмококки - в S форме. Они образовывали капсулу. Таким образом, под влиянием убитых вирулентных пневмококков у R мутанта восстановилась способность формировать капсулу, утраченную в результате мутации, т.е.они стали вирулентными. Явление трансформации было продемонстрировано также in vitro (в пробирке) при размножении R - мутанта в присутствии убитых нагреванием пневмококков в S форме. Трансформация происходила и в тех случаях, когда к размножившейся культуре пневмококков в R форме добавляли бесклеточный экстракт из Бактерий. Работа Гриффита заложила краеугольный камень в развитие молекулярной генетики и молекулярной биологии. В 1944 году Эйвери, Мак-Карти и Мак-Леод установили, что трансформирующим началом, обеспечивающим превращение пневмококков из R формы в вирулентную S форму является ДНК. 5 - Открытие явления трансформации продемонстрировало, что наследственная информация закодирована в молекуле ДНК, а не в белке, как считали ранее. В последствии было показано наличие трансформации и у других видов бактерий. |
