шпаргалка по охт. 1. Технологические показатели и их роль в управлении технологическим процессом
 Скачать 0.82 Mb. Скачать 0.82 Mb.
|
|
28.Конверсия и селективность – общее и различие. Оценка эффективности процесса в целом осуществляется прежде всего по экономическим показателям: себестоимость целевого продукта, приведенные затраты и пр. Но для оценки отдельных стадий процесса необходимы показатели, отражающие химическую и физико-химическую сущность явлений, идущих в аппаратах. Технологический показатель, отражающий степень использования (долю) исходного реагента на химические превращения (конверсия): 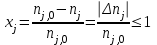 , при этом , при этом 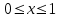 , ,где n0 – начальное количество реагента; n – конечное количество реагента. При условии постоянства объема реакционной смеси, количество превращающегося реагента можно заменить его концентрацией. Например, по: 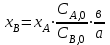 . .Полная селективность (избирательность или полезная конверсия) – это отношение количества исходного реагента, расходуемого на целевую реакцию, к общему количеству исходного реагента, пошедшего на все реакции (и целевые и побочные), или
29.Принципы построения ХТС. Любое химическое производство представляет собой совокупность трех основных операций: подготовка сырья;превращение (химическое или физико-химическое) сырья;выделение целевых продуктов.Эти операции осуществляются в десятках и сотнях разнообразных аппаратов и устройств, связанных между собой различными потоками. Функциональные подсистемы (функции производства): технологическая (переработка сырья в целевой продукт); энергетическая (обеспечение энергией производства); управляющая (автоматизированная система управлений технологическим процессом - АСУТП). Масштабные подсистемы – определенные функции в последовательности процессов переработки сырья в целевой продукт, которые комментируются рисунком. 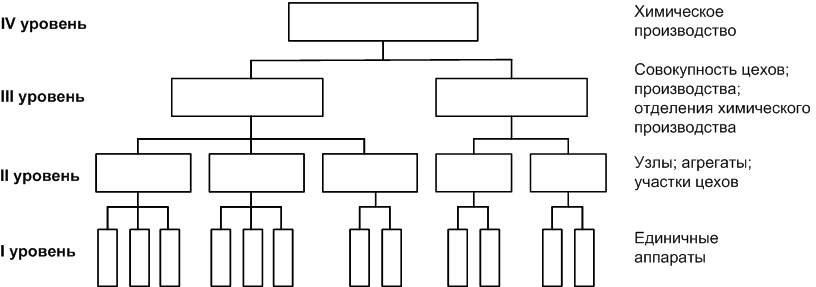 В структуре ХТС минимальный элемент – отдельный аппарат (реактор, кристаллизатор, колонна, печь и пр.) – I уровень. Объединенные в конкретной технологической операции ряд аппаратов (основных и вспомогательных) образуют узел, агрегат, участок цеха (узел кристаллизации, блок очистки и пр.), которые представляют II уровень ХТС в масштабе производства. Совокупность подсистем второго уровня образует подсистему III уровня (цех, отделение производства, участок производства или производство). Объединение подсистем третьего уровня может образовывать производства (производство олефинов, производство волокон и пр.), т.е. IV уровень ХТС. Приведенное выделение подсистем условно, т.к. химические производства отличаются по структуре. Но установленная иерархия в конкретном производстве позволяет наиболее точно и оперативно проводить анализ ХТС и управлять внутренними процессами не только по вертикали, но и по горизонтали иерархической схемы. Материальные потоки (по трубопроводам, транспортерам, подъемникам и пр. механическим устройствам); энергетические потоки (по трубопроводам - пар, горячая вода, горючие газы и пр.; электроэнергия – провода, силовые кабели);информационные потоки.ХТП –это сложная система, состоящая из единичных связанных между собой процессов и взаимодействующая с окружающей средой. Элементами ХТС являются процессы тепло- и массообмена, гидромеханические, химические и т.д. 30.Стадии гетерогенного катализа. Пример производственного процесса. В гетерогенных системах каталитическая реакция идет на поверхности раздела фаз. Ускорение реакции зависит от количества катализатора, но и от величины его поверхности, а также от того, с какой скоростью происходит смена молекул, входящих в соприкосновение с этой поверхностью, т.е. от скорости диффузии реагентов и продуктов реакции. На практике наиболее часто осуществляется гетерогенный катализ двух типов:процессы, в которых катализатор находится в твердой фазе, а реагирующие вещества в жидкой;процессы, в которых катализатор находится в твердой фазе а реагирующие вещества в газовой. Гетерогенный катализ является сложным многостадийным процессом, каждая стадия которого имеет свою скорость. Весь процесс можно разделить на пять стадий: 1) диффузия реагирующих веществ к поверхности катализатора; 2) адсорбция на адсорбционных центрах; 3) химическая реакция на поверхности; 4) десорбция продуктов реакции с поверхности; 5) диффузия продуктов реакции в объем раствора или газа. Лимитирующей стадией гетерогенного катализа 2-го типа может быть любая из перечисленных стадий. Адсорбция молекул реагентов на поверхности катализатора – стадия, имеющая характер химического взаимодействия. Необходимо различать адсорбцию двух видов – физическую, обратимую, идущую за счет взаимного притяжения молекул (сил Ван-дер-Ваальса), и активированную, или хемосорбцию, идущую за счет химических валентных сил. Физическая адсорбция сопровождается образованием на поверхности твердого тела многослойной молекулярной пленки, которая находится в равновесии с газовой фазой. Повышение температуры вызывает снижение скорости адсорбции и усиление десорбции молекул. Скорость хемосорбции растет с повышением температуры до определенного предела. Свободные химические связи на поверхности катализатора распределены неравномерно, поэтому молекулы реагирующих веществ адсорбируются не всей поверхностью, а лишь отдельными участками катализатора – активными центрами. 31.Методы управления скоростью химической реакции. Скорость реакции зависит от условий ее протекания, главным образом, от температуры и концентрации (парциальных давлений) компонентов. На скорость реакции в каталитических процессах (гомогенных) влияет концентрация катализатора; на скорость фотохимических реакций – интенсивность излучения и т.д. Большинство реакций сложны по механизму и состоят из ряда последовательных стадий. Кинетические модели – сложные выражения, которые строятся на основании изученного механизма реакции.При равных порядках частных реакций концентрация не влияет на селективность, и повышение концентрации целесообразно для увеличения скорости реакции. Если порядок реакции образования побочного продукта больше, то селективность будет увеличиваться при снижении концентрации. Однако скорость превращения будет уменьшаться.Повышение температуры приведет к увеличению дифференциальной селективности, если при этом скорость образования 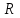 возрастает больше, чем скорость образования возрастает больше, чем скорость образования 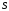 . Это возможно в случае . Это возможно в случае 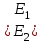 . При . При 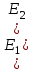 увеличению селективности будет способствовать снижение температуры в ущерб интенсивности.Влияние температуры. Если увеличению селективности будет способствовать снижение температуры в ущерб интенсивности.Влияние температуры. Если 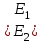 , то с повышением температуры , то с повышением температуры 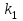 увеличивается сильнее, чем увеличивается сильнее, чем 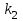 , и, соответственно, дифференциальная селективность , и, соответственно, дифференциальная селективность 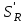 будет возрастать. При обратном соотношении энергий активации частных реакций ( будет возрастать. При обратном соотношении энергий активации частных реакций (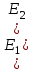 ) температура будет отрицательно сказываться на селективности.Концентрация. С увеличением концентрации (числа частиц в единице объема) чаще происходят столкновения молекул реагирующих веществ - скорость реакции возрастает. Константа скорости реакции k зависит от природы реагирующих веществ, температуры и катализатора, но не зависит от значения концентраций реагентов.Для гетерогенных реакций концентрация твердой фазы в выражение скорости реакции не входит.При повышении температуры на каждые 10°C скорость реакции возрастает в 2-4 раза. Для гетерогенных систем, чем больше поверхность соприкосновения, тем быстрее протекает реакция. Поверхность твердых веществ может быть увеличена путем их измельчения, а для растворимых веществ - путем их растворения. Вещества, которые участвуют в реакциях и увеличивают ее скорость, оставаясь к концу реакции неизменными, называются катализаторами. Механизм действия катализаторов связан с уменьшением энергии активации реакции за счет образования промежуточных соединений. При гомогенном катализе реагенты и катализатор составляют одну фазу при гетерогенном катализе - разные фазы (находятся в различных агрегатных состояниях). Резко замедлить протекание нежелательных химических процессов в ряде случаев можно добавляя в реакционную среду ингибиторы (явление "отрицательного катализа"). ) температура будет отрицательно сказываться на селективности.Концентрация. С увеличением концентрации (числа частиц в единице объема) чаще происходят столкновения молекул реагирующих веществ - скорость реакции возрастает. Константа скорости реакции k зависит от природы реагирующих веществ, температуры и катализатора, но не зависит от значения концентраций реагентов.Для гетерогенных реакций концентрация твердой фазы в выражение скорости реакции не входит.При повышении температуры на каждые 10°C скорость реакции возрастает в 2-4 раза. Для гетерогенных систем, чем больше поверхность соприкосновения, тем быстрее протекает реакция. Поверхность твердых веществ может быть увеличена путем их измельчения, а для растворимых веществ - путем их растворения. Вещества, которые участвуют в реакциях и увеличивают ее скорость, оставаясь к концу реакции неизменными, называются катализаторами. Механизм действия катализаторов связан с уменьшением энергии активации реакции за счет образования промежуточных соединений. При гомогенном катализе реагенты и катализатор составляют одну фазу при гетерогенном катализе - разные фазы (находятся в различных агрегатных состояниях). Резко замедлить протекание нежелательных химических процессов в ряде случаев можно добавляя в реакционную среду ингибиторы (явление "отрицательного катализа").32.Соленость и жесткость воды – общее и различия. В природе вода практически не встречается в чистом виде. Природные воды являются сложной гетерогенной системой, включающей минеральные, органические и газообразные соединения, находящиеся в ней в растворенном, коллоидном и взвешенном состояниях. Классификация вод по суммарному содержанию растворимых солей кальция и магния (жесткость; единица измерения – мг-экв/л и градус жесткости). Жесткость бывает: временная (карбонатная), которая обуславливается наличием Ca(HCO3)2 и Mg(HCO3)2 , которые в виде накипи выпадают при кипячении; постоянная (некарбонатная) определяется наличием в воде хлоридов, сульфатов, нитратов кальция и магния. Сумма временной и постоянной жесткости называется общей жесткостью.Классификация вод по общему солесодержанию:пресная вода – до 1000 мг/л (1,0 г/л);солоноватая вода – от 1 до 10 г/л;соленая вода – от 10 до 50 г/л;рассолы – более 50 г/л. Пресная вода в свою очередь делится на воду малой (до 200 мг/л), средней (до 500 мг/л) и повышенной минерализации (500-1000 мг/л). Общее представление о солесодержании дает такой показатель состава воды как – сухой остаток фильтрованной (отстоенной) пробы воды. Обессоливание воды(деминерализация) – удаление всех солей обеспечивается чаще двумя способами: дистилляцией – на перегонных установках и ионообменным способом. В основе процесса лежит способность ионитов (катионитов и анионитов) природного или искусственного происхождения вступать в реакцию обмена с ионами растворенных в воде солей (катионов Ca, Mg, Na,K; анионов SO4,CO3,HCO3Cl). Например: 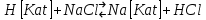 ; ;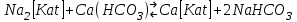 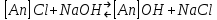 Обессоливание воды или умягчение (удаление ионов кальция и магния) осуществляется на ионитовых фильтрах и совпадает не только с процедурой умягчения, но и с процессом дегазации. Обессоливание воды или умягчение (удаление ионов кальция и магния) осуществляется на ионитовых фильтрах и совпадает не только с процедурой умягчения, но и с процессом дегазации.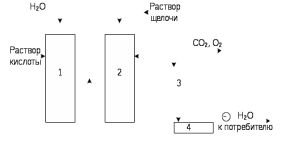 Рис. 13.2 Схема установки для обессоливания (умягчения) и дегазации воды 1 - катионовый фильтр, 2 – анионовый фильтр, 3 – дегазатор, 4 – сборник воды 33.Требования, предъявляемые к химическим реакторам. Организация процессов в реакторах. Многообразие химических и физических явлений, лежащих в основе разнохарактерных технологических процессов, выдвигает самые различные требования к химическим реакторам. Однако все без исключения реакторы должны удовлетворять следующим основным требованиям: обеспечивать наибольшую производительность и интенсивность по целевому продукту;давать возможно более высокую степень превращения сырья при максимальной селективности процесса;иметь малые энергетические затраты на транспортировку и перемешивание реагентов;быть достаточно простыми в устройстве и эксплуатации (включая ремонт и монтаж), дешевыми, для чего при изготовлении реакторов необходимо использовать черные металлы, недорогие изделия силикатной промышленности, недефицитные пластмассы и т.п.;наиболее полно использовать теплоту экзотермических реакций и теплоту, подводимую извне (в т.ч. теплоту продуктовых потоков), для осуществления эндотермических процессов;быть надежными в работе, по возможности наиболее полно механизированными и обеспечивать автоматическое регулирование и управление процесса. Оптимизация реакторов заключается в обеспечении их режима работы с достижением наилучших технико-экономических показателей, при условии, что теплообмен, подача реагентов определены конструкцией реактора. Имея математическое описание процесса и используя численные методы оптимизации с помощью ЭВМ, это можно сделать. Задача оптимизации – сугубо математическая процедура, которая включает: постановку задачи оптимизации, выбор критерия оптимизации (одного показателя);выбор переменных, при которых выбранный критерий принимает экстремальный характер (управляющие параметры по критерию);установить математическую связь критерия оптимизации с управляющими параметрами;определить ограничения, накладываемые на переменные;решение задачи оптимизации (разрабатывается алгоритм и используется ЭВМ). 34.Классификация реакторов по гидродинамическому режиму. Реактор полного вытеснения характеризуется переменной концентрацией реагирующих веществ по длине аппарата, наибольшей разницей концентраций на входе и выходе из реактора и, следовательно, наибольшей движущей силой процесса. Изменение концентраций в реакционном объеме носит плавный характер, т.к. последующие реакционные объемы реагирующих веществ не смешиваются с предыдущими, а полностью ими вытесняются. Практически к режиму полного вытеснения можно приблизиться в реакторе с малым диаметром и большой длиною при относительно высоких скоростях движения реагирующих веществ. Реакторы вытеснения находят широкое применение для проведения как гомогенных, так и гетерогенных каталитических процессов. Реактор полного смешения обычно снабжен каким-либо перемешивающим устройством и характеризуется постоянством концентрации реагирующих веществ во всем объеме реактора в данный момент времени вследствие практически мгновенного смешения реагирующих веществ в реакционном объеме. Поэтому изменение концентрации реагирующих веществ на входе в реактор носит скачкообразный характер. Средняя движущая сила процесса в таком аппарате будет меньше, чем в аппарате полного вытеснения. Перемешивание проводят с помощью мешалки или циркуляционного насоса. Система, состоящая в некоторых случаях из 20 и более аппаратов, получила название каскада реакторов (батареи реакторов). В каскаде реакторов изменение концентрации реагирующих веществ носит ступенчатый характер, т.к. продукт реакции предыдущего аппарата является исходным реагирующим веществом в последующем аппарате. Следствием ступенчатого изменения концентрации является пониженная средняя скорость реакции по сравнению с реактором вытеснения, при тех же концентрациях реагентов на входе в аппарат. Гидродинамический режим работы каскада реакторов является промежуточным и зависит от числа аппаратов: с увеличением числа реакторов в каскаде он приближается к режиму вытеснения, а при уменьшении – к режиму смешения. В реакторе промежуточного типа нельзя осуществить полностью ни один из перечисленных выше гидродинамических режимов движения реагирующих веществ. Средняя движущая сила процесса в таком аппарате больше, чем в аппарате полного смешения, но меньше, чем в аппарате полного вытеснения. Следует отметить, что значительная часть реакционной химической аппаратуры работает именно в этом гидродинамическом режиме.Реакторы промежуточного типа применяются в тех случаях, когда процесс химического превращения вещества сопровождается большим тепловым эффектом или протекает при высоких концентрациях реагирующих веществ. 35.Основные виды энергии. Основные виды энергии, применяемые в тех или иных химических производствах, зависят от характера технологического процесса. Тепловая энергия может быть получена за счет сжигания твердого, жидкого и газообразного топлива в различных устройствах. Тепловая энергия применяется для осуществления самых разнообразных процессов - нагрева, плавления, сушки, выпаривания, дистилляции, тепловой десорбции, эндотермических превращений. В качестве теплоносителей используют топочные газы, получаемые сжиганием топлива, водяной пар, горячую воду и другие жидкости (масло, расплавы солей и пр.).Электрическая энергия применяется для проведения электрохимических (электролиз растворов и расплавов), электротермических (плавление, нагревание, синтез при высоких температурах), электромагнитных процессов. В промышленности осуществляют процессы, связанные с использованием электростатических явлений, - осаждение пылей и туманов, электрокрекинг углеводородов. Широко используется в химической промышленности превращение электрической энергии в механическую в электроприводах различных машин и механических устройств (дробилки, измельчители, смесители, центрифуги, вентиляторы, насосы, компрессоры). Световая энергия в последнее время приобретает все большее значение для проведения фотохимических реакций. Используют также энергию других видов излучений и атомныхпревращенийдля проведения радиационно-химических и ядерно-химических реакций. Первичные источники энергии – источники, энергетический потенциал которых является следствием природных процессов и не зависит от деятельности человека. К ним относятся: ископаемые горючие и расщепляющиеся вещества, нагретые до высокой температуры воды недр Земли (термальные воды), Солнце, ветер, энергия вод рек, морей, океанов. Вторичные источники энергии – вещества, обладающие определенным энергетическим потенциалом и являющиеся побочными продуктами деятельности человека: отходящие горючие органические вещества, горячие отработанные теплоносители промышленных производств (газ, вода, пар), нагретые вентиляционные выбросы, горячие и находящиеся под давлением технологические потоки и др.К невозобновляющимся первичным источникам энергии относятся ископаемые горючие вещества (уголь, нефть, природный газ, сланцы); к возобновляющимся – все источники энергии, являющиеся продуктами деятельности Солнца и природных явлений и процессов на поверхности Земли: ветер, энергия воды рек, морей, океанов, растительные продукты биологической деятельности (древесина и другие растительные продукты), а также Солнце. |

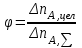 .
.