шпаргалка по охт. 1. Технологические показатели и их роль в управлении технологическим процессом
 Скачать 0.82 Mb. Скачать 0.82 Mb.
|
|
15.Равновесное и кинетическое состояние системы. В основе любого ХТП лежит процесс химического взаимодействия, т.е. химическая реакция. Известно, что теоретически большинство реакций обратимы, т.е. в зависимости от условий они могут проходить как в прямом, так и в обратном направлении. Если скорость прямой реакции равна скорости обратной реакции, то результирующая скорость равна «0». В результате чего соотношение компонентов во взаимодействующих системах остается неизменным до тех пор, пока не изменяются условия протекания процесса. При изменении технологических параметров: температуры ( 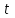 ), давления ( ), давления (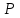 ), концентрации реагирующих веществ ( ), концентрации реагирующих веществ (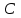 ), - равновесие нарушается, и процесс может сместиться влево или вправо до момента наступления нового равновесия. С учетом вышеизложенного можно обобщить: равновесное состояние достигается в технологической системе при бесконечно большом времени контакта. ), - равновесие нарушается, и процесс может сместиться влево или вправо до момента наступления нового равновесия. С учетом вышеизложенного можно обобщить: равновесное состояние достигается в технологической системе при бесконечно большом времени контакта. В реальных технологических схемах, когда время контакта конечно, достигается кинетическое состояние. Для разных процессов время достижения равновесного состояния связано со скоростью протекающего процесса. В реальных технологических процессах отличить кинетическое состояние от равновесного можно изменением подачи сырья (т.е. времени контакта 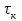 ): ): 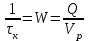 м3/(чм3) или 1/ч.Если смена подачи сырья (увеличение или уменьшение) изменяет конверсию (т.е. степень превращения его в новый целевой продукт), значит система находится в состоянии равновесном, если не изменяет – то в кинетическом (т.е. на пути к достижению равновесного состояния). Основная задача производства – выбор таких аппаратов и условий ХТП ( м3/(чм3) или 1/ч.Если смена подачи сырья (увеличение или уменьшение) изменяет конверсию (т.е. степень превращения его в новый целевой продукт), значит система находится в состоянии равновесном, если не изменяет – то в кинетическом (т.е. на пути к достижению равновесного состояния). Основная задача производства – выбор таких аппаратов и условий ХТП ( , ,  , катализатор), когда бы достигалось состояние, близкое к равновесному в аппарате возможно меньших размеров. При организации производства на стадии проектирования очень важны термодинамические расчеты химических реакций. Они позволяют сделать вывод о принципиальной возможности данного химического превращения; предварительно выбрать условия проведения процесса, определить равновесный состав продуктов, рассчитать теоретическое достижение степени превращения исходных веществ и выходы продуктов, а также энергетические эффекты (теплоты реакции, теплоты изменения агрегатного состояния и пр.). , катализатор), когда бы достигалось состояние, близкое к равновесному в аппарате возможно меньших размеров. При организации производства на стадии проектирования очень важны термодинамические расчеты химических реакций. Они позволяют сделать вывод о принципиальной возможности данного химического превращения; предварительно выбрать условия проведения процесса, определить равновесный состав продуктов, рассчитать теоретическое достижение степени превращения исходных веществ и выходы продуктов, а также энергетические эффекты (теплоты реакции, теплоты изменения агрегатного состояния и пр.).Величины, характеризующие состояние термодинамической системы, называют термодинамическими параметрами. Это - температура, давление, концентрация реагентов, удельный объем, плотность, молярный объем и др. термодинамика – это выбор условий ХТС, т.е., что возможно или невозможно, и при каких условиях (данные показатели не зависят от конструкции аппарата, его гидродинамики, катализатора); 16.Константа равновесия и оценка обратимости химической реакции. Уравнение изотермы Вант-Гоффа. Количественной характеристикой обратимого процесса является константа химического равновесия. Чем больше К, тем меньше 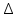 G, а если G, а если 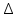 G<0, то процесс идет в сторону образования конечных веществ. G<0, то процесс идет в сторону образования конечных веществ.Если константа равновесия мала, то процесс неосуществим, но можно подобрать условия (температуру, давление и соотношение реагентов), при которых можно получить необходимый выход продуктов. Она является мерой устойчивости системы. Данное неравенство 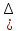 G<0) позволяет оценить возможность использования процесса для получения желаемого продукта. Кроме того, позволяет определить условия, препятствующие протеканию нежелательных реакций, особенно если они имеют место при производстве целевого продукта. G<0) позволяет оценить возможность использования процесса для получения желаемого продукта. Кроме того, позволяет определить условия, препятствующие протеканию нежелательных реакций, особенно если они имеют место при производстве целевого продукта.Для расчета 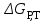 используют чаще справочные данные, где приводятся значения стандартных энергий Гиббса используют чаще справочные данные, где приводятся значения стандартных энергий Гиббса 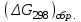 образования веществ при температуре 298 К. Если их нет, то ведут ее расчет по уравнению образования веществ при температуре 298 К. Если их нет, то ведут ее расчет по уравнению
где 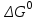 – изменение свободной энергии Гиббса в стандартном состоянии; – изменение свободной энергии Гиббса в стандартном состоянии;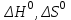 – стандартные энтальпия и энтропия (справочные данные). – стандартные энтальпия и энтропия (справочные данные).В условиях равновесия 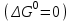 при любой температуре при любой температуре 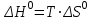 . .Порядок и знак величины 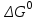 позволяют качественно предвидеть положение равновесия реакции (уравнение изотермы Вант-Гоффа): позволяют качественно предвидеть положение равновесия реакции (уравнение изотермы Вант-Гоффа):
Если 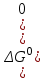 , то равновесие сдвинуто вправо и , то равновесие сдвинуто вправо и 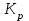 имеет большое численное значение, а выход продукта велик; если имеет большое численное значение, а выход продукта велик; если 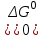 , то равновесие сдвинуто влево и , то равновесие сдвинуто влево и 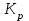 имеет малое численное значение, а выход продукта мал. Равновесный состав смесей связан с константой равновесия имеет малое численное значение, а выход продукта мал. Равновесный состав смесей связан с константой равновесия 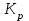 : :
где 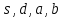 - стехиометрические коэффициенты в уравнении (6.4). - стехиометрические коэффициенты в уравнении (6.4).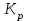 - термодинамическая функция, которая зависит только от температуры Изменение химического равновесия достигается изменением внешних условий. Направленность влияния определяется правилом, называемым принципом Ле-Шателье. Он состоит в том, что если воздействовать на систему, находящуюся в химическом равновесии, то состояние системы изменится таким образом, что это воздействие ослабляется. - термодинамическая функция, которая зависит только от температуры Изменение химического равновесия достигается изменением внешних условий. Направленность влияния определяется правилом, называемым принципом Ле-Шателье. Он состоит в том, что если воздействовать на систему, находящуюся в химическом равновесии, то состояние системы изменится таким образом, что это воздействие ослабляется.17.Роль термодинамических расчетов в химической технологии. В основе любого химико-технологического процесса (ХТП) лежат общие (научные, теоретические принципы) – это физико-химические основы ОХТ. Это – совокупность теоретических знаний, включающих такие науки как термодинамика, кинетика, катализ, энергетический (тепловой) и материальный баланс. При рассмотрении раздела «технологический регламент» упоминалось, что в нем всегда обязательно используются результаты научных исследований, реализуемого ХТП в промышленности, а именно, должны быть приведены кинетические уравнения реакций; указаны константы равновесия 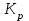 и равновесный выход целевого продукта, условия равновесия; математическая модель процесса. и равновесный выход целевого продукта, условия равновесия; математическая модель процесса.В основе любого ХТП лежит процесс химического взаимодействия, т.е. химическая реакция. Известно, что теоретически большинство реакций обратимы, т.е. в зависимости от условий они могут проходить как в прямом, так и в обратном направлении. Если скорость прямой реакции равна скорости обратной реакции, то результирующая скорость равна «0». В результате чего соотношение компонентов во взаимодействующих системах остается неизменным до тех пор, пока не изменяются условия протекания процесса. При изменении технологических параметров: температуры ( 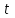 ), давления ( ), давления (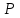 ), концентрации реагирующих веществ ( ), концентрации реагирующих веществ (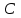 ), - равновесие нарушается, и процесс может сместиться влево или вправо до момента наступления нового равновесия. С учетом вышеизложенного можно обобщить: равновесное состояние достигается в технологической системе при бесконечно большом времени контакта. Для разных процессов время достижения равновесного состояния связано со скоростью протекающего процесса.Если смена подачи сырья (увеличение или уменьшение) изменяет конверсию (т.е. степень превращения его в новый целевой продукт), значит система находится в состоянии равновесном, если не изменяет – то в кинетическом (т.е. на пути к достижению равновесного состояния).Основная задача производства – выбор таких аппаратов и условий ХТП ( ), - равновесие нарушается, и процесс может сместиться влево или вправо до момента наступления нового равновесия. С учетом вышеизложенного можно обобщить: равновесное состояние достигается в технологической системе при бесконечно большом времени контакта. Для разных процессов время достижения равновесного состояния связано со скоростью протекающего процесса.Если смена подачи сырья (увеличение или уменьшение) изменяет конверсию (т.е. степень превращения его в новый целевой продукт), значит система находится в состоянии равновесном, если не изменяет – то в кинетическом (т.е. на пути к достижению равновесного состояния).Основная задача производства – выбор таких аппаратов и условий ХТП (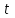 , , 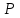 , катализатор), когда бы достигалось состояние, близкое к равновесному в аппарате возможно меньших размеров. При организации производства на стадии проектирования очень важны термодинамические расчеты химических реакций. Они позволяют сделать вывод о принципиальной возможности данного химического превращения; предварительно выбрать условия проведения процесса, определить равновесный состав продуктов, рассчитать теоретическое достижение степени превращения исходных веществ и выходы продуктов, а также энергетические эффекты (теплоты реакции, теплоты изменения агрегатного состояния и пр.)Величины, характеризующие состояние термодинамической системы, называют термодинамическими параметрами. Это - температура, давление, концентрация реагентов, удельный объем, плотность, молярный объем и др. , катализатор), когда бы достигалось состояние, близкое к равновесному в аппарате возможно меньших размеров. При организации производства на стадии проектирования очень важны термодинамические расчеты химических реакций. Они позволяют сделать вывод о принципиальной возможности данного химического превращения; предварительно выбрать условия проведения процесса, определить равновесный состав продуктов, рассчитать теоретическое достижение степени превращения исходных веществ и выходы продуктов, а также энергетические эффекты (теплоты реакции, теплоты изменения агрегатного состояния и пр.)Величины, характеризующие состояние термодинамической системы, называют термодинамическими параметрами. Это - температура, давление, концентрация реагентов, удельный объем, плотность, молярный объем и др. 18.Основная нормативно-техническая документация при организации химико-технологического процесса. Формирование нового производства начинается с оценки рыночной ситуации (маркетинга): изменение спроса на товарный продукт и долговременности рынков сбыта, возможность оперативного перехода на новую товарную форму (модель), оценка затрат, срок окупаемости затрат и др. Документ, который создается на самом первом этапе, называется «бизнес-план» или технико-экономическое обоснование проекта (ТЭО). Следующий этап – подготовка технического задания (ТЗ) на товарный продукт, в котором оговариваются все его основные показатели, согласованные с потребителем продукции. Формирование структуры производства осуществляется в соответствии с техническим (технологическим) проектом данного производства. Составными документами проекта являются: технологический регламент производства, технические условия на целевой продукт (ТУ). Технологический регламент является документом, содержащим исходные данные, необходимые и достаточные для реализации технологического процесса производства целевого продукта заданного (по ТУ) качества. Выполняется технологический регламент «разработчиком» данного целевого продукта в соответствии с государственным стандартом. Он включает определенные разделы: общая характеристика производства; техническая характеристика сырья, продуктов, основных и вспомогательных материалов и нормативно-технические документы на них (НТД); химическая схема производства; основные физико-химические и кинетические константы процессов; основные технологические показатели (конверсия, селективность, выход продукта, расходные коэффициенты) отдельных стадий; технологическая схема производства (аппаратурно-технологическая схема со спецификацией по основному и вспомогательному оборудованию); описание технологического процесса по отдельным стадиям, аппаратам; условия ведения процессов (режимы и их контроль); материальный баланс процессов; характеристика отходов производства; удельные нормы сырья, материалов, энергии на единицу товарного продукта; техника безопасности производства; контроль и управление производством (действителен на какой-срок).Технические условия (ТУ) на товарный продукт (либо аналогичные документы – ГОСТ – государственный стандарт на определенный продукт; СТП – стандарт предприятия на продукт и пр.) представляют собой подробные сведения по производимому продукту: состав, свойства, области его использования, условия его хранения и транспортировки. Обязательно приводятся физико-химические (отдельные) характеристики товарного продукта и методы их контроля.Все вышеприведенные документы «разработчик» проекта производства приобретает в результате предварительной научно-исследовательской работы (НИР) и опытно-конструкторской работы (ОКР). 19.Биотехнология. Биотехнология – это реализация биологических процессов, систем в промышленных масштабах. Высокие избирательные скорости процессов, реализуемые в мягких условиях (при невысоких температурах и атмосферном давлении) позволяют предполагать наличие еще не известных до конца механизмов биокатализа. Именно эти механизмы привлекают исследователей, поскольку с их помощью рассчитывают вовлечь в пищевой ресурсный цикл для человека, сельскохозяйственных животных не пищевое сырье; решить вопрос о возобновляемых источниках энергии и экологические проблемы. Человек реализовал в быту ряд биотехнологий – соление и квашение мяса, рыбы, овощей и фруктов как метода сохранения продуктов питания, производство молочнокислой продукции, сыра, вина, хлеба, пива, уксуса и т.д.Бесспорным родоначальником массового и прикладного использования результатов микробиологических исследований в практической деятельности человека можно назвать Л. Пастера (конец ХIX): производство органических растворителей (ацетона, этанола, бутанола, изопропанола) и др. химических веществ. Оно существовало еще до развития нефтехимического производства. Однако, по мере исчерпания нефтяного сырья еще возможен возврат к ним в будущем.
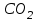 , , 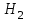 , , 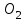 , спирте (этаноле), растительных отходов (гидролизатах)решает одну из глобальных проблем человечества – ресурсосбережение пищевого продукта. , спирте (этаноле), растительных отходов (гидролизатах)решает одну из глобальных проблем человечества – ресурсосбережение пищевого продукта. 20.Классификация химических реакторов. Химический реактор – устройство, аппарат для проведения химических превращений (химических реакций).Используют много различных названий – реактор, колонна, башня, автоклав, камера, печь, контактный аппарат, полимеризатор, дожигатель, гидрогенизатор, окислитель и др. В промышленной технологии химический реактор является основным аппаратом, где имеют место также определенные физические процессы (гидродинамические, тепловые, диффузионные), с помощью которых создаются оптимальные условия для проведения собственно химического превращения. Для осуществления этих физических процессов реактор имеет в своем устройстве типовые конструктивные элементы, широко применяемые в аппаратах для проведения собственно физических процессов (мешалки, контактные устройства, теплообменники и т.д.). Для всех реакторов существуют общие принципы, на основе которых можно найти связь между конструкцией аппарата и основными закономерностями протекающего в нем химического процесса. Критериями, по которым классифицируют реакционную аппаратуру, являются периодичность или непрерывность процесса, его гидродинамический и тепловой режимы, физические свойства взаимодействующих веществ. По принципу организации процесса химическая реакционная аппаратура может быть разделена на три группы: Реакторы непрерывного действия; Реакторы периодического действия; Реакторы полунепрерывного (полупериодического) действия. По гидродинамическому режиму различают следующие типы реакторов: Реакторы полного вытеснения; Реакторы полного смешения; Реакторы промежуточного типа (с промежуточным гидродинамическим режимом). По тепловому режиму работы реакторы делят на следующие типы:Изотермический реактор;Адиабатический реактор;Политропический реактор. Для гомогенных процессов используют как емкостные, так и трубчатые аппараты. Причем, емкостные аппараты могут работать как в периодическом, так и в проточном режиме. Часто снабжены мешалками разнообразных конструкций. Конструктивная классификация реакторов объединяет всю реакционную аппаратуру в следующие группы:Реакторы типа реакционной камеры;Реакторы типа колонны;Реакторы типа теплообменника; Реакторы типа печи.
|

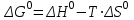 ,
,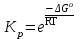 .
.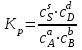 ,
,