шпаргалка по охт. 1. Технологические показатели и их роль в управлении технологическим процессом
 Скачать 0.82 Mb. Скачать 0.82 Mb.
|
|
8. Схемы организации ХТС (функциональная, технологическая, химическая) и решаемые задачи производства. При разработке ХТС (анализ и синтез процесса) осуществляется изучение свойств и эффективность функционирования моделей ХТС. Конечной задачей анализа-синтеза ХТС каждой модели (их виды будут рассмотрены далее) является оптимизация всех подсистем и в целом ХТС. Критерий эффективности, как правило, экономический – себестоимость, средняя прибыль, приведенный доход, приведенные затраты и т.д. Различают описательные модели: химическая; операционная; математическая; и графические модели: функциональные; технологические; структурные; специальные. Химическая модель (схема) включает основные химические реакции, которые составляют процесс превращения сырья в целевой продукт. Пример производства соды 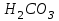 из поваренной соли из поваренной соли 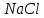 и известняка и известняка 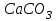 . (схема в виде формул) . (схема в виде формул)Функциональная модель (схема) выстраивается на основе химической и операционной схем и в свою очередь служит основой для аппаратурного оформления процесса и более детальной разработки ХТС. Технологическая модель (схема) показывает элементы системы, порядок их соединения и последовательность технологических операций. В технологической схеме каждый элемент имеет общепринятое изображение, близкое к его натуральному виду. Потоки (жидкие, газообразные, твердые или их смеси) отображаются линиями со стрелками. В определенных случаях вводятся обозначения технологических показателей ведения процесса, а также сведения об основном оборудовании (спецификация), которые приводятся в отдельной вставке. Технологические схемы чрезвычайно наглядны и применяются как при проектировании, так и при эксплуатации ХТС. В частности, они входят в состав технологического регламента на производство. 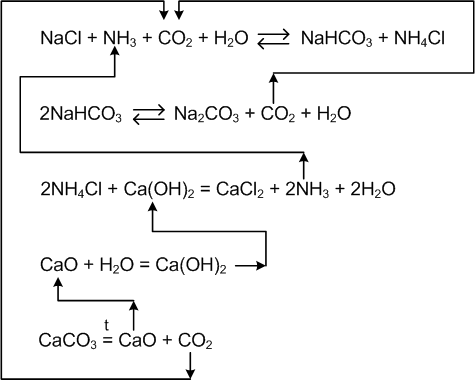  9.Кинетика гомогенного катализа. Его закономерности. Такой процесс может идти в газовой или жидкой фазе. Механизм его состоит в образовании между реагентами и катализатором нестойких, промежуточных соединений, существующих в той же фазе (газовой или жидкой), после распада которых образуется новый продукт, а катализатор регенерируется. По такому типу протекают реакции гидратации, дегидратации, гидролиза, этерификации, поликонденсации в растворах. Примером кислотно-основного катализа может служить гидратация олефинов в спирты, катализируемая кислотами ( 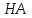 ). В общем виде: ). В общем виде:
На стадии а) катализатор служит донором протона, на стадии в) катализатор регенерируется. Разновидностью гомогенного катализа является процесс, имеющий радикальный механизм, который может идти как в газовой фазе, так и в жидкой фазе. При этом катализатор может выступать инициатором, направляющим процесс по цепному механизму. Ускорение достигается в результате появления богатых энергией частиц – свободных радикалов в процессе самой реакции. Такие реакции называются автокаталитическими. К ним относятся процессы горения, полимеризации. Скорость гомогенного каталитического процесса возрастает с повышением концентрации исходных веществ и катализатора. Влияние температуры, давления и перемешивания на скорость процесса аналогично общим кинетическим закономерностям гомогенных процессов. К микрогетерогенному катализу относятся ферментативный катализ, который является основой всех обменных процессов живых организмов. 10.Гомогенный и гетерогенный катализ. Общее и различия. В качестве катализаторов могут выступать индивидуальные вещества, соединения. Они могут быть в различном фазовом состоянии – газы, жидкости и твердые соединения. По принципу фазового состояния реагентов и катализатора каталитические процессы разделяют на две основные группы: гомогенные и гетерогенные. При гомогенном катализе и катализатор, и реагенты находятся в одной фазе – газовой или жидкой. При гетерогенном катализе – катализатор и реагенты или продукты реакции находятся в разных фазах. В промышленности чаще применяют твердые катализаторы. Все каталитические реакции гомо- и гетерогенного катализа делят по типу взаимодействия катализатора с реагирующими веществами на два основных класса: окислительно-восстановительное (гомолитическое) и кислотно-основное (гетеролитическое) взаимодействие. Окислительно-восстановительный (окисления, гидрирования, дегидрирования) катализ заключается в обмене электронами между катализатором и реагентами. Кислотно-основной (гидратация, дегидратация, полимеризация, поликонденсация, крекинг, изомеризация, алкилирование)катализ заключается в обмене протонами или ионами (катионами или анионами) между катализатором и реагирующими молекулами. В гетерогенных системах каталитическая реакция идет на поверхности раздела фаз. Ускорение реакции зависит не только от количества катализатора, но и от величины его поверхности, а также от того, с какой скоростью происходит смена молекул, входящих в соприкосновение с этой поверхностью, т.е. от скорости диффузии реагентов и продуктов реакции. Гетерогенный катализ является сложным многостадийным процессом, каждая стадия которого имеет свою скорость (может быть лимитирующей). Весь процесс можно разделить на пять стадий: 1) диффузия реагирующих веществ к поверхности катализатора; 2) адсорбция на адсорбционных центрах; 3) химическая реакция на поверхности; 4) десорбция продуктов реакции с поверхности; 5) диффузия продуктов реакции в объем раствора или газа. Гомогенный катализ может идти в газовой или жидкой фазе. Механизм его состоит в образовании между реагентами и катализатором нестойких, промежуточных соединений, существующих в той же фазе (газовой или жидкой), после распада которых образуется новый продукт, а катализатор регенерируется (состоит из двух стадий). Разновидностью гомогенного катализа является процесс, имеющий радикальный механизм, который может идти как в газовой фазе, так и в жидкой фазе. При этом катализатор может выступать инициатором, направляющим процесс по цепному механизму. Ускорение достигается в результате появления богатых энергией частиц – свободных радикалов в процессе самой реакции. Такие реакции называются автокаталитическими. К ним относятся процессы горения, полимеризации. 11.Физический смысл критерия равновесности. Рассмотрим уравнение химической реакции 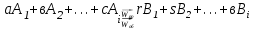 Равновесное состояние системы характеризуется:  , ,где  - скорость прямой реакции; - скорость прямой реакции;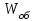 - скорость обратной реакции. - скорость обратной реакции.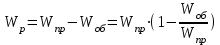 . .  Примем, что Примем, что 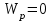 . .Отсюда: 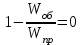 ; или ; или 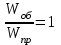 . .Если 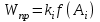 и и 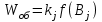 , ,где 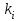 - константа прямой реакции; - константа прямой реакции;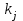 - константа обратной реакции, - константа обратной реакции,то 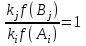 , после преобразования (делим на , после преобразования (делим на 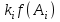 ) )имеем: 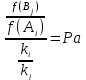 или или 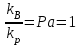 , ,где 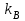 - вынужденное равновесие, определяется реальным кинетическим состоянием системы; - вынужденное равновесие, определяется реальным кинетическим состоянием системы;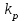 - свободное равновесие, определяется на основе термодинамических расчетов; - свободное равновесие, определяется на основе термодинамических расчетов;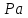 - критерий равновесия, мера отклонения кинетического равновесия ( - критерий равновесия, мера отклонения кинетического равновесия (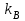 ) от свободного равновесия (термодинамического ) от свободного равновесия (термодинамического 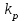 ) )12.Свойства серной кислоты и области ее применения. Безводная серная кислота (моногидрат) представляет собой тяжелую маслянистую жидкость, которая смешивается с водой во всех соотношениях с выделением большого количества тепла. Плотность 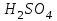 при 0 °С равна 1,85 г/см3, кипит при 296 °С и замерзает при – 10 °С. Серной кислотой называют не только моногидрат, но и водные растворы его ( при 0 °С равна 1,85 г/см3, кипит при 296 °С и замерзает при – 10 °С. Серной кислотой называют не только моногидрат, но и водные растворы его (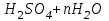 ), а также растворы трехокиси серы в моногидрате ( ), а также растворы трехокиси серы в моногидрате (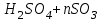 ), олеум. Чистая серная кислота бесцветна, техническая окрашена примесями в темный цвет. Свойства зависят от состава. Серная кислота весьма активна. Она растворяет окислы металлов и большинство чистых металлов; вытесняет при повышенной температуре все другие кислоты из солей. Особенно жадно серная кислота соединяется с водой благодаря способности давать гидраты. Она отнимает воду от других кислот, от кристаллогидратов солей и даже кислородных производных углеводородов, которые содержат не воду таковую, а водород и кислород в сочетании Н:О=2, дерево и другие растительные и животные ткани, содержащие целлюлозу, крахмал и сахар, разрушаются в концентрированной серной кислоте; вода связывается с кислотой и от ткани остается лишь мелкодисперсный углерод. В разбавленной целлюлоза и крахмал распадаются с образованием сахаров. При попадании на кожу человека конц. серная кислота вызывает ожоги. ), олеум. Чистая серная кислота бесцветна, техническая окрашена примесями в темный цвет. Свойства зависят от состава. Серная кислота весьма активна. Она растворяет окислы металлов и большинство чистых металлов; вытесняет при повышенной температуре все другие кислоты из солей. Особенно жадно серная кислота соединяется с водой благодаря способности давать гидраты. Она отнимает воду от других кислот, от кристаллогидратов солей и даже кислородных производных углеводородов, которые содержат не воду таковую, а водород и кислород в сочетании Н:О=2, дерево и другие растительные и животные ткани, содержащие целлюлозу, крахмал и сахар, разрушаются в концентрированной серной кислоте; вода связывается с кислотой и от ткани остается лишь мелкодисперсный углерод. В разбавленной целлюлоза и крахмал распадаются с образованием сахаров. При попадании на кожу человека конц. серная кислота вызывает ожоги.
13.Влияние катализатора на механизм химической реакции. Катализ – это способ ускорения химических реакций. Ускорение достигается в 103 – 106 раз. Катализатор – это соединения, вещества, которые, многократно вступая в промежуточное взаимодействие с участниками реакций, изменяют ее механизм и увеличивают скорость реакции, при этом они восстанавливают свой химический состав после каждого цикла промежуточных взаимодействий. Катализаторы не могут вызывать реакций термодинамически невозможных. Но если она возможна, и не идет из-за высокой энергии активации, присутствие катализатора создает условия для ее возникновения. Роль катализатора заключается в замене трудноосуществимого прямого пути течения реакций более легким обходным путем, включающим промежуточное взаимодействие с катализатором. Энергия активации каждой стадии каталитической реакции существенно ниже энергии активации химической реакции без участия катализатора. 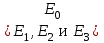 . .Под энергией активации понимают минимальное значение суммарной энергии сталкивающихся молекул, которая обеспечивает вступление их в реакцию между собой. Энергию активации можно интерпретировать как энергетический барьер, который нужно преодолеть реагирующим веществам, чтобы произошел акт взаимодействия. При этом скорость реакции тем больше, чем меньше энергия активации 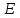 , и, вследствие экспоненциальной зависимости, , и, вследствие экспоненциальной зависимости, 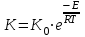 , скорость реакции значительно возрастает даже при небольшом снижении энергии активации. , скорость реакции значительно возрастает даже при небольшом снижении энергии активации.Таким образом, действие катализаторов заключается в неограниченном повышении константы скорости реакции 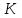 без влияния на движущую силу без влияния на движущую силу 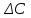 .В простых одномаршрутных реакциях действие катализатора не смещает равновесие, а лишь ускоряет достижение его при данной температуре. Если термодинамически возможны различные параллельные реакции основного исходного вещества, то применение катализатора, ускоряющего одну из возможных реакций, позволяет подавлять остальные и получать такой целевой продукт, который при некаталитической реакции не получается.В качестве катализаторов могут выступать индивидуальные вещества, соединения. Они могут быть в различном фазовом состоянии – газы, жидкости и твердые соединения. .В простых одномаршрутных реакциях действие катализатора не смещает равновесие, а лишь ускоряет достижение его при данной температуре. Если термодинамически возможны различные параллельные реакции основного исходного вещества, то применение катализатора, ускоряющего одну из возможных реакций, позволяет подавлять остальные и получать такой целевой продукт, который при некаталитической реакции не получается.В качестве катализаторов могут выступать индивидуальные вещества, соединения. Они могут быть в различном фазовом состоянии – газы, жидкости и твердые соединения.Избирательность или селективность катализатора. Так называется способность катализатора избирательно ускорять целевую реакцию при наличии нескольких побочных. Общую селективность можно представить как: 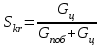 14.Скорость химической реакции. Простые и сложные реакции. Скорость химической реакции ( 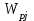 ) принято выражать количеством моль ( ) принято выражать количеством моль (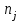 ) одного из реагентов или продуктов, прореагировавшим (или образовавшимся) в единицу времени ) одного из реагентов или продуктов, прореагировавшим (или образовавшимся) в единицу времени 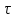 в единице реакционного пространства. Для гомогенной химической реакции в единице реакционного пространства. Для гомогенной химической реакции
Скорость может быть измерена по любому компоненту, участвующему в реакции; она всегда положительна, поэтому знак перед производной 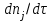 должен определяться тем, является ли вещество должен определяться тем, является ли вещество 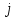 исходным реагентом (-) или продуктом (+). Зависимость скорости реакции от концентрации: исходным реагентом (-) или продуктом (+). Зависимость скорости реакции от концентрации:
где 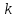 - коэффициент пропорциональности или константа скорости реакции; - коэффициент пропорциональности или константа скорости реакции; 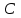 - концентрация компонентов; - концентрация компонентов; 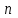 - порядок реакции. Измеряется в кмоль·м-3·ч-1 или моль·л-1·с-1 и т.д. В зависимости от механизма реакции могут быть подразделены на простые и сложные. К простым реакциям относятся реакции, протекающие в одном направлении и включающие один химический этап и их можно классифицировать следующим образом: по порядку реакции, по молекулярности. Для простых реакций порядок и молекулярность совпадают только в случае реакций, протекающих в соответствии с уравнением реакции. В подавляющем большинстве случаев, молекулярность и порядок реакции не совпадают. Это объясняется тем, что стехиометрическое уравнение реакции, описывающее процесс в целом, не в состоянии отразить истинного механизма реакции, протекающей, как правило, в особенности у сложных реакций, через ряд последовательных стадий. - порядок реакции. Измеряется в кмоль·м-3·ч-1 или моль·л-1·с-1 и т.д. В зависимости от механизма реакции могут быть подразделены на простые и сложные. К простым реакциям относятся реакции, протекающие в одном направлении и включающие один химический этап и их можно классифицировать следующим образом: по порядку реакции, по молекулярности. Для простых реакций порядок и молекулярность совпадают только в случае реакций, протекающих в соответствии с уравнением реакции. В подавляющем большинстве случаев, молекулярность и порядок реакции не совпадают. Это объясняется тем, что стехиометрическое уравнение реакции, описывающее процесс в целом, не в состоянии отразить истинного механизма реакции, протекающей, как правило, в особенности у сложных реакций, через ряд последовательных стадий.Сложные реакции подразделяются следующим образом: Обратимые реакции 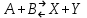 ; ;Параллельные реакции 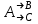 ; ; 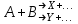 ; скорость процесса будет определяться в первую очередь скоростью наиболее быстрой его стадии; ; скорость процесса будет определяться в первую очередь скоростью наиболее быстрой его стадии;Сопряженные реакции 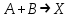 (а) и (а) и 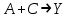 (б); они отличаются тем, что одна из них – (а) идет самопроизвольно, а другая, например (б), только в присутствии первой; (б); они отличаются тем, что одна из них – (а) идет самопроизвольно, а другая, например (б), только в присутствии первой;Последовательные реакции 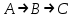 , , 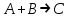 ; если скорость одной из химических стадий значительно меньше скоростей других, то скорость всего процесса будет определяться самой медленной стадией. ; если скорость одной из химических стадий значительно меньше скоростей других, то скорость всего процесса будет определяться самой медленной стадией.Законы химической кинетики основаны на двух простых принципах: - скорость химической реакции пропорциональна концентрации реагентов; - суммарная скорость нескольких превращений, широко различающихся по скорости, определяется скоростью наиболее медленной стадии. |

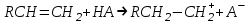 ;
;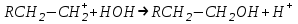 ;
;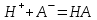 .
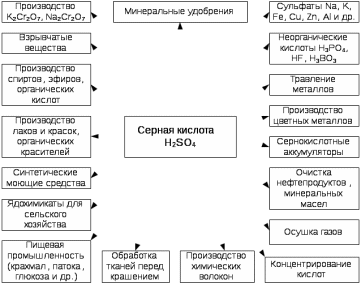
.
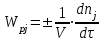 ,
,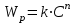 ,
,