шпаргалка по охт. 1. Технологические показатели и их роль в управлении технологическим процессом
 Скачать 0.82 Mb. Скачать 0.82 Mb.
|
|
21.Молекулярность и порядок реакции Реакции, протекающие в одну сторону, можно классифицировать следующим образом: - По порядку уравнения для скорости реакции – по порядку реакции. Порядком реакции называется сумма показателей степеней в кинетическом уравнении реакции; - По числу частиц, принимающих участие в элементарном акте, - по молекулярности реакции. Для простых реакций порядок и молекулярность совпадают только в случае реакций, протекающих в соответствии с уравнением реакции и имеют цельночисленные значения. В подавляющем большинстве случаев, молекулярность и порядок реакции не совпадают. Это объясняется тем, что стехиометрическое уравнение реакции, описывающее процесс в целом, не в состоянии отразить истинного механизма реакции, протекающей, как правило, в особенности у сложных реакций, через ряд последовательных стадий. Классификация реакций по их молекулярности: мономолекулярные 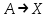 ; ; 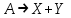 ; ;бимолекулярные 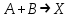 ; ; 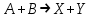 ; ;тримолекулярные 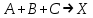 . .Сложные реакции подразделяются следующим образом: Обратимые реакции 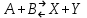 ; ;Параллельные реакции 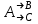 ; ; 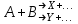 ; при параллельных химических реакциях скорость всего процесса будет определяться в первую очередь скоростью наиболее быстрой его стадии; ; при параллельных химических реакциях скорость всего процесса будет определяться в первую очередь скоростью наиболее быстрой его стадии;Сопряженные реакции 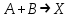 (а) и (а) и 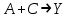 (б); они отличаются тем, что одна из них – (а) идет самопроизвольно, а другая, например (б), только в присутствии первой; (б); они отличаются тем, что одна из них – (а) идет самопроизвольно, а другая, например (б), только в присутствии первой;Последовательные реакции 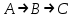 , , 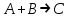 ; если в последовательных реакциях скорость одной из химических стадий значительно меньше скоростей других, то скорость всего процесса будет определяться самой медленной стадией. ; если в последовательных реакциях скорость одной из химических стадий значительно меньше скоростей других, то скорость всего процесса будет определяться самой медленной стадией.Для химических реакций в гетерогенных условиях порядок реакции может иметь как целочисленное значение (1, 2, 3), так быть больше и меньше единицы. Например, частный случай, когда 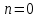 . Тогда скорость реакции не определяется концентрацией компонентов, т.к. . Тогда скорость реакции не определяется концентрацией компонентов, т.к. 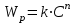 , а , а 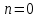 , тогда , тогда 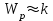 . Процесс описывается в данном случае кинетическим уравнением типа: . Процесс описывается в данном случае кинетическим уравнением типа: 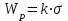 , где , где 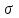 - поверхностная концентрация реагирующих соединений на твердой (жидкой) фазе.Вид кинетического уравнения (зависимости скорости реакции от концентраций реагентов) позволяет классифицировать реакции по порядку. Существуют реакции первого второго, третьего, дробного порядков - поверхностная концентрация реагирующих соединений на твердой (жидкой) фазе.Вид кинетического уравнения (зависимости скорости реакции от концентраций реагентов) позволяет классифицировать реакции по порядку. Существуют реакции первого второго, третьего, дробного порядков
22.Мощность и производительность процесса, аппарата. Основные критерии эффективности ХТП. Технологические показатели, которые характеризуют эффективность работы как отдельных аппаратов, так и цехов и производств в целом: производительность – это количество целевого продукта, полученного в единицу времени: 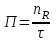 , где , где 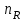 - количество целевого продукта, кг (т, м3); - количество целевого продукта, кг (т, м3);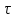 - период наработки продукта, ч (месяц, год). - период наработки продукта, ч (месяц, год).Максимальная производительность – мощность. Практические расходные коэффициенты, производительность, мощность и интенсивность относятся не только к технологическим, но и к экономическим показателям производства. Оценка эффективности процесса в целом осуществляется прежде всего по экономическим показателям: себестоимость целевого продукта, приведенные затраты и пр. Но для оценки отдельных стадий процесса необходимы показатели, отражающие химическую и физико-химическую сущность явлений, идущих в аппаратах. Технологический показатель, отражающий степень использования исходного реагента на химические превращения (конверсия) 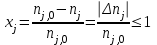 , при этом , при этом 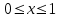 Полная селективность – это отношение количества исходного реагента, расходуемого на целевую реакцию, к общему количеству исходного реагента, пошедшего на все реакции (и целевые и побочные), или
Отношение реально полученного количества продукта к максимально возможному его количеству (при данных условиях процесса) называют выходом продукта в необратимой химической реакции, или в виде:
Между выходом целевого продукта, степенью превращения исходного реагента и селективностью существует простая связь: 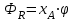 (для необратимых химических реакций), (для необратимых химических реакций),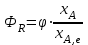 (для обратимых химических реакций). (для обратимых химических реакций).23.Технологический регламент химического производства. Его роль в организации производства. Формирование структуры производства осуществляется в соответствии с техническим (технологическим) проектом данного производства. Составными документами проекта являются: технологический регламент производства, технические условия на целевой продукт (ТУ). Технологический регламент производства является документом, содержащим исходные данные, необходимые и достаточные для реализации технологического процесса производства целевого продукта заданного (по ТУ) качества. Выполняется технологический регламент «разработчиком» данного целевого продукта в соответствии с государственным стандартом. Он включает определенные разделы: общая характеристика производства; техническая характеристика сырья, продуктов, основных и вспомогательных материалов и нормативно-технические документы на них (НТД); химическая схема производства; основные физико-химические и кинетические константы процессов; основные технологические показатели (конверсия, селективность, выход продукта, расходные коэффициенты) отдельных стадий; технологическая схема производства (аппаратурно-технологическая схема со спецификацией по основному и вспомогательному оборудованию); описание технологического процесса по отдельным стадиям, аппаратам; условия ведения процессов (режимы и их контроль); материальный баланс процессов; характеристика отходов производства; удельные номы сырья, материалов, энергии на единицу товарного продукта; санитария и гигиена производства (техника безопасности производства); контроль и управление производством. Основной функцией действующего регламента на производстве является контроль и управление технологическим процессом. «Регламент» действителен на определенный период времени (например, пять лет), после чего он может пересматриваться, изменяться, дополняться (возможна замена оборудования отдельных стадий производства; изменение сырья и пр.). 24.Катализ. Сущность. Виды катализа. Катализ – это способ ускорения химических реакций. Ускорение достигается в 103 – 106 раз. Катализатор – это соединения, вещества, которые, многократно вступая в промежуточное взаимодействие с участниками реакций, изменяют ее механизм и увеличивают скорость реакции, при этом они восстанавливают свой химический состав после каждого цикла промежуточных взаимодействий. Катализаторы не могут вызывать реакций термодинамически невозможных. Но если она возможна, и не идет из-за высокой энергии активации, присутствие катализатора создает условия для ее возникновения. Роль катализатора заключается в замене трудно осуществимого прямого пути течения реакций более легким обходным путем, включающим промежуточное взаимодействие с катализатором. По принципу фазового состояния реагентов и катализатора каталитические процессы разделяют на две основные группы:гомогенные и гетерогенные. При гомогенном катализе и катализатор, и реагенты находятся в одной фазе – газовой или жидкой. При гетерогенном катализе – катализатор и реагенты или продукты реакции находятся в разных фазах. В промышленности чаще применяют твердые катализаторы. Все каталитические реакции гомо- и гетерогенного катализа делят по типу взаимодействия катализатора с реагирующими веществами на два основных класса: окислительно-восстановительное (гомолитическое) и кислотно-основное (гетеролитическое) взаимодействие. Окислительно-восстановительный катализ заключается в обмене электронами между катализатором и реагентами. Кислотно-основнойкатализ заключается в обмене протонами или ионами (катионами или анионами) между катализатором и реагирующими молекулами. К окислительно-восстановительным относятся реакции окисления, гидрирования, дегидрирования. Катализаторами служат металлы – 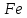 , , 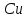 , , 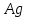 , , 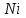 , , 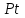 , , 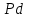 и др. и оксиды металлов переменной валентности – и др. и оксиды металлов переменной валентности –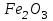 , , 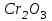 , , 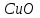 , , 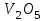 и др.К кислотно-основным относятся реакции: гидратации и дегидратации, гидролиза, полимеризации, поликонденсации, крекинга, изомеризации, алкилирования. Типичные катализаторы кислотно-основных реакций - кислоты и основания, в т.ч. и др.К кислотно-основным относятся реакции: гидратации и дегидратации, гидролиза, полимеризации, поликонденсации, крекинга, изомеризации, алкилирования. Типичные катализаторы кислотно-основных реакций - кислоты и основания, в т.ч.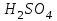 , , 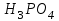 , , 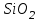 , , 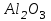 , , 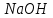 и др.Сложные многокомпонентные катализаторы могут одновременно ускорять как окислительно-восстановительные, так и кислотно-основные реакции – бифункциональные катализаторы ( и др.Сложные многокомпонентные катализаторы могут одновременно ускорять как окислительно-восстановительные, так и кислотно-основные реакции – бифункциональные катализаторы (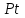 на фторированном на фторированном 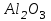 , оксид молибдена на , оксид молибдена на 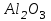 , , 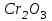 на на 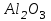 ) – риформинг (дегидрирование нафтенов, изомеризация, дегидроциклизация парафиновых и др.) с получением высокооктановых бензинов и получение ароматических углеводородов. ) – риформинг (дегидрирование нафтенов, изомеризация, дегидроциклизация парафиновых и др.) с получением высокооктановых бензинов и получение ароматических углеводородов.25.Время контактирования и его оценка в реальном аппарате. Характер изменения концентрации реагирующих веществ в реакционном объеме различен в каждый момент времени в разных точках объема аппарата, но постоянен во времени для одной и той же точки объема. Величина, обратная времени пребывания (контакта) продуктов реакции в аппарате, называется объемной скоростью ( 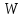 ), которую можно использовать в качестве производительности ( ), которую можно использовать в качестве производительности (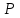 ) непрерывно действующего аппарата. ) непрерывно действующего аппарата.Принято время химического взаимодействия в аппарате обозначать как время контактирования ( 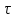 ), которое будет определяться из следующего выражения: ), которое будет определяться из следующего выражения:
где 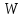 - объемная скорость сырьевого потока, ч-1 (с-1); - объемная скорость сырьевого потока, ч-1 (с-1); 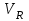 - объем химического реактора, м3 (л); - объем химического реактора, м3 (л); 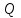 - объемный расход, м3/ч (мл/с). - объемный расход, м3/ч (мл/с).26.Промышленные катализаторы. Технологические характеристики, производство. Катализаторы могут быть твердыми, жидкими, газообразными. В промышленности чаще используют твердые катализаторы. Промышленные твердые катализаторы не являются индивидуальными веществами. Они представляют собой, как правило, сложную смесь, которая называется контактной массой. В этой массе одни вещества являются собственно катализаторами, а другие служат активаторами (модификаторами) и носителями. Активаторы (промоторы) – вещества, повышающие активность основного катализатора. Активатор может увеличивать поверхность каталитически активного вещества или повышает термостойкость катализатора, или защищает от действия контактных ядов. Носители (трегеры) – термостойкие, прочные, пористые вещества, на которые наносят катализатор. Они обеспечивают развитую поверхность катализатора, термостойкость, экономию дорогостоящих каталитических веществ – таких как платина, палладий, серебро и др. В качестве носителя часто используют оксид алюминия, силикагель, синтетические алюмосиликаты, каолин, асбест, активный уголь, цеолиты. Достаточно высокая активность, стойкость к действию ядов, избирательность, стабильность в работе, достаточная теплопроводность, термостойкость, механическая прочность и срок службы, малая стоимость и энергозатратность (температура зажигания). К катализаторам реакторов кипящего слоя предъявляются дополнительные требования – высокая износоустойчивость зерен при ударах и трении друг о друга, стенки реактора и теплообменных устройств. Способы производства: Осаждение гидроксидов или карбонатов из растворов их солей совместно с носителем или без носителя с последующим формованием и прокаливанием контактной массы (осажденные катализаторы). Смешение и совместное прессование порошков катализаторов с активаторами и носителями и вяжущими веществами. Сплавление нескольких веществ (металлов или оксидов) с последующим восстановлением металлов из оксидов водородом. Иногда катализатор готовят в виде тончайших сеток из сплавов различных металлов. Пропитка пористого носителя раствором, содержащим катализатор и активатор, с последующей сушкой и прокалкой. В качестве катализаторов применяют так же некоторые минералы и их смеси. Например, алюмосиликаты, оксиды железа, бокситы и т.п. 27.Характеристика химического реактора по тепловому режиму. В процессе химической реакции идет или выделение тепла, или его поглощение. Возникает разность температур между реактором и окружающей средой. Разность температур является движущей силой теплообмена.В адиабатическом реакторе имеет место наибольший перепад температур реагирующих веществ на входе и выходе из аппарата, который возрастает для экзотермических процессов и убывает для эндотермических. В нем полностью отсутствует теплообмен с окружающей средой. Температурный режим процесса в любой точке по высоте (длине) реактора описывается уравнением:
где 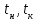 - начальная и конечная температуры реакционной смеси; - начальная и конечная температуры реакционной смеси;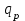 - тепловой эффект при полном превращении исходного сырья или при полном переходе основного компонента из одной фазы в другую в гетерогенных процессах; - тепловой эффект при полном превращении исходного сырья или при полном переходе основного компонента из одной фазы в другую в гетерогенных процессах; 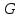 - общая масса сырья; - общая масса сырья;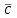 - средняя удельная теплоемкость в интервале рабочих температур; - средняя удельная теплоемкость в интервале рабочих температур; 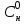 - начальная концентрация исходного сырья; - начальная концентрация исходного сырья;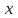 - степень превращения (конверсия) сырья.По типу, близкому к адиабатическому реактору вытеснения, работают контактные аппараты с фильтрующим слоем катализатора, камерные реакторы для гомогенных превращений, прямоточные абсорберы с изолирующей футеровкой и др. - степень превращения (конверсия) сырья.По типу, близкому к адиабатическому реактору вытеснения, работают контактные аппараты с фильтрующим слоем катализатора, камерные реакторы для гомогенных превращений, прямоточные абсорберы с изолирующей футеровкой и др.
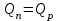 ). На практике такой тепловой режим работы реактора может быть достигнут лишь в условиях полного перемешивания реагирующих веществ. В качестве примера можно назвать реактор с «кипящим» слоем катализатора для получения изооктана. Или реактор, где тепловой режим поддерживается при помощи теплообменных устройств, а подведение или отведение теплоты рассчитывается по уравнению: ). На практике такой тепловой режим работы реактора может быть достигнут лишь в условиях полного перемешивания реагирующих веществ. В качестве примера можно назвать реактор с «кипящим» слоем катализатора для получения изооктана. Или реактор, где тепловой режим поддерживается при помощи теплообменных устройств, а подведение или отведение теплоты рассчитывается по уравнению: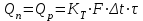 , где , где 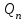 - количество теплоты, необходимое для осуществления процесса (подвести или отвести) в реакторе.Реактор, в котором поддержание необходимой температуры осуществляется только за счет теплоты химического процесса без использования внешних источников энергии (автотермический).В политропическом реакторе тепловой режим (изменение температуры в реакционном объеме) будет определяться не только собственно тепловым эффектом процесса химического превращения вещества, но и, в неменьшей степени, теплотехническими и конструктивными факторами реакционной аппаратуры. - количество теплоты, необходимое для осуществления процесса (подвести или отвести) в реакторе.Реактор, в котором поддержание необходимой температуры осуществляется только за счет теплоты химического процесса без использования внешних источников энергии (автотермический).В политропическом реакторе тепловой режим (изменение температуры в реакционном объеме) будет определяться не только собственно тепловым эффектом процесса химического превращения вещества, но и, в неменьшей степени, теплотехническими и конструктивными факторами реакционной аппаратуры. |

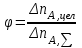 .
.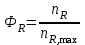 ,
,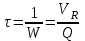 (ч, с),
(ч, с),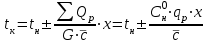 ,
,