шпаргалка по охт. 1. Технологические показатели и их роль в управлении технологическим процессом
 Скачать 0.82 Mb. Скачать 0.82 Mb.
|
|
36.Расходные коэффициенты и их разновидности. Различают теоретические (стехиометрические) и практические (затраты сырья, материалов, энергии на единицу массы целевого продукта) расходные коэффициенты: теоретические рассчитывают по уравнению реакции: 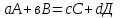 , ,где 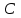 – целевой продукт; – целевой продукт;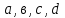 - стехиометрические коэффициенты. - стехиометрические коэффициенты.Тогда 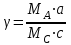 , ,где 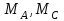 - молекулярные массы сырья ( - молекулярные массы сырья ( ) и целевого продукта ( ) и целевого продукта ( ); );практические расходные коэффициенты рассчитываются из данных материального баланса как отношение массы затраченного сырья (  или или 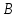 ) к массе полученного целевого продукта ( ) к массе полученного целевого продукта (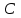 ): ):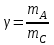 . .37.Основные тенденции развития современной химической промышленности. Основные тенденции в развитии химической промышленности связаны с решением глобальных проблем человечества. Восполнение и расширение пищевых ресурсов: биотехнология, с помощью которой будут создаваться кормовые, пищевые добавки, витамины лекарства. Решение энергетических проблем: водородные технологии (топливо, синтез микробного белка (водородокисляющие бактерии)); ядерная энергетика; нетрадиционные источники энергии – солнечная, ветровая, энергия быстро воспроизводимой биомассы и пр. Защита (охрана) окружающей человечество среды обитания на Земле: решение проблемы изменения климата (глобальное потепление) и разрушение озонового слоя. Решение экологических задач путем совершенствования технологических процессов: комплексного и эффективного использования сырья; глубокой рекуперации тепла химических и физических реакций при снижении энергоемкости производства в целом. 38.Энергетическая диаграмма каталитического и некаталитического процесса. Катализ – это способ ускорения химических реакций. Ускорение достигается в 103 – 106 раз.Катализатор – это соединения, вещества, которые, многократно вступая в промежуточное взаимодействие с участниками реакций, изменяют ее механизм и увеличивают скорость реакции, при этом они восстанавливают свой химический состав после каждого цикла промежуточных взаимодействий. Катализаторы не могут вызывать реакций термодинамически невозможных. Но если она возможна, и не идет из-за высокой энергии активации, присутствие катализатора создает условия для ее возникновения.Роль катализатора заключается в замене трудно осуществимого прямого пути течения реакций более легким обходным путем, включающим промежуточное взаимодействие с катализатором. Проиллюстрируем это рисунком 9.1., где представлены кривые: 2 – реакционный путь без катализатора и 2 – реакционный путь с катализатором.
39. Уравнение Аррениуса, его применение. Формальная кинетика рассматривает процесс, не интересуясь механизмом реакции, чисто количественно описывает результат всех стадий, всех превращений, результат всей реакции в целом. Поэтому конечной задачей формальной кинетики является составление уравнения для расчета константы скорости данной реакции, т.е. уравнения, позволяющего в любой момент времени рассчитать скорость реакции как функцию концентрации. Законы химической кинетики основаны на двух простых принципах:скорость химической реакции пропорциональна концентрации реагентов;суммарная скорость нескольких превращений, широко различающихся по скорости, определяется скоростью наиболее медленной стадии.Проведение экспериментов при различных температурах (не менее 3-х) позволяет установить значения констант скорости реакции как функции температуры ( 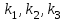 ). Или возможен расчет значения ). Или возможен расчет значения 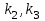 при при 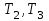 , если известно значение , если известно значение 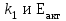 для данной химической реакции. При этом используется уравнение Аррениуса (для процессов идущих в кинетической области при невысоких температурах) для данной химической реакции. При этом используется уравнение Аррениуса (для процессов идущих в кинетической области при невысоких температурах)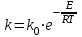 или или 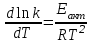 , , где 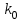 - предэкспоненциальный множитель; - предэкспоненциальный множитель;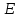 - энергия активации; - энергия активации; 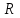 - универсальная газовая постоянная; - универсальная газовая постоянная; 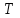 - температура. - температура.Более удобной формой для расчетов является интегральная форма этого уравнения 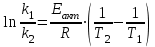 , ,где 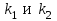 - константы скорости реакции, соответствующие абсолютным температурам - константы скорости реакции, соответствующие абсолютным температурам 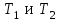 . .Соответственно, можно рассчитать и температурный коэффициент скорости реакции 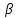 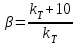 .Для определения данных показателей используется логарифмическая форма уравнения Аррениуса ( .Для определения данных показателей используется логарифмическая форма уравнения Аррениуса (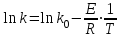 ). ).40.Скорость гетерогенной химической реакции. Гетерогенные химические процессы основаны на реакциях между реагентами, находящимися в разных фазах. Химические реакции являются одной из стадий гетерогенного процесса и протекают после перемещения реагентов к поверхности раздела фаз, а в ряде случаев и через межфазную поверхность. Большинство промышленных химико-технологических процессов относится к гетерогенным. Механизм гетерогенных процессов сложнее гомогенных, так как взаимодействию реагентов, находящихся в разных фазах, предшествует их доставка к поверхности раздела фаз и массообмен между фазами. Поэтому скорость гетерогенных некаталитических процессов, как правило, меньше скорости гомогенных процессов. Гетерогенный катализ является сложным многостадийным процессом, каждая стадия которого имеет свою скорость (может быть лимитирующей). Весь процесс можно разделить на пять стадий: 1) диффузия реагирующих веществ к поверхности катализатора; 2) адсорбция на адсорбционных центрах; 3) химическая реакция на поверхности; 4) десорбция продуктов реакции с поверхности; 5) диффузия продуктов реакции в объем раствора или газа. Многие гетерогенные процессы не связаны с химическими реакциями и основаны только на физико-химических явлениях. К таким процессам можно отнести испарение без изменения состава, конденсацию, перегонку, растворение, экстракцию. Важными технологическими показателями промышленных процессов служат равновесный выход продукта, определяемый равновесием при данных условиях и фактический выход продукта, определяемый как равновесием, так и скоростью процесса. Скорость гетерогенных процессов характеризуется величиной фактического выхода продукта или коэффициентом скорости процесса в кинетическом уравнении. Химическим факторами являются константы скоростей химических реакций. К физическим и гидродинамическим относятся величина межфазной поверхности, коэффициент диффузии и другие физические свойства реагентов и продуктов реакции, геометрические параметры аппаратов, факторы, влияющие на турбулентность системы. Скорость процесса в целом будет определяться скоростью наиболее медленной стадии. Если скорость реакции на поверхности катализатора больше скорости диффузии, то скорость процесса в целом будет определяться скоростью диффузии. Если скорость химической реакции значительно меньше, чем скорость диффузии, то скорость процесса в целом будет определяться скоростью химической реакции. В этом случае процесс лежит в кинетической области и описывается уравнением кинетики той реакции, которая протекает на поверхности катализатора. Если скорость диффузии и скорость химической реакции, рассмотренные независимо друг от друга, соизмеримы, то имеется переходная область. Один и тот же процесс в зависимости от условий его проведения может лежать в различных областях. Большое влияние на характер протекания гетерогенного химического процесса оказывают давления реагирующих веществ, скорости потоков, пористость катализатора и температура. 41.Лимитирующая стадия и области протекания гетерогенного процесса. Гетерогенные химические процессы основаны на реакциях между реагентами, находящимися в разных фазах. Химические реакции являются одной из стадий гетерогенного процесса и протекают после перемещения реагентов к поверхности раздела фаз, а в ряде случаев и через межфазную поверхность. Большинство промышленных химико-технологических процессов относится к гетерогенным. Механизм гетерогенных процессов сложнее гомогенных, так как взаимодействию реагентов, находящихся в разных фазах, предшествует их доставка к поверхности раздела фаз и массообмен между фазами. Химические гетерогенные процессы включают в качестве этапа химические реакции, которые идут в одной из фаз после перемещения туда реагентов или на поверхности раздела фаз. На гетерогенные равновесия влияют температура, давление, концентрации реагентов и продуктов реакции. Равновесие гетерогенных процессов определяется константой равновесия химических реакций, законом распределения компонентов между фазами и правилом фаз. Гетерогенные процессы, сопровождаемые химической реакцией могут быть: 1) когда химическая реакция протекает на поверхности раздела фаз, этот тип характерен для процессов с участием твердой фазы: Т-Ж, Т-Г, Г-Ж-Т и др.; 2) когда химические реакции протекают в объеме одной из фаз после переноса в нее вещества из другой, такие процессы наиболее распространены и могут идти с участием любых фаз в системах Г-Ж, Ж-Ж (несмешивающихся), Т-Ж, Г-Ж-Т и др.; 3) когда реакция происходит на поверхности вновь образующейся фазы, этот тип возможен для процессов взаимодействия твердых фаз. Реакторы для проведения низкотемпературных некаталитических гетерогенных процессов не имеют характерных особенностей и аналогичны типовым аппаратам, в которых осуществляются физические процессы. Гетерогенная химическая реакция может протекать только в том случае, если происходит непрерывная молекулярная или конвективная диффузия реагирующих веществ к поверхности, на которой идет данная реакция, и непрерывная обратная диффузия продуктов реакции. Скорость процесса в целом будет определяться скоростью наиболее медленной стадии. Если скорость реакции на поверхности катализатора больше скорости диффузии, то скорость процесса в целом будет определяться скоростью диффузии. Наблюдаемая макроскопическая кинетика реакции будет подчиняться уравнениям, которые можно получить, рассматривая только процессы диффузии, и, следовательно, не будет отражать истинной скорости химической реакции на поверхности катализатора. В этом случае говорят, что процесс лежит в диффузионной области. Процесс при этом чаще всего описывается уравнением реакции первого порядка, так как скорость диффузии прямо пропорциональна концентрации. Если скорость химической реакции значительно меньше, чем скорость диффузии, то скорость процесса в целом будет определяться скоростью химической реакции. В этом случае процесс лежит в кинетической области и описывается уравнением кинетики той реакции, которая протекает на поверхности катализатора. Если скорость диффузии и скорость химической реакции, рассмотренные независимо друг от друга, соизмеримы, то имеется переходная область. Один и тот же процесс в зависимости от условий его проведения может лежать в различных областях. Большое влияние на характер протекания гетерогенного химического процесса оказывают давления реагирующих веществ, скорости потоков, пористость катализатора и температура. 42.Способы ускорения гетерогенно-каталитических процессов, протекающих в разных областях. Каталитический гетерогенный процесс протекает в диффузионной области при большом диаметре зерен катализатора, малой линейной скорости газа относительно катализатора и очень высоких температурах.Установить влияние линейной скорости на процесс можно, изменив одновременно в аппарате высоту засыпки катализатора 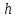 (например, увеличив ее в 2 раза) и одновременно увеличив расход подачи сырья также в 2 раза. При этом сохраняется постоянными концентрация реагентов, температура процесса и время контакта. Изменяется лишь линейная скорость в аппарате, т.к.: (например, увеличив ее в 2 раза) и одновременно увеличив расход подачи сырья также в 2 раза. При этом сохраняется постоянными концентрация реагентов, температура процесса и время контакта. Изменяется лишь линейная скорость в аппарате, т.к.: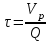 или или 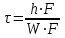 ,где ,где 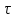 - время контакта, с (ч); - время контакта, с (ч); 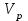 - объем реакционной зоны, м3; - объем реакционной зоны, м3; 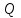 - расход сырья, м3/ч; - расход сырья, м3/ч; 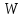 - линейная скорость в аппарате, м/с; - линейная скорость в аппарате, м/с; 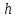 - высота засыпки катализатора, м; - высота засыпки катализатора, м;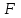 - сечение аппарата, м2, т.е., во сколько раз увеличили высоту реакционной зоны аппарата, во столько раз увеличили линейную скорость. В свою очередь линейная скорость влияет на толщину ламинарного слоя газообразного сырья на зерне катализатора и, следовательно, на процесс внешней диффузии. - сечение аппарата, м2, т.е., во сколько раз увеличили высоту реакционной зоны аппарата, во столько раз увеличили линейную скорость. В свою очередь линейная скорость влияет на толщину ламинарного слоя газообразного сырья на зерне катализатора и, следовательно, на процесс внешней диффузии. Для оптимизации практических процессов устанавливается такой гидродинамический режим подачи сырья, при котором максимально снижается внешнедиффузионное торможение, а внутридиффузионное торможение устраняется на стадии приготовления катализатора – созданием широких транспортных пор, выбором соответствующего размера зерна катализатора ( 3-5 мм).При изменении температуры на 10 °С скорость диффузии, как показывает опыт, изменяется приблизительно в 1,2 раза, а скорость химической реакции — в 3—4 раза. Поэтому при понижении температуры скорость химической реакции убывает быстрее, чем скорость диффузии, и при низких температурах процесс чаще протекает в кинетической области. Этот участок обычно характеризуется значительной величиной энергии активации. Чем больше поверхность соприкосновения, тем быстрее протекает реакция. Поверхность твердых веществ может быть увеличена путем их измельчения, а для растворимых веществ - путем их растворения. 43.Способы смещения равновесия. Изменение химического равновесия достигается изменением внешних условий. Направленность влияния определяется правилом, называемым принципом Ле-Шателье. Он состоит в том, что если воздействовать на систему, находящуюся в химическом равновесии, то состояние системы изменится таким образом, что это воздействие ослабляется.Влияние давления определяется законом разности числа молей газообразных участников реакции ( 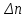 ) или знаком изменения объема ( ) или знаком изменения объема (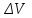 ). При ). При 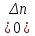 (число молей продуктов превышает число молей реагентов) увеличение давления неблагоприятно (равновесие будет смещаться в сторону реагентов). Чтобы реакция пошла вправо (в сторону целевого продукта) необходимо уменьшить давление на газовую систему. И напротив, если реакция идет с уменьшением числа молей ( (число молей продуктов превышает число молей реагентов) увеличение давления неблагоприятно (равновесие будет смещаться в сторону реагентов). Чтобы реакция пошла вправо (в сторону целевого продукта) необходимо уменьшить давление на газовую систему. И напротив, если реакция идет с уменьшением числа молей (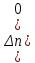 ), повышение давления технологически оправдано, так как способствует увеличению выхода целевого продукта. Изменять давление в газовых системах (и тем самым равновесие) можно, используя прием разбавления газовой системы инертным газом (будет эффект снижения общего давления). Поэтому в технологических процессах, где ), повышение давления технологически оправдано, так как способствует увеличению выхода целевого продукта. Изменять давление в газовых системах (и тем самым равновесие) можно, используя прием разбавления газовой системы инертным газом (будет эффект снижения общего давления). Поэтому в технологических процессах, где 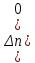 выводят из системы инертные газы. выводят из системы инертные газы.Влияние концентрации. В соответствии с принципом Ле-Шателье введение в равновесную систему дополнительных количеств какого-либо вещества вызывает смещение равновесия, при котором концентрация этого вещества уменьшается. С учетом этого, целесообразно выводить из продуктовой смеси целевой продукт, что будет смещать реакцию в сторону его образования. Для увеличения степени конвертирования дорогого или дефицитного сырьевого компонента в избытке берут более дешевый сырьевой компонент. Влияние температуры. Смещение равновесия при изменении температуры зависит от знака теплового эффекта реакции. Так повышение температуры всегда положительно, если реакция идет с поглощением тепла. Необходимо отметить, что влияние на ХТП с помощью управляющих параметров (расход сырья, отвод продуктов, 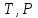 ) будет тем заметнее, чем большим тепловым эффектом или чем большим объемным изменением (или ) будет тем заметнее, чем большим тепловым эффектом или чем большим объемным изменением (или 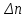 ) сопровождается процесс. ) сопровождается процесс.44.Термодинамический анализ процесса: 2SO2 + O2 → 2SO3.
Начальная концентрация перерабатываемого газа выбирается так, чтобы режим процесса находился в пределах рабочих температур катализатора. Большое значение 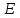 при при 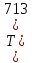 К приводит к резкому уменьшению скорости реакции с понижением температуры. Чтобы адиабатический процесс в первом слое мог интенсивно развиваться, начальная температура должна быть не ниже 713 К. Ее называют «температурой зажигания» (для низкотемпературных катализаторов она ниже). На диаграмме « К приводит к резкому уменьшению скорости реакции с понижением температуры. Чтобы адиабатический процесс в первом слое мог интенсивно развиваться, начальная температура должна быть не ниже 713 К. Ее называют «температурой зажигания» (для низкотемпературных катализаторов она ниже). На диаграмме «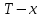 » адиабатический процесс представлен прямой линией. Наклон ее определен величиной адиабатического разогрева » адиабатический процесс представлен прямой линией. Наклон ее определен величиной адиабатического разогрева 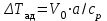 . Для окисления . Для окисления 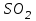 приближенно приближенно 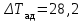 град на 1 % град на 1 % 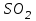 . Чем больше . Чем больше 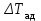 (или начальная концентрация (или начальная концентрация 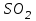 - - 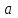 ), тем больше разогрев. Процесс может развиваться до равновесия, и максимальная (равновесная) температура не должна превышать допустимую. На рис. 15.10 это соответствует начальной концентрации ), тем больше разогрев. Процесс может развиваться до равновесия, и максимальная (равновесная) температура не должна превышать допустимую. На рис. 15.10 это соответствует начальной концентрации 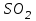 7-8 %. Низкотемпературный катализатор позволяет поднять концентрацию до 9-10 %. Температуры в остальных слоях определяют из оптимизации режима реактора. 7-8 %. Низкотемпературный катализатор позволяет поднять концентрацию до 9-10 %. Температуры в остальных слоях определяют из оптимизации режима реактора. |

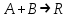 - одностадийная химическая реакция с энергией активации -–
- одностадийная химическая реакция с энергией активации -–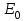 , идущая без катализатора;
, идущая без катализатора;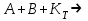 :
: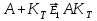 - образование промежуточного активированного комплекса с энергией активации
- образование промежуточного активированного комплекса с энергией активации 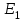 ;
;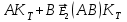 - активированный комплекс
- активированный комплекс 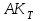 реагирует со вторым реагентом;
реагирует со вторым реагентом;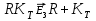 - разложение комплекса
- разложение комплекса 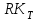 с образованием продукта реакции и освобождение катализатора дляновогоцикла
с образованием продукта реакции и освобождение катализатора дляновогоцикла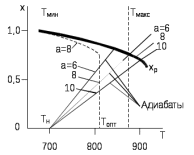
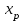 - равновесные степени превращения;
- равновесные степени превращения; 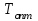 - оптимальная температура;
- оптимальная температура; 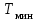 ,
, 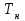 - начальная температура в слое катализатора;
- начальная температура в слое катализатора;