Шпоры итоговая №1. 1. Токсикология как наука. Основная токсикологическая терминология. Теоретическая токсикология. Клиническая токсикология. Судебная токсикология. Военная токсикология, Экологическая токсикология. Токсикологическая химия
 Скачать 214.19 Kb. Скачать 214.19 Kb.
|
1 Этап клинико-биохимических исследований - преаналитический.На данном этапе нужно соблюдать 3 условия:
2 Этап клинико-биохимических исследований - аналитический.На этом этапе важно:
3 этап клинико-биохимических исследований – постаналитический, на этом этапе необходимо обращать внимание на следующее:
12.Клиническая интерпретация лабораторных данных. Базы данных Helix и In vitro, приложения из Google Play. Я хз 13.Выполнение химико-токсикологических исследований в КДЛ Порядок проведения химико-токсикологических исследований при медицинском освидетельствовании17. Химико-токсикологические исследования отобранных проб биологических объектов проводятся в химико-токсикологических лабораториях наркологических диспансеров (наркологических больниц), иных медицинских организаций (далее – лаборатория) при наличии у указанных организаций лицензии на осуществление медицинской деятельности, предусматривающей выполнение работ (услуг) по клинической лабораторной диагностике. Сроки проведения химико-токсикологических исследований не должны превышать четырнадцать рабочих дней с момента поступления пробы биологического объекта в лабораторию. 18. Химико-токсикологические исследования пробы биологического объекта при медицинском освидетельствовании проводятся на следующие группы химических веществ, включая их метаболиты: опиаты (6-моноацетилморфин, морфин, кодеин, дезоморфин и др.), каннабиоиды, фенилалкиламины (амфетамин, метамфетамин, мефедрон и др.), кокаин, метадон, бензодиазепины, барбитураты, а также на другие группы химических веществ, которые идентифицируются как вещества, вызывающие опьянение. Заключение о наличии или отсутствии в пробе биологического объекта наркотических средств и (или) психотропных веществ, иных химических веществ (в том числе лекарственных средств для медицинского применения) выносится с учетом уровней пороговых значений этих средств (веществ) и их метаболитов, указанных в приложении к настоящему Порядку. 19. Химико-токсикологические исследования пробы биологического объекта (мочи) проводятся в два этапа: 1) предварительные исследования иммунохимическими методами с применением технических средств регистрации, обеспечивающих обнаружение наркотических средств, психотропных веществ, иных химических веществ и их метаболитов на уровне порогового значения, указанного в Таблице 1 приложения к настоящему Порядку, и запись количественного содержания выявленных химических веществ на бумажном носителе, зарегистрированных Федеральной службой по надзору в сфере здравоохранения; 2) подтверждающие исследования методами газовой или жидкостной хроматографии с масс-спектрометрическим детектированием. 20. При получении по результатам предварительных исследований пробы биологического объекта (мочи) количественного результата ниже уровня порогового значения, установленного в Таблице 1 приложения к настоящему Порядку: 1) в случае, если в Направлении предварительный клинический диагноз указывает на выявление состояния наркотического опьянения или иного токсического опьянения либо в качестве цели проведения химико-токсикологических исследований определено обнаружение химических веществ, не обозначенных в Таблице 1 приложения к настоящему Порядку, проводятся химико-токсикологические исследования подтверждающими методами, направленные на выявление других (помимо указанных в Таблице 1 приложения к настоящему Порядку) наркотических средств, психотропных веществ и иных химических веществ, которые идентифицируются как вещества, вызывающие опьянение; 2) в случае, если в Направлении отсутствуют сведения, указанные в подпункте 1 настоящего пункта, дальнейшие исследования не проводятся, результат считается отрицательным, выносится заключение об отсутствии в исследованной пробе биологического объекта наркотических средств, психотропных веществ и иных химических веществ, которые идентифицируются как вещества, вызывающие опьянение. При получении по результатам предварительных исследований пробы биологического объекта (мочи) количественного результата, равного или превышающего уровень порогового значения, установленный в Таблице 1 приложения к настоящему Порядку, проводятся подтверждающие исследования. 21. При получении по результатам подтверждающих исследований пробы биологического объекта (мочи) количественного результата, равного или превышающего уровень порогового значения, установленный в Таблице 2 приложения к настоящему Порядку, результат считается положительным, выносится заключение о наличии в исследованной пробе биологического объекта наркотических средств и (или) психотропных веществ, иных химических веществ, которые идентифицируются как вещества, вызывающие опьянение, с указанием выявленного средства (вещества). При получении по результатам подтверждающих исследований пробы биологического объекта (мочи) количественного результата ниже уровня порогового значения, установленного в Таблице 2 приложения к настоящему Порядку, результат считается отрицательным, выносится заключение об отсутствии в исследованной пробе биологического объекта наркотических средств, психотропных веществ и иных химических веществ, которые идентифицируются как вещества, вызывающие опьянение. 22. Результаты химико-токсикологических исследований отражаются в справке о результатах химико-токсикологических исследований (учетная форма № 454/у-06), которая оформляется в двух экземплярах по форме и в порядке, утвержденным приказом Министерства здравоохранения и социального развития Российской Федерации от 27 января 2006 г. № 40 «Об организации проведения химико-токсикологических исследований при аналитической диагностике наличия в организме человека алкоголя, наркотических средств, психотропных и других токсических веществ». Один экземпляр справки о результатах химико-токсикологических исследований представляется в медицинскую организацию, направившую в лабораторию пробу биологического объекта, отобранную у освидетельствуемого, второй экземпляр указанной справки хранится в лаборатории. По желанию освидетельствуемого ему выдается копия справки о результатах химико-токсикологических исследований. 23. Полученные результаты химико-токсикологических исследований указываются в пункте 16 Акта, после чего выносится окончательное медицинское заключение. Оригинал справки о результатах химико-токсикологических исследований приобщается ко второму экземпляру Акта, копия указанной справки – к первому. 14.Принципы идентификации химических веществ Химическая идентификация (обнаружение) – это установление вида и состояния фаз, молекул, атомов, ионов и др. составных частей вещества, на основе сопоставления экспериментальных и соответствующих справочных данных для извесных веществ. Идентификация – цель качественного анализа. Обычно определяется комплекс свойств веществ: цвет, вязкость, фазовое состояние, плотность, температура плавления, кипения, растворимость, электродный потенциал, энергию ионизации. Идентификация катионов и анионов неорганических веществ. Методы качественного анализа базируются на ионных реакциях, которые позволяют идентифицировать элементы в форме тех или иных ионов. В ходе реакций образуются труднорастворимые соединения, окрашенные комплексные соединения, происходит окисление или восстановление с изменением цвета раствора. Для идентификации с помощью образования труднорастворимых соединений используют как групповые, так и индивидуальные осадители. Групповыми осадителями для ионов Ag+, Pb2+, Hg2+ служит NaCl; для ионов Ca2+, Sr2+, Ba2+, - (NH4)2CO3, для ионов Al3+, Cr3+, Fe2+, Mn2+, Co2+, Ni2+, Zn2+ и др. – (NH4)2S. Если присутствует несколько катионов, то проводят дробный анализ, при котором осаждаются все труднорастворимые соединения, а затем обнаруживаются оставшиеся катионы тем или иным методом, либо проводят ступенчатое добавление реагента, при котором сначала осаждаются соединения с наименьшим значением ПР, а затем соединения с более высоким значением ПР. Любой катион можно идентифицировать с помощью определенной реакции, если удалить другие катионы, мешающие этой идентификации. Имеется много органических и неорганических реагентов, образующих осадки или окрашенные комплексные соединения с катионами. Летучие соединения металлов окрашивают пламя горелки в тот или иной цвет. Поэтому, если внести изучаемое вещества на платиновой или нихромовой проволоке в бесцветное пламя горелки, то происходит окрашивание пламени в присутствии в веществе тех или иных элементов, например, в цвета: ярко-желтый (натрий), фиолетовый (калий), кирпично-красный (кальций), карминово-красный (стронций), желто-зеленый (медь или бор), бледно-голубой (свинец или мышьяк). Анионы можно обнаружить дробным анализом. Для этого групповой реагент ступенчато приливают к анализируемому раствору, первыми выпадают в осадок соединения с наименьшими значениями ПР. Отдельные ионы могут быть обнаружены с помощью тех или иных специфических реакций или реагентов. Например, при воздействии на анионы СО32- кислотой протекает реакция с выделением пузырьков диоксида углерода: СО32-+2Н+Н2О+СО2 Как и для катионов, имеются реагенты на те или иные анионы. Таким образом, химическая идентификация вещества базируется в основном на реакциях осаждения, комплексообразования, окисления и восстановления, нейтрализации, при которых происходит выпадение белого или окрашенного осадка, изменение цвета раствора и выделение газообразных веществ. 15.Варианты фотометрического анализа Фотометрия (от греческого photos - свет и metreo - меряю) представляет собой метод количественного анализа, особенно для определения микроколичеств веществ. Метод дает возможность определить концентрацию вещества в растворе в тех случаях, когда вещество имеет собственную окраску либо приобретает окраску путем воздействия на него соответствующего химического реагента. Сущность фотометрического анализа заключается в следующем: определяют уменьшение интенсивности потока монохроматического света (т.е. света с определенной, возможно узкой областью спектра) после прохождения его через определенной толщины слой окрашенного раствора и, учтя законы светопоглощения, делают вывод о концентрации растворенного вещества. Основной закон светопоглощения Бугера-Ламберта-Бера определяет зависимость между поглощением излучения раствором и концентрацией в нем поглощаемого вещества. Основными фотометрическими методами являются колориметрия, фотоэлектроколориметрия и спектрофотометрия. Фотометрическое (колориметрическое) определение окрашенных веществ основано на сравнении окраски или светопоглощения исследуемого раствора и стандартного для которого известно содержание определяемого вещества. Различают колориметрию визуальную - субъективную и фотоэлектрическую - объективную. В первом случае концентрацию вещества в растворе измеряют визуально при помощи компараторов, колориметров сливания, концентрационных колориметров (КОЛ-1М), универсального фотометра ФМ-56 и др. Основным недостатком визуальной колориметрии является малая точность (5-10 относительных процентов). Визуальные методы колориметрических определений являются субъективными; точность их зависит от индивидуальных особенностей зрения наблюдателя. Применение фотоэлектрической колориметрии позволяет при помощи фотоэлементов, заменяющих глаз человека, избежать некоторых ошибок субъективной оценки при исследовании. Принцип фотоэлектроколориметрии состоит в том, что фотоэлементы под действием света дают электрический ток, интенсивность которого пропорциональна силе света. Если между источником света и фотоэлементом поместить светопоглощающую среду (например, окрашенный раствор), то сила фототока уменьшится в зависимости от интенсивности окраски раствора. Составив эмпирический график, в котором дана зависимость между интенсивностью фототока и концентрацией вещества в растворе, можно в каждом отдельном случае по интенсивности полученного фототока сделать заключение о концентрации вещества в растворе. 16.Спектральные характеристики лекарственных и наркотических веществ. Спектрофотомерия в ультрафиолетовой и видимой областях спектра. Дифференциальная спектрофотомерия на примере производных барбитуровой кислоты. Метод экстракционной фотометрии, ИК спектроскопия. Интерпретация результатов идентификации и количественного определения. Спектроскопическое исследование барбитуратов чаще проводят в области длин волн 200-400 нм, т.е. в УФ области спектра, получая электронные спектры поглощения (что обусловлено наличием в структуре системы хромофоров и ауксохромов). Способность барбитуратов к абсорбции в УФ области связана с их таутомерными превращениями. Для 5,5-замещенных производных: 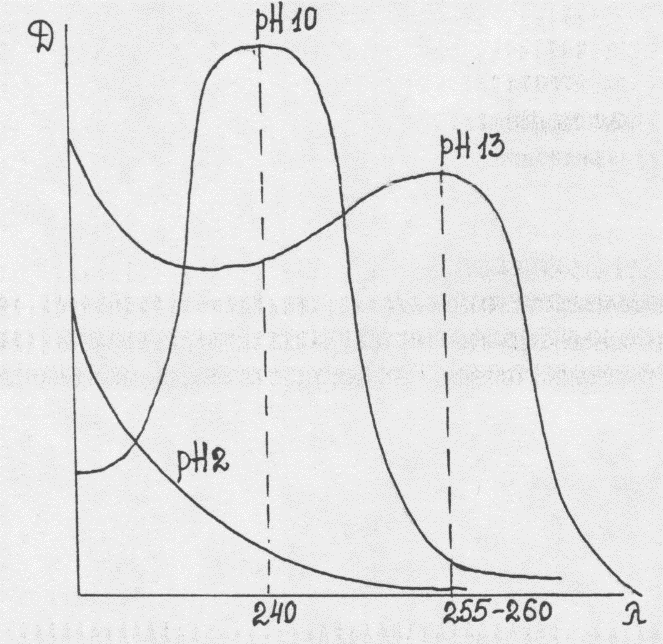 Имидная форма (рН 2) не абсорбирует в УФ области, т.к. здесь отсутствует хромофорная система (система сопряженных простых и двойных связей). Имидольная форма (рН 10) уже имеет такую систему и обладает характерным погло-щением с max=240 нм Диимидольная форма также обладает характерным поглощением с max=255-260нм. Здесь происходит удлинение хромофорной системы за счет образования еще одной двойной связи и, соответственно этому, батохромный сдвиг максимума (в длинноволновую область). В отличие от 5,5-дизамещенных барбитуратов, трехзамещенные имеют лишь одну ионизированную форму (имидольную), поэтому их поглощение не меняется с переходом от рН 10 к рН 13, и они обладают одним максимумом в щелочной среде при длине волны 245 нм. Тиобарбитураты особенно удобны для исследования в УФ области, т.к. имеют два максимума в кислом растворе (239-290 нм), в щелочном при рН=10 также два максимума (255 и 310 нм) и при рН 13 - один (310нм). Таким образом, УФ-спектроскопия дает возможность дифференцировать барбитураты в зависимости от типа замещения в пиримидиновом кольце на: 1. Двузамещенные (рН 2 - нет max, рН 10 - 240 нм, рН 13 -255-260 нм) 2. Трехзамещенные (рН 2 - нет max, рН 10 и рН 13 -245 нм) 3. Тиобарбитураты (рН 2 - 239 нм и 290 нм, рН 10 - 255 и 310 нм, рН 13 - 310 нм). Однако, дифференциация отдельных представителей внутри каждого из типов замещения затруднительна, т.к. их спектры сходны между собой. Применение спектральных методов анализа требует высокой степени чистоты выделенных веществ и должно сочетаться с их хроматографической очисткой. Заключение о присутствии барбитуратов дается по комплексу результатов реакций, ХТС и УФ-спектроскопии. 4 Этап. Для количественного определения барбитуратов в настоящее время используется спектрофотометрический метод. При спектрофотометрическом определении барбитуратов, выделенных из биологического материала, используют принцип дифференциальной спектрофотометрии, т.к. прямому СФ-определению мешают посторонние вещества, извлекающиеся из объекта исследования совместно с барбитуратами. В I варианте концентрацию барбитурата в растворе (после его элюирования с хроматограммы) определяют по разности абсорбций в щелочном - рН 10 и кислом - рН 2 растворах при =240 нм. D=DpH10-DpH2 Во II варианте - по разности абсорбций в щелочных - рН 13 и рН 10 растворах при =260нм. D=DpH13-DpH10 Использование принципа дифференциальной спектрофотометрии возможно, когда поглощение примесей при выбранной длине волны не зависит от рН среды. Тогда при вычитании оптических плотностей происходит уничтожение абсорбции примесей, что дает возможность получать истинные результаты количественного определения. Например, В 1 варианте - DpH 10 = D10 + D10 |
