Шпора по первому разделу желтой книги. 13. Схема Сравнительная характеристика клеточной стенки грам и грам типа
 Скачать 1.03 Mb. Скачать 1.03 Mb.
|
|
«Обязательные» структуры: 1-нуклеоид; 2-клеточная стенка; 3-цитоплазматическая мембрана; 4- мезосома; 5-рибосомы. «Необязательные» структуры:1-плазмида (R); 2-включения (волютин); 3-капсула; 4-жгутики; 5-пили. 1- Два типа строения клеточной стенки: грам+ и грам- бактерий 2- Первый тип - «спиртоустойчивая» клеточная стенка, содержащая около 40 слоев пептидогликана и тейхоевые кислоты - полимеры известного состава (описать); второй тип — «спирточувствительная» клеточная стенка, содержащая ок. 1-4 слоя пептидогликана, липопротеины, порины, наружную мембрану, наличие в ней липида А (эндотоксина); 3- Опорная, транспортная и рецепторная функция, прочее 4- Для первого типа при окрашивании по способу Грама характерна устойчивость к обесцвечиванию спиртом в течение 40 сек и сохранение фиолетового цвета при докрашивании (фуксином); для второго - обесцвечивание спиртом в течение 40 сек; докрашивание в красный цвет фуксином 5 Обеспечивает различия в окраске по Граму, что имеет значение при диагностике инфекционных заболеваний, тип строения клеточной стенки определяет чувствительность микроба к ряду антибактериальных агентов (воздействие лизоцима на уровне гликозидной связи; бета-лактамов - на уровне пептидных связей; ПАВ (поверхностно-активные вещества), грамицидин С - на уровне фосфолипидных компонентов, прочие антибиотики, дезинфектанты и физические воздействия - на уровне пептидных и ковалентных связей; тип строения клеточной стенки корреллирует с типом токсинообразования (экзо- или эндотоксина) и характером индукции иммунитета (антитоксический или антибактериальный) 1,2 - «спиртоустойчивая» клеточная стенка, содержащая ок. 40 слоев пептидогликана и тейхоевые кислоты - полимеры известного состава; 3- опорная, транспортная, рецепторная, антигенная функция, устойчивость к обесцвечиванию спиртом в теч. 40 сек; 4 - стрептококки, стафилококки, бациллы, и клостридии, дифтероиды - возбудители инфекционных заболеваний; 5 - воздействие лизоцима на уровне гликозидной связи; бета-лактамов - на уровне пептидных связей; химические и физические способы стерилизации и дезинфекции. 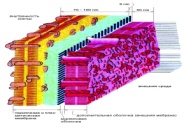 1.5. Схема «Строение клеточной стенки грам- типа» 1.5. Схема «Строение клеточной стенки грам- типа»1-2 - «спирточуствительная» клеточная стенка, содержащая ок. 1-4 слоя пептидогликана, липопротеины, наружную мембрану, состоящую из фосфолипидов, ЛПС комплекса белков - поринов; 3- опорная, транспортная, рецепторная, антигенная (О и К антигены) функция, обесцвечивание спиртом в теч. 40 сек; 4- патогенные нейсерии, вейллонеллы, бактероиды и др. Неклостридиальные анаэробные бактерии, энтеробактерии, извитые формы - возбудители инфекционных заболеваний; 5 - на уровне фосфолипидных компонентов - ПАВ (поверхностно-активные вещества), грамицидин С, на уровне пептидных и ковалентных связей - прочие антибиотики дезинфектанты, физические воздействия. 1 - пептидогликаны — биополимер, характерный только для прокариотов; 2 - N-ацетил-глкжозамин, N-ацетил-мурамовая кислота, тетрапептид; 3 - опорная, транспортная, рецепторная, антигенная функция, устойчивость к обесцвечиванию спиртом в теч. 40 сек; 4 - большинство кокков, бациллы сибирской язвы, клостридии столбняка, газовой гангрены, ботулизма, дифтерийная и туберкулёзная палочка; 5 - лизоцим — на уровне гликозидной связи, бета-лактамы - по пептидной связи, разрушение антибиотиками и «жёстких» стерилизующих воздействиях. 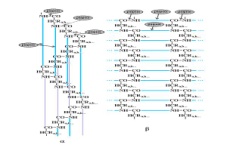 1.7. Схема «Строение протеинового компонента мембраны прокариотов». 1.7. Схема «Строение протеинового компонента мембраны прокариотов».1 - протеиновый компонент, содержащий аминокислотные альфа-и бета-структуры; 2 - аминокислотные последовательности, конъюгированные в билипидный каркас цитоплазмати ческой мембраны; 3 - транспортная, рецепторная, регуляторная функция, участие в процессах питания, дыхания и репродукции, «метаболичесекая граница» клетки 4 - диплококки-нейссерии, энтеробактерии, возбудители особо опасных инфекций -чумы, туляремии, бруцеллёза, холерный вибрион, спириллы, спирохеты и неклостридиальные анаэробы - бактероиды, фузобактерии, вейллонеллы; 5 - грамицидин С и поверхностно-активные вещества (ПАВ) - на уровне билипидного слоя; макролидные антибиотики, тетрациклины и левомицетин - блокада ферментов протеинового компонента мембраны 1 - двунитевая ДНК; 2 - капсид: капсомеры, гликопротеиновые «шипы» и их роль; 3- ДНК-полимераза 4 - кубический тип симметрии к апсида; 5 - особенности культивирования вирусов; отличия вирусов от эукариотической и прокариотической клеток. 1 - однонитевая +РНК; 2 - капсид: капсомеры, адгезины; 3 - РНК-полимераза 4 - кубический тип симметрии капсида; 5 - признаки «живого» и «неживого»; особенности культивирования вирусов; методы выявления вирусов в культурах клеток. 1 - двунитевая ДНК; 2 - капсомеры; 3 - суперкапсида; 4 - гликопротеиновые шипы, их роль; 5 - кубический, спиральный или смешанный тип симметрии капсида. 1 - РНК, возможны варианты «+» и «-»; 2 - поверхностные гликопротеины суперкапсида; 3 - капсомеры и капсид; 4 - суперкапсида; 5 - кубический, спиральный или смешанный типы. 1 - репродуктивный цикл у бактериофага; 2 - формирование умеренных и вирулентных фагов, литический и лизогенные циклы; 3 - строение, смешанный тип симметрии, адгезины; 4 - трансдукция и лизогенная конверсия; 5 - фаготипирование, генная инженерия, лечение некоторых инфекций. 1 - репродуктивный цикл у хламидий; 2 - формирование ретикулярных и элементарных телец; 3 - особенности метаболизма, внутриклеточный паразитизм; 4 - серологический метод, РИФ, ЙФА, ПЦР; 5 - воздушно-капельный и контактно-бытовой: конъюктивиты, трахома, пневмонии, орнитоз, урогенитальный хламидиоз, венерическая лимфогранулёма. 1 - пролиферативный цикл прионов; 2 - формирование нормальных и аномальных белков ргр; 3 - особенности структуры белка; 4 - ИФА, иммуноблоттинг, ПЦР; 5 - алиментарный путь, накопление в нервных клетках патологического белка - губчатый энцефаломиелит; скрепи, куру, синдром Крейтцфельдта-Якоба. 1 - сканирующая микроскопия трепонемы на фоне клеточных элементов исследуемого материала; 2,3 - сократительные фибриллы - двигательная активность; 4 - три рода возбудителей; 5 - прижизненная микроскопия в тёмном поле, нативный препарат с тушью. 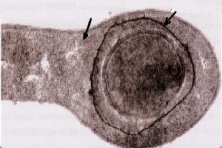 1.16. Электронно-микроскопическая фотография слорообразующей палочки. 1.16. Электронно-микроскопическая фотография слорообразующей палочки.1 - сканирующая микроскопия споры на фоне вегетативного тела бациллы; 2 - многослойная оболочка в обезвоженной споре; 3 - устойчивость к температурным факторам, высушиванию, химическим веществам; 4 - бациллы и клостридии — аэробные и анаэробные спорообразующие микробы, их роль в патологии; 5 - окраска по Ожешко, негативные способы. 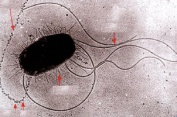 1.17.Электронно-микроскопическая фотография жгутиковой бактерии. 1.17.Электронно-микроскопическая фотография жгутиковой бактерии.1 - сканирующая микроскопия бактерии; 2 - перитрихиально расположенные жгутики у E.coli, пили, наличие бактериофагов на жгутике; 3 - двигательная активность, роль пилей в адгезии и конъюгации; 4 - три рода основных возбудителей: Escherichia, Salmonella, Shigella; 5 - окраска по Леффлеру, оценка характера подвижности с помощью прижизненной микроскопии в тёмном поле зрения. 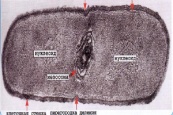 1.18.Электронно-микроскопическая фотография делящейся прокариотич клетки. 1.18.Электронно-микроскопическая фотография делящейся прокариотич клетки.1,2 - электронная микроскопия делящейся бактерии; 3 - клеточная стенка, ЦПМ и нуклеоид - обязательные компоненты бактерии, септальная мезосома и перегородка деления; 4 - изоморфный и гетероморфный, путём перетяжки или инвагинации; процесс репликации ДНК и роль мезосом; 5 - организация генетического материала клетки, организация мембранных структур, функциональная организация. 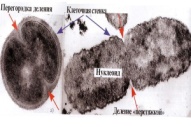 1.19. Варианты цитокинеза 1.19. Варианты цитокинеза1,2 - электронная микроскопия делящейся клетки; 3 - оболочка и нуклеоид — обязательные компоненты бактерий клетки, септальная мезосома и перегородка деления; 4 - изоморфный и гетероморфный, деление путём «перетяжки» у грам- бактерий и инвагинации у грам+; 5 - параметры сравнения эукариотической и прокариотической клеток; организация генетического материала клеток, организация мембранных структур, функциональная организация. 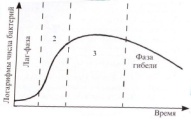 1.20. Кривая роста бактерий в жидкой питательной среде. 1.20. Кривая роста бактерий в жидкой питательной среде.1 - кривая роста бактериальной популяции; 2 - фаза логарифмического, экспоненциального роста; 3 - фаза стационарная; 4 - дать характеристику фаз, характеризующихся динамикой прироста и/или убыли клеток популяции; 5 - значение для пищевой (виноделие) и микробиологической промышленности, медицинской микробиологии (культивирование, требования к питательным средам). 2 - культивирование облигатно-анаэробных и микроаэрофильных бактерий; 3 - вакуум насос, баллоны с бескислородной смесью, редуцирующий пакет, питательные среды со стимуляторами роста анаэробных бактерий; 4 - облигатно-анаэробный, факультативно-анаэробный, микроаэрофильный тип дыхания; 5 - субстратное, окислительное, фотосинтетическое - различаются по конечным акцепторам кислорода и энергетике химических реакций. 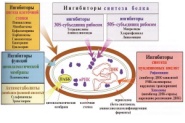 1.22. Схема клеточных мишеней для антибиотиков 1.22. Схема клеточных мишеней для антибиотиков1 - классификация антибактериальных препаратов по механизму действия клеточные мишени для антибактериальных препаратов; 2 - ДНК, РНК, рибосомы, клеточная стенка, ЦПМ, ферменты нуклеотида и ЦПМ; 3 - блокада синтеза НК, белка, клеточной стенки» метаболизма на разных уровнях; 4 - бактерицидное и бактериостатическое действие; 5 - стратегия и тактика антибактериальной терапии, механизмы выработки резистентности микробов к препаратам.  1.23. Автодиспенсср для нанесения дисков 1.23. Автодиспенсср для нанесения дисков1 - автоматический диспенсер для нанесения дисков с антибиотиками; 2 - определение чувствительности микробов к антибиотикам способом дисков (диффузии в агар); 3 - бактериологический метод исследования, способ дисков; 4 - измеряют зоны торможения роста культуры вокруг дисков; 5 - определение чувствительности и устойчивости возбудителей к антибиотикам, выбор оптимальных препаратов для антибактериальной терапии.  1.24.Кассетная антибиотикограмма 1.24.Кассетная антибиотикограмма1,2 - кассета для определения чувствительности штаммов к лекарственным препаратам и минимальной подавляющей концентрации (МПК) препаратов методом разведения; 3 - бактериологический метод, проводят титрование антибиотика для получения диапазона концентраций в лунках кассеты, которую затем заполняют расплавленной агаровой средой, после застывания проводят посев исследуемого штамма, результат учитывают по наличию или отсутствию роста в лунках с определённой концентрацией; 4 - определение МПК, сопоставление МПК и активной концентрации препарата в организме; 5 - оценка чувствительности анаэробных бактерий при культивировании в анаэростате; выбор оптимального препарата для антибактериальной терапии.  1.25.Транспортная система 1.25.Транспортная система1 - транспортная система с полужидкой средой Стюарта; 2 - доставить в лабораторию жизнеспособные аэробные и анаэробные бактерии, используется сбалансированный буферный раствор солей при отсутствии питательных веществ необходимых для размножения бактериальных клеток; 3 - бактериологический метод исследования; 4 - аутотрофы и гетеротрофы; ауксотрофы и паратрофы; 5 - основы классификации по источникам энергии, углерода и т.п.  1.26. Флакон со средой 199 для культуры тканей 1.26. Флакон со средой 199 для культуры тканей1 - любой вирус-содержащий материал, обработанный антибиотиками; 2 - вирусологический метод исследования с использованием культуры ткани на среде 199; 3 - индикатор фенол-рот, до культивирования, после гибели клеток цвет не изменяется; 4 - биологический и серологический метод, реакции нейтрализации со специфическими сыворотками, ПЦР; 5 - программа рецепторной специфичности, гемагглютинация, разрушение поражённых вирусом клеток.  1.27.Тест-система API An 1.27.Тест-система API An1 - чистая культура бактерий; 2 - бактериологический метод, определение биохимических свойств в API An для идентификации анаэробных бактерий; 3 - культура ферментирует углеводы с образованием жёлтой окраски; 4 - для подтверждения заключения - серологическая идентификация, ПЦР; 5 - гликолитическая и протеолитическая активность, газообразование и редукция красителей - проявления основных особенностей метаболизма у бактерий. 1 - бактериологический метод, этап идентификации; 2 - нитратная или гепаринизированная плазма; 3 - культура коагулирует цитратную плазму, следовательно, относится к коагулазо+ группе; 4 - необходима биохимическая идентификация (маннит), фаготипирование, определение белка А. 5 - плазмиды, лизогенная конверсия. 1 - бактериологический метод на этапе изучения чистой культуры; 2 - диффузионный способ определения чувствительности к дискам с антибиотиками на плотной среде АГВ; 3 - размеры зоны задержки роста культуры или её отсутствие; 4 - можно воспользоваться определением минимальной подавляющей концентрации препаратов (МПК), использовать др. Методы определения чувствительности к лекарственным препаратам с помощью ПЦР; 5 - модификационная и генетические формы резистентности; механизмы связаны с изменчивостью бактерий. 1,2 - бактериологический метод, получение изолированных колоний на плотной Универсальной среде (кровяной агар, агар с гемином); 3 - полный гемолиз вокруг колоний; 4 - биохимическая и серологическая идентификация; 5 - разрушение мембран эритроцитов и полный распад гемоглобина (р -гемолиз) 1 - бактериологический метод, получение изолированных колоний на плотной питательной среде (1 этап) 2 - кровяной агар или кровяной агар с гемином для анаэробных бактерий; 3 - полный гемолиз вокруг колоний; 4 - биохимическая и серологическая идентификация; 5 - стрептококки (а, р, у).  1.32. Препарат «Колонии альфа-гемолитического стрептококка» 1.32. Препарат «Колонии альфа-гемолитического стрептококка»1 - бактериологический метод, получение изолированных колоний на плотной питательной среде (1 этап) 2 - кровяной агар или кровяной агар с гемином для анаэробных бактерий; 3 - частичный гемолиз вокруг колоний; 4 - биохимическая и серологическая идентификация; 5 - расщепление гемоглобина до промежуточного продукта - буро-зелёного пигмента биливердина (а -гемолиз)  133.Препарат «Лецитиназная активность стафилококка» 133.Препарат «Лецитиназная активность стафилококка»1 - бактериологический метод, получение изолированных колоний на плотной питательной среде (1 этап) 2 - желточно-солевой агар; 3 - образование «радужных» ореолов, зон преломления света вокруг колоний; 4 - биохимическая и серологическая идентификация; 5 - расщепление лецитина и вителлина под действием ферментативного комплекса лецитовителлазы (лицетиназы) 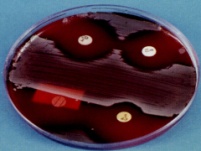 134.Антнбиотикограмма, способ дисков на кровяном агаре 134.Антнбиотикограмма, способ дисков на кровяном агаре1 - бактериологический метод на этапе изучения чистой культуры; 2 - диффузионный способ определения чувствительности к дискам с антибиотиками на плотной среде; 3 - размеры зоны задержки роста культуры или её отсутствие; 4 - можно воспользоваться определением минимальной подавляющей концентрации препаратов (МПК), использовать др. Способы определения чувствительности к лекарственным препаратам, проводить определение генов резистентности с помощью ПЦР; 5 - посев выполнен на кровяном агаре; подобная постановка исследования используется при опенке чувствительности гемофильных и анаэробных бактерий, не растущих на обычных питательных средах  1.35. Антибиотикограмма, кассетный микрометод 1.35. Антибиотикограмма, кассетный микрометод1 - бактериологический метод на этапе изучения чистой культуры или первичный посев материала (экспресс-методика); 2 - диффузионный способ определения чувствительности к антибиотикам на плотной среде, которая распределена в лунки пластиковой кассеты с разными препаратами и/или разными концентрациями препаратов; 3 - отсутствие признаков роста культуры или её рост; 4 - можно воспользоваться способом дисков, использовать др. Способы определения чувствительности к лекарственным препаратам, проводить определение генов резистентности с помощью ПЦР; 5 - модифицированная методика позволяет определять как чувствительность отдельных штаммов, так и проводить определение МПК; в данном случае посев выполнен на кровяном агаре; подобная постановка исследования используется при оценке чувствительности гемофильных и анаэробных бактерий, не растущих на обычных питательных средах 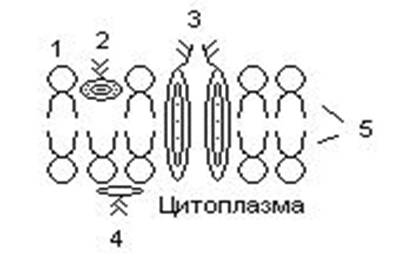 1.36.Схема «Строение цитоплазматической мембраны прокариотов». 1.36.Схема «Строение цитоплазматической мембраны прокариотов».1 - фосфолипиды, определяют непроницаемость за счёт гидрофобных липидных «головою); 2 - поверхностные белки с углеводными цепочками (адгезины и т.п., определяют рецепторную функцию); 3 - интегральные белки (транслоказы, порины и т.п. - определяют избирательную проницаемость клетки, транспортную функцию, участие в процессах питания, биосинтезе, делении клетки); 4 - дыхательные и др. Внутриклеточные ферменты (определяют высокую метаболическую активность прокариотической клетки, участвуют в энергетическом обмене (АТФ), процессах репликации ДНК, делении клетки); 5 - билипидный слой из молекул фосфолипидов с вкраплениями поверхностных и интегральных белковых молекул. 1 - бактериофаг (Т2) 2 - состоит из головки, отростка, базальной пластины, шипов и нитей- филаментов; головка фага покрыта белковым чехлом, в котором полипептидные субъединицы расположены по кубическому типу симметрии, внутри головки находится гигантская непрерывная двунитевая молекула ДНК, суперсперилизованая за счёт внутренних белков фага: спермина и путресцина; в дистальной части отростка расположен фермент лизоцим, необходимый для разрушения глихозндных связей пептидогли кана, входящего в состав клеточных стенок бактерий 3 - репродукция в бактериальной клетке; бактериофаги могут быть вирулентными и умеренными; вирулентные фаги характеризуются тем, что цикл их развития в бактериальной клетке обязательно завершается выходом фагов из бактерии и гибелью бактериальной клетки, т.е. Наблюдается продуктивная форма инфекции (примером является бактериофаг кишечных бактерий Т2) 4 - адгезия фагов на специфических рецепторах клеточной стенки бактерий с помощью нитей и шипов отростка; сокращение белкового чехла отростка и инъекция нуклеиновой кислоты (ДНК) внутрь бактериальной клетки; синтез ранних фаговых белков, которые запускают синтез фаговой ДНК 5 - приготовление препаратов для диагностики (фаготипирование стафилококка) или лечения бактериальных инфекций (стафилококковый, брюшнотифозный, холерный, чумной фаги) 1 - адсорбция бактериофагов на поверхности бактериальной клетки 2 - клетка и бактериофаги, прикрепившиеся к клеточной стенке, а также нити деспирализованной ДНК фагов в цитоплазме клетки 3 - внутриклеточная репродукция вирулентных фагов 4 - адгезия фагов на специфических рецепторах клеточной стенки бактерий с помощью нитей и шипов отростка; сокращение белкового чехла отростка и инъекция нуклеиновой кислоты (ДНК) внутрь бактериальной клетки; синтез ранних фаговых белков, которые запускают синтез фаговой ДНК и далее - поздних фаговых белков 5 - цикл литической инфекции бактериальных клеток вирулентным фагом (в отличие от лизогенного цикла умеренного фага); в медицинской практике используется для диагностики (фаготипирование стафилококка) или лечения бактериальных инфекций (стафилококковый, брюшнотифозный, холерный, чумной фаги) 1 - разъединенный синтез отдельных структурных элементов вируса с последующей их сборкой (репродукция вирулентного бактериофага Т2 в кишечной палочке) 2 - бактериальная клетка, содержащая фаговые частицы 3 - внутриклеточная репродукция вирулентных фагов (морфогенез фага вдет по трем основным направлениям, независимо приводящим к формированию головок, отростков и нитей, которые затем объединяются, образуя зрелые фаговые частицы; процесс контролируют более 60 фаговых генов) 4 - А-Б-В - скрытый период сборки фаговых компонентов (14 мин); Г- появление первых собранных фагов (15 мин); Д - начало «выхода» фагов из клетки (40 мин); наряду с образовавшимися зрелыми частицами фага в цитоплазме бактерий накапливается свободный фаговый лизоцим, являющийся поздним фаговым белком, который изнутри истончает клеточную стенку бактерий и она разрывается под действием внутреннего осмотического давления 5 - Образуются новые фаги (до 300 фагов), а бактериальная клетка погибает 1 - адсорбция бактериофагов на поверхности бактериальной клетки 2 - клетка и множество бактериофагов, находящихся вокруг и прикрепившихся к клеточной стенке бактерии 3 - внутриклеточная репродукция вирулентных фагов — адгезия фагов на специфических рецепторах клеточной стенки бактерий; инъекция нуклеиновой кислоты (ДНК) внутрь бактериальной клетки; синтез ранних фаговых белков, которые запускают синтез фаговой ДНК и далее - поздних фаговых белков 5 - используется для диагностики (фаготипирование стафилококка) или лечения бактериальных инфекций (стафилококковый, брюшнотифозный, холерный, чумной фаги) 1- процесс конъюгации между jf+ и F- бактериями 2 - на электронной фотографии - клетки донора и реципиента (F-), хорошо видна половая пиля; половые пили представляют нитевидные образования полые внутри, образуемые белком пилином (количество пилей колеблется в пределах 1-10) 3 - конъюгация является вариантом рекомбинативной изменчивости у бактерий; в процессе конъюгации от клетки донора к клетке реципиенту осуществляется перенос фактора фертильности (F-плазмида), а также и других плазмид и генов хромосомы (плазмиды резистентности к антибиотикам, tox-гены и т.п.). Бактерии доноры, чтобы иметь возможность осуществлять конъюгацию, должны обладать дополнительным генетическим материалом - Р плазмидой (от слова фертильность - плодовитость). F плазмида имеет синонимы - половой фактор, фактор фертильности, фактор плодовитости, F фактор; она представляет собой двунитевую ковалентно замкнутую молекулу ДНК, которая по молекулярной массе значительно меньше хромосомы бактериальной клетки; в составе F фактора имеются гены, отвечающие не только за репликацию, но и кодирующие синтез половых пилей (ворсинок) на поверхности бактериальной клетки. 4 - после того как произошла коагтрегация двух бактерий и половые пили соединили обе конъюгирующие клетки, происходит сокращение пилей в результате чего в течение нескольких минут бактерия реципиент подтягивается вплотную к донору и клеточные стенки обеих бактерий входят в тесный контакт, формируя цитоплазматический мостик; далее осуществляется репликация плазмиды и перенос генетической информации 5 - передача генов резистентности к антибиотикам, кодирующих синтез ферментов, факторов вирулентности, ускорение процесса репродукции у бактерий в случае формирования Hfr-пслеток 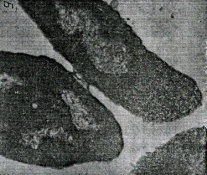 .42. Фотография «Конъюгация у бактерий под электронным микроскопом» .42. Фотография «Конъюгация у бактерий под электронным микроскопом»1 - процесс конъюгации между F+ и F- бактериями 2 - на электронной фотографии - клетки донора (F+) и реципиента (F-), хорошо виден цитоплазматический мостик; 3 - передача генетического материала в редких случаях может происходить по половым пилям, но все-таки в подавляющем большинстве случаев она происходит по цитоплазматичеекому мостику 4 - существуют два состояния полового фактора: свободное нахождение в цитоплазме, и тогда бактерии обозначаются F* и интегрированное в хромосому. В последнем случае бактерии обозначаются Hfr, т.е.обладающис высокой частотой рекомбинации (от англ.: hight frequence of recombinantion). Если половой фактор находится в свободном состоянии в цитоплазме, то в клетку реципиент передается только его генетический материал. 5 - передача генов резистентности к антибиотикам, кодирующих синтез ферментов, факторов вирулентности, ускорение процесса репродукции у бактерий в случае формирования Hfr-гклеток 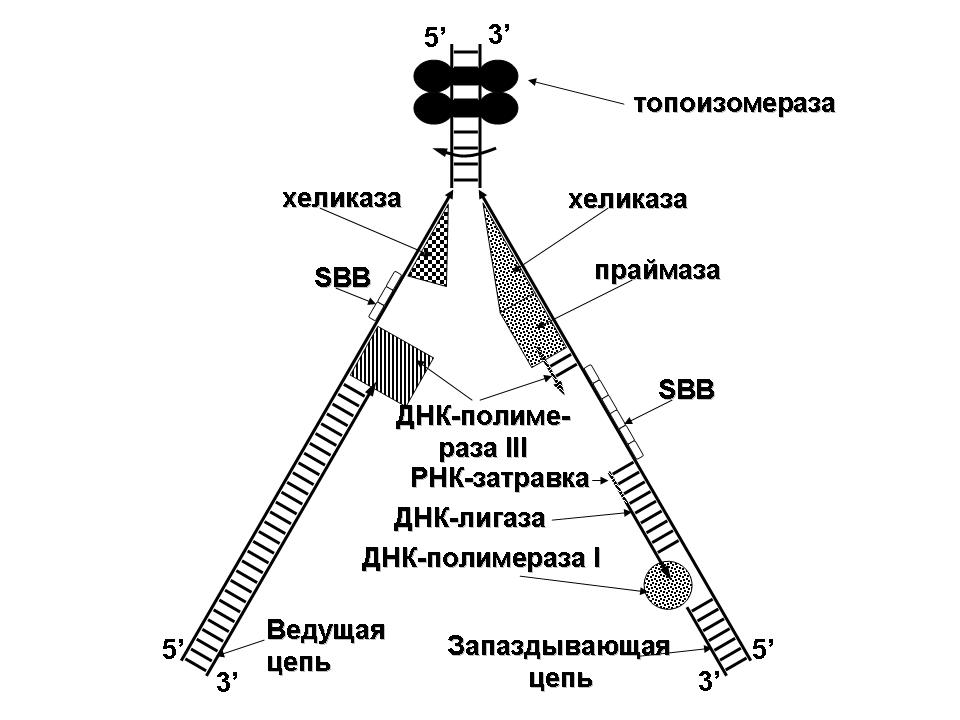 1.43. Схема «Формирование репликативной вилки хромосомы» 1.43. Схема «Формирование репликативной вилки хромосомы»1 - схема репликации ДНК (формирование репликативной вилки) 2 - процесс расплетания нитей ДНК и участвующие в нём ферменты 3 - синтез ДНК на обеих матричных цепях идет в направлении от 5' к 3' концам. На ведущей нити ДНК он происходит непрерывно, а на отстающей прерывисто в виде фрагментов Оказаки, каждый из которых включает 1000-2000 нуклеотидов 4 - образование репликативной вилки ДНК начинается в определённом участке ДНК (ориджин) при участии фермента ДНК-гиразы; дальнейшее формирование репликативной вилки обеспечивают ферменты хелнказы. Одна хеликаза передвигается по ведущей нити ДНК, а другая по отстающей. Кроме хеликаз в формировании репликативной вилки участвуют SSB - белки, специфически связывающиеся с каждой из расплетенных нитей ДНК. Они предотвращают преждевременное их соединение. Вновь синтезированные нити ДНК всегда содержат на 51 концах несколько рибонуклеотидов, т.е. Синтез ДНК начинается с синтеза короткой цепи РНК, связанной с матрицей ДНК. Эту РНК-затравку образует специальный фермент, который называется ДНК-праймаза (праймер - затравка). Затем синтез ДНК продолжается благодаря присоединению к РНК-затравке дезокеирибонуклеотидов с помощью ДНК-полимиразы III. Удаление РНК-затравки и застройка брешей осуществляется ДНК-полимеразой I. На отстающей нити ДНК, остающиеся между двумя соседние фрагментами Оказаки, однонитевые разрывы заделывает ДНК-лигаза. Раскручивание узлов, образующихся перед репликативной вилкой сверхсперилизованными нитями ДНК, осуществляет фермент топоизомераза. Энергия, необходимая для расплетания нитей ДНК поставляется в результате гидролиза АТФ 5 - делению бактериальной клетки обязательно должна предшествовать репликация ДНК 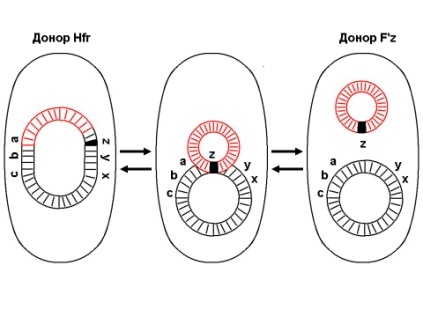 1.44. Схема «Конъюгация у бактерий. Формирование F рекомбинантов» 1.44. Схема «Конъюгация у бактерий. Формирование F рекомбинантов»1 - конъюгация у бактерий: формирование Ррекомбинантов 2 - донор Hfr, вычленение плазмиды с геном z, донор f'z 3 - существуют два состояния полового фактора: свободное нахождение в цитоплазме, и тогда бактерии обозначаются F*" и интегрированное в хромосому - обозначаются Hfr, т.е.обладающие высокой частотой рекомбинации (от англ.: hight frequence of recombinantion). Бели половой фактор находится в свободном состоянии в цитоплазме, то в клетку реципиент передается только его генетический материал 4 - У Hfr бактерий может происходить выход полового фактора из состава хромосомы в цитоплазму, в результате возникает клон F* клеток. В некоторых случаях при выходе F фактора он может включить расположенный рядом ген бактериальной хромосомы (путем рекомбинации). В таких случаях рядом с обозначением полового фактора дается символ соответствующего гена (z). Следовательно, особенностью Hfr бактерий является передача генов собственной хромосомы в клетку реципиент. Например, fmac, т.е. В составе полового фактора находится лактозный оперон, отвечающий за утилизацию лактозы. В результате бактерии имеют делецию, соответствующую лактозному гену, являющегося уже составной частью полового фактора. Если в состав полового фактора войдут гены, жизненно необходимые бактерии, то потеря его клеткой может привести к ее гибели. Поскольку половые факторы могут включаться в различные участки бактериальной хромо сомы, то F плазмида может содержать различные гены. 5 - передача генов резистентности к антибиотикам, кодирующих синтез ферментов, факторов вирулентности, ускорение процесса репродукции у бактерий в случае формирования Hfr-гклеток 1 - конъюгация у бактерий 2 - конъюгирующие клетки, этапы репликации F плазмиды с последующим формированием из F- клетки 3- конъюгация является вариантом рекомбинативной изменчивости у бактерий; в процессе конъюгации от клетки донора к клетке реципиенту осуществляется перенос фактора фертильности (F-плазмида), а также и других плазмид и генов хромосомы (плазмиды резистентности к антибиотикам, tox-гены и т.п.). Бактерии доноры, чтобы иметь возможность осуществлять конъюгацию, должны обладать дополнительным генетическим материалом - F плазмидой (от слова фертильность - плодовитость). F плазмида имеет синонимы - половой фактор, фактор фертильности, фактор плодовитости, F фактор; она представляет собой двунитевую ковалентно замкнутую молекулу ДНК, которая по молекулярной массе значительно меньше хромосомы бактериальной клетки; в составе F фактора имеются гены, отвечающие не только за репликацию, но и кодирующие синтез половых пилей (ворсинок) на поверхности бактериальной клетки. 4 - расплетание ДНК плазмиды; переход нити ДНК из F+ донора с 5* конца в F Реципиент; достраивание комплементарной нити; формирование F плазмиды 5 - передача генов резистентности к антибиотикам, кодирующих синтез ферментов, факторов вирулентности и т.п. 1 - конъюгация у бактерий: формирование Hfr рекомбинантов 2 - донор F+, Hfr клетка, деление Hfr рекомбинантов 3 - существуют два состояния полового фактора: свободное нахождение в цитоплазме, и тогда бактерии обозначаются F+ и интегрированное в хромосому - обозначаются Hfr, т.е.обладающие высокой частотой рекомбинации (от англ.: hight frequence of recombinantion). Если половой фактор находится в свободном состоянии в цитоплазме, то в клетку реципиент передается только его генетический материал 4 - У Hfr штаммов (у них половой фактор включен в хромосому) конъюгация начинается с разрезания одной нити ДНК в области включенного полового фактора. Поэтому в клетку реципиент входит сначала небольшой участок ДНК F фактора наподобие "локомотива", а затем гены хромосомы донора (вагоны, которые тянет "локомотив"). На нити ДНК, входящей в реципиент, синтезируется комплементарная ей нить. Затем перешедшие в клетку реципиент гены донора вступают в рекомбинацию с генами реципиента, замещая свои аллели. У Hfr бактерий может происходить выход полового фактора из состава хромосомы в цитоплазму, в результате возникает клон F* клеток. 5 - передача генов резистентности к антибиотикам, кодирующих синтез ферментов, факторов вирулентности, ускорение процесса репродукции у бактерии в случае формирования Hfr-гклеток 1 - схема темновой репарации ДНК 2 - двойная ДНК с тиминовым димером, сформировавшимся при повреждении У Ф-светом 3 - восстановление разрушенного участка ДНК с помощью экндо- и экзонуклеаз 4 - этапы темновой репарации ДНК: участок ДНК с тиминовым димером (1); разрезание повреждённой нити ДНК эндонуклеазой (2), удаление тиминового димера и прилежащей части ДНК экзонуклеазой - эксцизия (3), ресинтез удаленного участка ДНК зашивание однонитевого разрыва ДНК с помощью ДНК-лигазы 5 - восстановление генофонда хромосом, увеличение продолжительности «жизни» ДНК 1 - схема трансформации с включением в хромосому клетки реципиента фрагмента одноцепочечной ДНК донора 2 - фрагмент ДНК донора, ДНК реципиента 3 - приобретение новых генотипических признаков клеткой реципиент 4 - трансформация включает следующие этапы: адсорбция выделившийся трансформирующей ДНК из клетки донора на рецепторах бактерии - реципиента Выделение ДНК из клетки донора может происходить в результате разрушения бактерий во внешней среде под действием различных химических и физических факторов, а также их аутолиза (1), разрезание двунитевой молекулы ДНК, адсорбированной на поверхности бактерий, ферментом эндонуклеазой на отдельные двунитевые фрагменты (2), на поверхности бактерий экзонуклеаза вызывает деградацию одной из нитей двунитевых фрагментов трансформирующей ДНК; в результате формируются однонитевые отрезки ДНК (3), синтез белка-лоцмана, который соединяется с однонитевыми фрагментами трансформирующей ДНК. На поверхности бактерий существует электрическое поле. Учитывая это белок-лоцман можно рассматривать в качестве ротора, а белки мембраны как статор. Под действием потока ионов Н* через статор происходит вращение ротора и продвижение в цитоплазму бактерий вместе с трансформирующей ДНК (4). Далее происходит интеграция поступившего в цитоплазму трансформирующего однонитевого фрагмента ДНК в образовавшуюся в одной из нитей ДНК реципиента брешь, которая возникает в результате удаления аллельного гена. Затем происходит репликация ДНК и формирование клона рекомбинантных бактерий (5). 5 - передача генов резистентности к антибиотикам, кодирующих синтез ферментов, факторов вирулентности 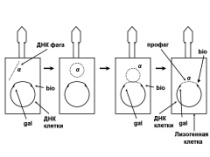 1.49. Схема «Лизогенная конверсия у бактерий» 1.49. Схема «Лизогенная конверсия у бактерий»1 - интеграция ДНК фага лямда в бактериальную ДНК и формирование лизогенной бактерии (лизогенная конверсия) 2 - умеренный бактериофаг, бактериальная клетка, процесс лизогении 3 - репродукция умеренного бактериофага в бактериальной клетке с привнесением в бактерии новой генетической информации (на модели фага лямбда и его хозяина -кишечной палочки; перенос гена, кодирующего биосинтез биотина) 4 - этапы специфической трансдукции: умеренный фаг впрыскивает ДНК в цитоплазму бактерии, где она принимает кольцевую структуру, которая накладывается на ДНК бактерии между генами gal (ген, отвечающий за утилизацию галактозы в клетке) и bio (ген, кодирующий синтез биотина в бактерии). Именно в этом месте находится специфический участок бактериальной хромосомы, который спаривается с участком фага, затем нуклеазы клетки разрезают обе ДНК, т.е. Имеет место их разрыв, и далее происходит перекрестное воссоединение свободных концов обеих нуклеиновых кислот, В результате ДНК фага включается в ДНК бактерий между генами gal и bio. Включенная ДНК фага в ДНК бактерии называется профаг. Клетка, имеющая профаг, называется лизогенной бактерией. При делении бактериальных клеток профаг передается дочерним по наследству. Такая наследственная передача профага может быть неограниченно долгой. Возникающее лизогенное состояние бактерий (лизогения) представляет собой интегративную форму инфекции. 5 - присутствие профага в ДНК бактерий приводит к появлению у них новых свойств. Приобретение лизогенными бактериями новых свойств называется лизогенной конверсией (превращением). 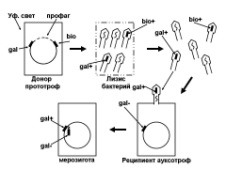 1.50. Схема «Трансдукции у бактерий» 1.50. Схема «Трансдукции у бактерий»1 - механизм специфической трансдукции на модели умеренного фага лямбда и его хозяин кишечная палочка. Донорные лизогенные бактерии облучаются УФ-светом, чтобы разрушить белок репрессор, удерживающий профаг в составе ДНК донора. В результате ликвидации белка репрессора происходит выход профага в цитоплазму и начинается продуктивный цикл его развития. 2 - профаг в бактериальной клетке и процессы перехода к продуктивной инфекции под действием ультрафиалетового облучения 3 - приобретение новых генотипических свойств в результате лизогенной специфической трансдукции трансдуцирующим фагом лямда 4 - профаг лямбда включен на хромосоме кишечной палочки между генами gal (отвечающим за утилизацию галактозы) и bio (контролирующем синтез биотина), т.е. Эти гены соприкасаются с концами профага. При выходе профага из состава ДНК донора в него в результате рекомбинации может включиться либо ген gal, либо ген bio. Трансдуцирующий бактериофаг может перенести в клетку реципиент только один из указанных генов. В случае если необходимо перенести из клетки донора (клетка дикого типа, т.е. Все гены работающие), ген gal, то в качестве реципиента используют бактерии, в которых имеется мутировавший галактозный ген gal". Трансдуцирующий бактериофаг переносит gal ген в цитоплазму реципиента. При этом он не замещает свой аллель gal", а прикрепляется рядом. Образуется мерозигота. Так как ген gal* является доминантным, то образовавшаяся частично диплоидная клетка (gal* / gal") будет утилизировать галактозу 5 - приобретение трансдуцирующего фага бактериями реципиентами приводит к появлению у них новых генов и новых фенотипических признаков (свойств) 1 - открытие явления трансформации - передачи генетической информации из разрушенных бактерий-доноров в виде неповрежденной молекулы ДНК в клетки реципиенты 2 - варианты опытов Грифита на модели пневмококковой инфекции у белых мышей; представлены высоковирулентные пневмококки (клетки образуют полисахаридную капсулу, колонии блестящие, гладкие, т.е. Находятся в S форме (от английского слова smooth - гладкий) и авирулентные (не имеют капсулы, их колонии шероховатые (от английского слова rought - шероховатый) 3 - включение фрагмента ДНК разрушенной клетки донора в живую клетку реципиент с приобретением последней новых признаков 4 - Опыт Гриффита заключался в следующем. Для заражения он использовал 4 партии мышей. Опытная партия была инфицирована смесью убитых нагреванием пневмококков в S форме с живыми бактериями в R форме. Контрольные группы мышей заражали следующим образом: одной группе вводили живых в S форме пневмококков другой -убитых нагреванием пневмококков в S форме, третьей - живых в R форме бактерий. При учете полученных данных в контрольных экспериментах были отмечены ожидаемые результаты, т.е. Мыши погибли при заражении их только живыми в S форме пневмококками, а две другие контрольные группы остались живыми. Мыши, входившие в состав опытной группы, т.елараженные смесью убитых нагреванием пневмококков в S форме и живых бактерий в R форме погибли. Гриффит выделил из погибших мышей возбудителя. Это были живые пневмококки - в S форме. Они образовывали капсулу. Таким образом, под влиянием убитых вирулентных пневмококков у R мутанта восстановилась способность формировать капсулу, утраченную в результате мутации, т.е.они стали вирулентными. Явление трансформации было продемонстрировано также in vitro (в пробирке) при размножении R - мутанта в присутствии убитых нагреванием пневмококков в S форме. Трансформация происходила и в тех случаях, когда к размножившейся культуре пневмококков в R форме добавляли бесклеточный экстракт из Бактерий. Работа Гриффита заложила краеугольный камень в развитие молекулярной генетики и молекулярной биологии. В 1944 году Эйвери, Мак-Карти и Мак-Леод установили, что трансформирующим началом, обеспечивающим превращение пневмококков из R формы в вирулентную S форму является ДНК. 5 - Открытие явления трансформации продемонстрировало, что наследственная информация закодирована в молекуле ДНК, а не в белке, как считали ранее. В последствии было показано наличие трансформации и у других видов бактерий. |
