хтов экзамен. 37 Основные виды промышленных товарных продуктов, получаемых путем этерификации. Примеры
 Скачать 1.37 Mb. Скачать 1.37 Mb.
|
|
37) Основные виды промышленных товарных продуктов, получаемых путем этерификации.Примеры. Этерификация – реакция взаимодействия органических или неорганических кислот со спиртами приводящие к образованию сложных эфиров. Сложные эфиры карбоновых кисло имеют важное практическое значение в качестве растворителей, отдушек, гидравлических жидкостей, смазочных масел, пластификаторов и мономеров. Растворителями служат сложные эфиры более дешевых и доступных кислот и спиртов. Все эти эфиры бесцветны и мало расторимы в воде. Их недостатки – значительная горючесть и взрывоопасность. Этил ацетат СН3СООС2Н5 ( т кип 77,1 °С) получают этерификацией этанола уксусной кислотой : СН3СООН + С2Н5ОН → СН3СООС2Н5 + Н2О Другой способ, состоит в превращение ацетальдегида по реакции Тищенко под влиянием алкоголята алюминия: 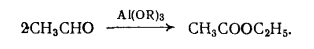 Сложные эфиры уксусной кислоты с одноатомными спиртами-гомологами этанола- также имеют важное значение; их получают этерификацией соответствующих спиртов уксусной кислотой. 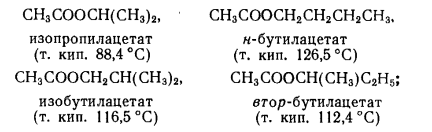  Как пластификаторы, наибольшее значение имеют сложные эфиры фталевой кислоты, получаемые из фталевого ангидрида и спиртов С4- С8,особенно из изооктана и 2 – этилгексанола 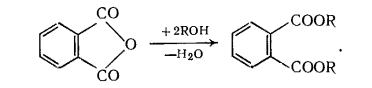 Для этой же цели применяют соответствующие эфиры изофталевой кислоты (м-бензоилдикарбоновая) кислоты. Во многих случаях сложноэфирные пластификаторы идентичны по составу сложноэфирным смазочным маслам. Этими пластификаторами являются полные эфиры двухосновных алифатических кислот (адипиновая, метиладипиновая, себационовая) с высшими одноатомными спиртами (н-окнанол, изооктанол. 2 – этилгексанол). Их получают этерификацией спиртов кислотами в присутствии кислотных катализаторов: 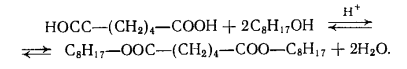 В качестве пластификаторов и смазочных масел применяют также полные эфиры ди-, три- и полиэтиленгликолей НО(СН2СНО)nН пентаэритрита C(CH2OH)4, триметилопропана СН3СН2С(СН2ОН)3 и высших одноосновных кислот С6-С9.Эти полные эфиры получают обычной этерификацией: Сложные эфиры ненасыщенных кислот и спиртов ввиду наличия в них двойных связей способны к полимеризации с образованием ценных продуктов. Важное значение имеют эфиры акриловой и метакриловой кислот, особенно метилметакрилат СН2=С(СН)3СООСН3. При полимеризации он дает полиметилметакрилат (органическое стекло, или плексиглас),который широко используют для изготовления изделий бытового и технического назначения. 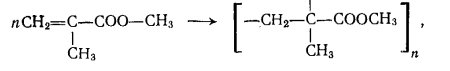 Для получения полиэтилентерефталата, применяемого для выработки важного синтетического волокна( терилен, или лавсан), используют диметиловый эфир терефталевой кислоты. 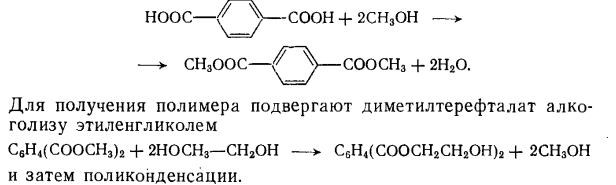 38) Процессы алкилирования аренов в органическом синтезе. Химизм, термодинамика, закономерности, катализаторы.Механизм реакции. 38) Процессы алкилирования аренов в органическом синтезе. Химизм, термодинамика, закономерности, катализаторы.Механизм реакции.Катализаторы. При алкилировании в качестве катализатора используют только хлорид алюминия, отличающийся наибольшей активностью из всех доступных апротонных кислот. Он же применяется при алкилировании углеводородов олефинами, но в этом случае пригодны и другие катализаторы кислотного типа (Н2SO4, безводный HF, BF3,фосфорная кислота на носителях, алюмосиликаты, цеолиты). Хлорид алюминия в твердом состоянии практически не растворим в углеводородах и слабо катализирует реакцию. Однако по мере выделения HCl хлорид алюминия начинает превращаться в темное жидкое вещество, также не растворимое в избытке углеводорода (комплекс Густавсона), который обладет высокой каталитической активностью, и реакция постепенно ускоряется. Его можно приготовить, пропуская HCl при нагревании через суспензию AlCl3 в ароматическом углеводороде. Комплекс представляет собой соединение AlCl3 и HCl с 1-6 молекулами ароматического углеводорода, одна из которых находится в особом структурном состоянии положительно заряженного иона (σ- комплекс), а остальные образуют сольватную оболочку. 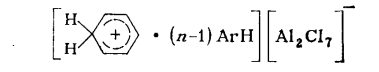 Во избежание медленного катализа твердым хлоридом алюминия этот активный каталитический комплекс целесообразно готовить предварительно и потом подавать на реакцию. Необходимо хорошо осушать реагенты и следить , чтобы в реакционную смесь не попадала вода, способная вызвать бурное разложение комплекса. Жидкая реакционная масса при алкилировании с AlCl3 состоит из двух фаз: каталитического комплекса и углеводородного слоя. Механизм реакции. В качестве алкилирующих агентов в промышленности применяют хлорпроизводные и олефины. При реакции с хлорпроизводными или олефинами AlCl3 расходуется только в каталитических количествах. В первом случае он активирует атом хлора, образуя сильно поляризованный комплекс или карбокатион, что с олефинами происходит только в присутствии сокатализатора – HCl: В действительности при катализе комплексом хлорида алюминия с углеводородом необходимый для этого протон уэе имеется в виде σ- комплекса. Он передается молекуле олефина, и образовавщийся карбокатион атакует ароматическое соединение,все происходит в слое каталитического комплекса, который непрерывно обменивается своими лигандами с глеводородным слоем. получившийся тем или иным путем карбокатион, атакует затем ароматическое ядро, причем реакция протекает через промежуточный π- комплекс и карбокатион с последующей быстрой стадией отщепления протона: 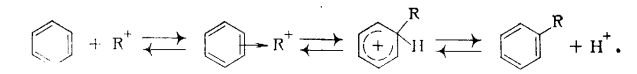 Строение алкильной группы в полученном продукте определяется правилом о промежуточном образовании наиболее стабильного карбокатиона (трет- > втор- > перв-). Поэтому в случае низших олефинов только из этилена образуется первичный алкилбензол (этилбензол), из пропилена – вторичный (изопропилбензол), а из изобутена – третбутилбензол: 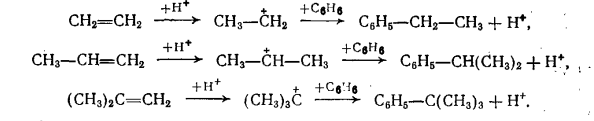 Однако при алкилировании высшими олефинами и хлорпроизводными наблюдается изомеризация алкильных групп, которая происходит перед алкилированием, поскольку алкилбензолы к ней уже не способны. Эта изомеризация протекает в направлении промежуточного образования наиболее стабильного карбокатиона, но без нарушения углеродного скелета алкильной группы, а лишь с перемещением реакционного центра. Вследствие этого из хлорпроизводных и олефинов с прямой цепью атомов углерода получается смесь втор-алкилбензолов, а из соединений с разветвленной цепью – преимущественно трет-алкилбензолы. Влияние строения ароматического соединения при реакциях алкилирования в общем такое же, как при других процессах электрофильного замещения в ароматическое ядро, но имеет свои особенности. Реакция алкилирования отличается сравнительно малой чувствительностью к электронодонорным заместителям в ядре. Так, активирующее влияние алкильных групп и конденсированных ядер при катализе реакции АlСl3 изменяется следующим образом (для бензола величина принята за 1,0): 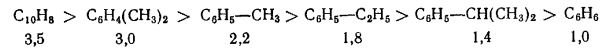 Электроакцепторные заместители сильно дезактивируют ароматическое ядро. Хлорбензол алкилируется примерно в 10 раз медленнее бензола, а карбонтльные, карбокси-, циано- и нитрогруппы приводят к полному дезактивированию ароматического ядра, вследствии чего соответствующие производные вообще не способны к алкилированию. Этим реакция алкилирования значительно отличается от других процессов замещения в ароматическое ядро, например от хлорирования и сульфирования. Правила ориентации при алкилировании в общем подобны другим реакциям электрофильного замещения в ароматическое ядро, но строение продукта может быть существенно изменяться в зависимости от катализатора и условий реакции. Так, электродонорные заместители в атомы галогена направляют дальнейшие замещение преимущественно в пара- м орто- положение, однако в более жестких условиях и особенно при катализе хлоридом алюминия происходит изомеризация гомологов бензола с внутримолекулярной миграцией алкильных групп и образованием равновесных смесей, в которых преобладают термодинамически более стабильные изомеры. При алкилировании нафталина это позволяет в мягких условиях получать 1-алкил, а в более жестких – 2 алкилнафталин. Последовательное алкилирование. При алкилировании ароматических соединений в присутствии любых катализаторов происходит последовательное замещение атомов водорода с образованием смеси продуктов разной степени алкилирования. Например, метилирование и этилирование бензола идет вплоть до получения гексаалкилбензолов. 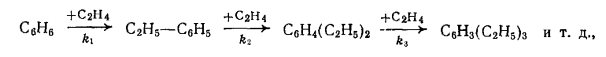 пропилирование – до получения тетраизопропилбензола и т.д. Каждая из реакций при умеренной температуре является практически необратимой. Однако при катализе АlСl3 и достаточно жестких условиях катализа алюмосиликатами и цеолитами происходит обратимая реакция переалкилирования (диспропорционирование) с межмолекулярной миграцией алкильных групп: С теми же катализаторами протекает и рассмотренная выше обратимая изомеризация с внутримолекулярной миграцией алкильных групп, в результате которой среди диалкилбензолов преобладает мета-изомер, среди триалкилбензолов 1,3,5-изомер и т.д. Способность алкильных групп к миграции изменяется в такой последовательности: Кинетика процесса. Сама реакция алкилирования с активным комплексом хлорида алюминия идет очень быстро, сильно ускоряется при механическом перемешивании или интенсивном барботировании газообразных олефинов через реакционную массу и протекает в диффузионной или близкой к ней области. Ее скорость повышается при росте давления, но мало зависит от температуры, имея низкую энергию активации. Лимитирующей является стадия диффузии олефина через пограничную пленку каталитического комплекса хлорида алюминия, в которой протекают все реакции. В отличие от этого, переалкилирование идет значительно медленнее и существенно ускоряется при повышении температуры, так как имеет энергию активации ≈ 63 кДж/моль. Обе реакции замедляются при постепенном дезактивировании катализатора, но особенно сильно падает скорость переалкилирования. В результате в реакционной смеси будет накапливаться значительное количество полиалкилбензолов, не успевающих вступить в реакцию переалкилирования. Во избежание этого приходитс ограничивать подачу реагентов, и возможность интенсификации процесса лимитируется медленной реакцией переалкилирования. На дезактивирование катализатора влияет, кроме примесей реагентов, накопление некоторых побочных продуктов алкилирования, способных прочно связывать АlСl3 или образовывать стабильные σ-комплексы, с трудом отдающие свой протон молекуле олефина. Такими веществами при низкой температуре, когда переалкилирование идет медленно, являются полиалкилбензолы, а при высокой температуре – полициклические ароматические соединения и смолы. В результате оказывается, что оптимальные производительность и расход катализатора при получении этил- и изопропилбензола достигаются при некоторой средней температуре (≈ 100 °С), когда переалкилирование протекает уже достаточно быстро, но полициклических веществ, дезактивирующих катализатор, получается еще мало. При синтезе соединений с более длинной алкильной группой выбор температуры лимитируется побочной реакцией деструкции, а при получении алкилнафталинов – процессами конденсации и осмоления. В этих случаях ее оптимум равен 30…50 °С, причем при алкилировании нафталина селективность можно дополнительно повысить применением растворителя. 39. Реакционная способность аренов и олефинов в реакции алкилирования. Требование к сырью, катализатору. Типы реакторов(рис.). Узел осушки бензола (рис) Алкилирование олефинами в большинстве случаев протекает по ионному механизму через промежуточное образование карбокатионов и катализируется протонными и апротонными кислотами. Реакционная способность олефинов при реакциях такого типа определяется их склонностью к образованию карбокатионов: Это означает, что удлинение и разветвление цепи углеродных атомов в олефине значительно повышает его способность к алкилированию: В ряде случаев алкилирование олефинами протекает под влиянием инициаторов радикально-цепных реакций, освещения или высокой температуры. Здесь промежуточными активными частицами являются свободные радикалы. Реакционная способность разных олефинов при таких реакциях значительно сближается. Требование к сырью. Ароматические углеводороды, применяемые для алкилирования, нужно предварительно осушать, для чего используют отгонку воды в виде азеотропной смеси с ароматическим углеводородом (бензол или толуол).При такой азеотропной осушке содержание влаги снижается до 0,002- 0,005%. Фракции низших олефинов поступают с газоразделительных установок пиролиза или крекинга достаточно сухими, но нередко содержат различные примеси, ведущие к повышенному расходу реагентов и катализатора, а также к образованию побочных веществ, от которых иногда трудно очистить целевой продукт. Нередко очистку фракции от этих веществ не проводят, допуская лишь наличие 2-3% примесей. Хлорид алюминия поступает на реакцию в виде жидкого каталитического комплекса, который готовят в аппарате с мешалкой при небольшом нагревании из технического AlCl3 диэтилбензола или примерно равных количеств бензола и диалкилбензола с небольшой добавкой хлорпроизводного или иногда воды. В последнее время рекомендовано готовить комплекс централизованно - из отходов металлического алюминия, ароматических углеводородов и безводного HCl: Реакционный узел. Периодический процесс проводят в реакторе с мешалкой и охлаждающей рубашкой, а иногда – со змеевиком. В реактор загружают бензол и АlСl3 или каталитический комплекс (10…20 % от объема реакционной массы), после чего при перемешивании добавляют жидкий олефин или хлорпроизводное, поддерживая заданную температуру. Переход к непрерывному процессу в случае жидких алкилирующих агентов осуществляется двумя основными способами. При первом из них используют трубчатый реактор (рис. 1, а), в нижней части которого имеется мощная мешалка, эмульгирующая реакционную массу. Исходные реагенты и отстоявшийся в сепараторе каталитический комплекс поступают в нижнюю часть реактора, а образующаяся эмульсия поднимается вверх по трубам и охлаждается водой, проходящей в межтрубном пространстве. В сепараторе углеводородный слой отделяют от каталитического комплекса и затем направляют на переработку. Время пребывания смеси в аппарате должно обеспечивать завершение реакции. Другой способ непрерывного проведения процесса для жидких алкилирующих агентов состоит в применении каскада из двух – четырех реакторов с мешалками (рис. 1, б). В первый аппарат подают исходные реагенты, а реакционная масса через боковой перелив перетекает в следующий реактор, проходя предварительно сепаратор; в нем каталитический комплекс отделяется и возвращается обратно в реактор. Устройство каскада обусловлено тем, что в единичном реакторе смешения трудно избежать потерь алкилирующего агента с готовым продуктом. Время пребывания реакционной массы в каскаде при температуре реакции 40…60 °С составляет ≈ 50 мин, причем оно определяется условиями отвода тепла и стремлением приблизиться к равновесию, благоприятному для получения моноалкилированных соединений. Алкилирование ароматических углеводородов газообразными олефинами проводят в барботажных колоннах (рис. 1, в), внутренняя поверхность которых защищена от коррозии кислотостойкими плитками. Жидкая реакционная масса, заполняющая колонну до бокового перелива, состоит из каталитического комплекса АlСl3 (20…40 % (об.)) и нерастворимой в нем смеси ароматических углеводородов. В нижнюю часть колонны подают сухой бензол и олефиновую фракцию, которая барботирует через жидкость, интенсивно ее перемешивая. Жидкая реакционная масса стекает через боковой перелив в сепаратор, где отстаивается более тяжелый каталитический комплекс, возвращаемый в низ алкилатора, а алкилат поступает на дальнейшую переработку.  40. Технология синтеза этилбензола, изопропил бензола. параметры процесса. Роль реакции переалкилирования и молярного соотношения реагентов. Схема. Параметры процесса.Температура реакции 100-140 °С, зависит от величины давления в реакторе алкилирования. Если применяются концентрированные фракции олефина, то обычно давление 0,1=0,20 МПа, и t=100°С, если t=120°С, то давление 3 Мпа. Высокие температуры применяют если для алкилирования используют несконцетрированные фракции олефинов. Каталитический комплекс готовят в растворе бензола, к которому добавлен диалкилбензол. Готовят при перешевании AlCl3 с растворителем при t= 50-60 °С. В качестве активатора комплекса в систему добавляют алкилхлорид (этилхлорид). В результате взаимодействия AlCl3 c растворителем образуется компелкс Густовстона, который катализирует реакцию алкилирования. Она экзотермическая, поэтому в реакторе для поддержании температуры процесса мы должны обеспечить эффект теплосъема. Кроме того т.к. в реакторе система гетерофазная, то в реакторе необходимо интенсивное перемешивание фаз, чтобы увеличить поверхность контакта и массообмена. Технологическая схема производства. На рисунке 2 изображена технологическая схема производства этил- или изо-пропилбензола алкилированием бензола газообразным олефином в присутствии АlСl3. Свежий бензол вместе с бензолом, возвращенным со стадии разделения, поступает в колонну 3, предназначенную для осушки бензола азеотропной ректификацией. Низкокипящая азеотропная смесь бензола с водой конденсируется в конденсаторе 4 и разделяется в сепараторе 5 на два слоя. Воду с растворенным в ней бензолом отводят (ее можно использовать для промывки реакционной массы), а бензольный слой стекает на верхнюю тарелку колонны 3, создавая орошение. Осушенный бензол из куба колонны 3 в теплообменнике 2 подогревает бензол, идущий на осушку, и попадает в сборник 8, откуда насосом непрерывно закачивается в алкилатор 9.  Каталитический комплекс готовят в аппарате 6 с мешалкой и рубашкой для обогрева паром. В него загружают полиалкилбензолы (ПАБ) или смесь бензола и полиалкилбензола (примерно в отношении 1:1) и хлорид алюминия (1 моль на 2,5…3,0 моль ароматических углеводородов), после чего при нагревании и перемешивании подают хлорпроизводное. Приготовленный комплекс периодически вводят в алкилатор. Реакция проводится в колонне-алкилаторе 9 с горячим сепаратором 12 для отделения каталитического комплекса и обратным конденсатором 10 для возвращения испарившегося бензола и отвода тепла. Олефин поступает в низ колонны, предварительно проходя расходомер. Бензол из емкости 8 поступает в низ алкилатора, как и конденсат из конденсатора 10. Газы, отходящие после конденсатора 10, содержат значительное количество паров легколетучего бензола (особенно при использовании разбавленных фракций олефинов). Для улавливания бензола эти газы направляют в абсорбер 13, который орошается полиалкилбензолами, выделенными из реакционной массы на стадии разделения. Собирающийся в нижней части абсорбера раствор бензола в полиалкилбензолах поступает в реакционный аппарат 9 для переалкилирования. Газы после абсорбера 13 промывают водой в скруббере 14 для удаления НСl и выводят в атмосферу или используют в качестве топочного газа. Углеводородный слой, отбираемый после сепаратора 12, состоит из бензола, моно- и полиалкилбензолов. В нем присутствуют также в небольшом количестве другие гомологи бензола, получившиеся за счет примесей олефинов в исходной фракции или путем частичной деструкции алкильной группы под действием АlСl3. При синтезе этил- и изопропилбензолов реакционная масса содержит 45…55 % бензола, 35…40 % моноалкилбензола, 8…12 % диалкилбензола и до 3 % более высокоалкилированных соединений, побочных продуктов и смол. Вся эта смесь проходит водяной холодильник 15 и дополнительно отстаивается в холодном сепараторе 16, откуда каталитический комплекс периодически возвращают в алкилатор. Алкилат направляют после этого на очистку от растворенного хлорида водорода и хлорида алюминия. С этой целью смесь промывают в системе противоточных колонн 17 и 18 вначале водой а затем – водной щелочью. Нейтрализованная смесь углеводородов (алкилат) поступает на ректификацию. Продукты реакции разделяют в нескольких непрерывно действующих ректификационных колоннах (на рисунке не по- казаны). В первой отгоняют бензол и воду, растворившуюся в углеводородах на стадии промывки. В следующей колонне в вакууме отгоняют фракцию, содержащую главным образом целевой продукт, но с примесью ближайших гомологов бензола. Ее подвергают затем дополнительной ректификации с выделением технического этил- или изопропилбензолов. Кубовая жидкость второй колонны содержит полиалкилбензолы с примесью продуктов осмоления, которые образуются под действием АlСl3. Полиалкилбензолы отгоняют в вакууме от смол и используют для абсорбции бензола из отходящих газов и приготовления каталитического комплекса. Через эти промежуточные операции полиалкилбензолы снова возвращают в аппарат 9, где их подвергают деалкилированию. Выход целевого продукта с учетом всех потерь достигает 94…95 % при расходе 5…10кг АlСl3 на 1 т моноалкилбензола. Рассмотренная технология алкилирования имеет ряд недостатков и непрерывно совершенствуется Так, образование большого объема сточных вод можно устранить, разлагая кислотный алкилат небольшим количеством воды; при этом получается концентрированный раствор гексагидрата АlСl3, находящий разнообразное применение. Предлагалось проводить неодинаковые по скорости процессы алкилирования бензола и переалкилирования полиалкилбензолов в разных аппаратах, что снижает количество рециркулята и энергетические затраты и позволяет работать при меньшем избытке бензола по отношению к олефину. 41.Процессы окисления в органическом синтазе. Жидкофазное окисление углеводородов. Механизм реакции. Роль инициатора, катализатора в процессе. Ингибиторы реакции. Широко используются для получения гидропероксидов, спиртов, карбоновые соединения,кислот и тд, В реакциях окисления наиболее широко в качестве окислителя для получения гидропероксидов используют О2 воздуха или технический О. Активными частицами являются свободные радикалы (R) углеводородные частица, R-O-O (перекисный растворитель), R-O (окси растворитель). Современная теория рассматривает процесс окисления как радикально-цепную реакцию с вырожденным разветвлением цепи. Механизм реакции включают стадии: 1.Инициирования 2.Роста цепи 3. Вырожденное разветвление 4.Обрыв цепи  За счет распада гидропероксидов появляется дополнительно свободные радикалы, которые также могут инициировать рост цепи, т.е. ускоряют реакции окисления.   т.е. при окислении углеводородов первичным молекулярным продуктом является гидропероксид, однако на ряду с ним в системе окисления образуется и другой кислород содержащий соединения: перекиси, спирты, кислоты, Н2О.Потому что реакция окисления протекала с высокой селективностью держат не высокую конверсию исходного углеводорода, как правило не более 30% масс. Реакционная способность вещества в реакции окисления определяется энергией связи СН отрыва атома Н+ и стабильностью образовавшегося радикала. |
