|
|
Максимально возможное число электронов на 3 энергетическом уровне
|
Невозможна следующая конфигурация в атоме
|
Молекула NaCl образована следующей химической связью
|
Соль, гидролизующаяся только по аниону
|
Соль, гидролизующаяся только по катиону
|
Соль, гидролизующаяся по катиону и аниону
|
Растворимость – это концентрация раствора
|
Какой продукт образуется из Cr2(SO4)3 в реакции Cr2(SO4)3+Br2+KOH
|
В результате реакции KMnO4+Na2SO3(в кислой среде) образуется
|
Из KMnO4 в результате реакции KMnO4+FeSO4+H2SO4 образуется следующее вещество
|
Из K2Cr2O7 в результате реакции K2Cr2O7+Na2SO3+H2SO4 образуется следующее вещество
|
Из KBr в результате реакции KBr+Cl2 образуется следующее вещество
|
Степень окисления марганца в перманганате калия
|
Степень окисления хлора в перхлорате калия
|
Степень окисления серы в сульфите калия
|
Бор использовал в своей модели атома
|
Главное квантовое число может принимать значения
|
Орбитальное квантовое число может принимать значения
|
Магнитное квантовое число может принимать значения
|
Спиновое квантовое число может принимать значения
|
Максимальная степень окисления железа равна
|
Степень окисления хрома в бихромате калия равна:
|
Заряд комплексного иона равен
в следующем комплексе:
|
Амминокомплексом является
|
Аквакомплексом является
|
Гидроксокомплексом является
|
Следующие электролиты при диссоциации в водном растворе образуют ионы водорода:
|
Растворитель-это компонент раствора
|
Белый осадок AgCl растворяется с образованием комплекса
|
Химическая кинетика – это наука
|
Константа равновесия равна
|
. Равновесие процесса
N2 + 3H2 2NH3
при повышении давления сместится в сторону
|
Константа скорости реакции зависит от
|
Для реакции
Zn + 2HCl (г) ZnCl2 + H2
при понижении давления равновесие сместится в сторону
|
Сильной кислотой является
|
Для слабых бинарных электролитов выражение 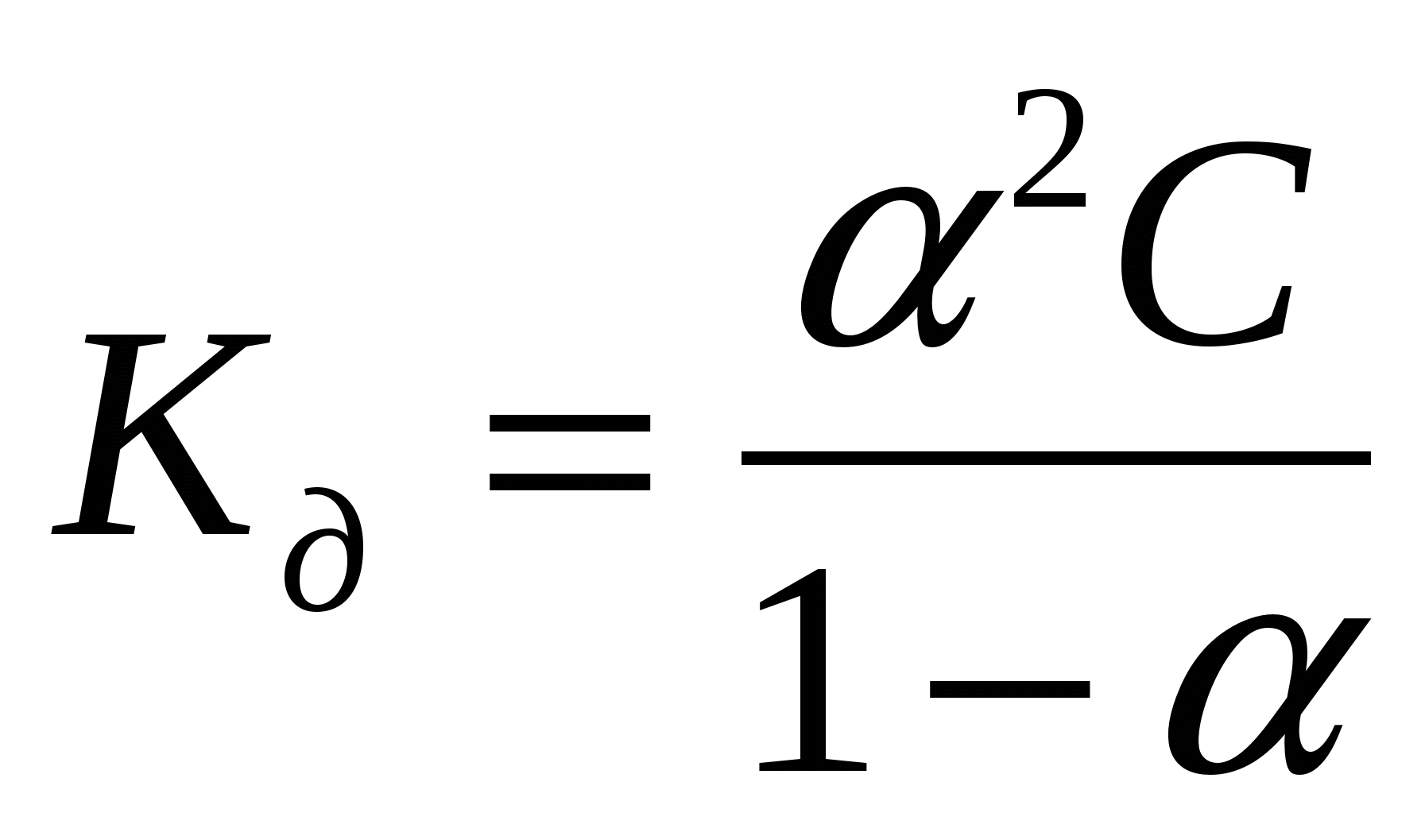
носит название
|
При 250С константа диссоциации уксусной кислоты равна 1,810-5. Степень диссоциации кислоты в 1 N водном растворе равна
|
Из приведенных электролитов выберите самый слабый
|
Слабым основанием является
|
Ионное произведение воды равно
|
Размерность энтропии
|
В изобарно-изотермических условиях реакции протекают самопроизвольно в направлении
|
Изменение энергии Гиббса в изобарно-изотермическом процессе вычисляется по формуле
|
Для определения влияния давления на температуру фазовых превращений в однокомпонентных системах постоянного состава применяют уравнение
|
Фенолфталеин в щелочной среде имеет цвет
|
Лакмус в кислой среде имеет цвет
|
Значение рН щелочного раствора рассчитывают по формуле
|
Среда водного раствора, водородный показатель которого
рН = 13,0
|
Электролиты – это
|
Степень диссоциации – это
|
Сильные электролиты – это вещества
|
Слабые электролиты – это вещества
|
Реакции
Fe(OH)3 + 3HCl FeCl3 + 3H2O
отвечает следующее ионное уравнение
|
В каком из этих соединений больше массовая доля водорода
|
Электролиз – это
|
Коррозия – это
|
Уравнение Нернста для электродов I рода
|
Царская водка – это
|
Горная порода доломит, химический состав которого соответствует формуле CaMg(CO3)2,
относится к классу:
|
Сусальное золото – это
|
Метасиликат натрия
|
СаС2+Н2О=С2Н2+Са(ОН)2Сколько литров ацетилена (н.у.) выделилось, если гидроксида кальция образовалось 7,4 г?
|
Какую максимальную степень окисления может проявлять атом рения?
|
Сколько фосфорной кислоты (М=98 г/моль) вступило в реакцию H3PO4+Ca(OH)2→
CaHPO4+2H2O, если в результате образовалось 36 г воды?
|
В каких единицах выражена универсальная газовая постоянная R, если ее значение равно 8,31
|
Моль – это
|
Требуется для реакции 0,5 моль гидроксида натрия. Этому количеству вещества соответствует его масса, равная
|
Одновременно в растворе могут находиться:
|
Для вычисления количества вещества газа уравнением Авогадро можно воспользоваться, если:
|
Хлорная кислота – это
|
Какой объем кислорода (н.у.) пойдет на сжигание 24 г магния 2Mg+O2=2MgO?
|
Присутствие хлоридов в водном растворе можно определить по образованию белого осадка с:
|
Эквивалент азота в аммиаке равен…
|
Вычислить эквивалентную массу металла, если при взаимодействии 24 г его с соляной кислотой образовалось 2 г водорода
|
Эквивалентная масса гидроксида натрия равна…
|
6,02·1023 молекул газа при нормальных условиях занимают объем:
|
В 98 г серной кислоты содержится водорода:
|
Постоянная Авогадро это:
|
Определить карбонатную породу можно
|
Массовую долю железа в Fe2(SO4)3 можно вычислить по формуле:
|
Первым доказательством сложного строения атома явилось открытие и изучение
|
Символ f соответствует значению орбитального квантового числа
|
С
Саша
реди перечисленных элементов наибольшее сродство к электрону имеет
|
У  атома никеля число электронов на внешнем уровне составляет: атома никеля число электронов на внешнем уровне составляет:
|
Состояние электрона в атоме описывается при помощи функции
|
На электронном энергетическом подуровне 6d могут разместиться
|
В ряду Mg – Al – Ca металлические свойства убывают или возрастают:
|
Координационное число железа в комплексе K[Fe(H2O)2(SO4)2] равно
|
Сколько протонов находится в ядре атома вольфрама?
|
Какое максимальное количество электронов может находиться на четвертом уровне?
|
Символы только d-элементов расположены в ряду:
|
Согласно квантовой теории, орбиталь – это:
|
Удаленность электрона от ядра атома определяется
|
В ряду гидроксидов Ва(OH)2 – Al(OH)3 – Si(OH)4 основные свойства:
|
Какая электронная конфигурация возможна?
|
Согласно теории Бора, энергия электрона в атоме
|
Набор значений магнитного квантового числа показывает
|
Электролитом является
|
Белый осадок при добавлении раствора нитрата серебра образует следующий комплекс
|
В водном растворе комплексные соединения диссоциируют на
|
Раствор отличается от химического соединения
|
Нормальная концентрация это
|
В одном килограмме 2 % раствора соляной кислоты масса растворенного вещества равна
|
Величина осмотического давления рассчитывается по формуле:
|
К понятию «сильный электролит» не относится высказывание:
|
Для какого из растворов концентрацией 0,1 моль/кг содержание ОН– будет наибольшим?
|
Выбрать способ расчета рН раствора сероводородной кислоты (H2S)
|
Гидролиз – это химическое взаимодействие с водой:
|
Буферный раствор образуется при реакции:
|
Растворимость соли всегда возрастает при
|
Раствор отличается от механической смеси …
|
Массовая доля это
|
Если в 2 кг раствора содержится 100 г серной кислоты, то массовая доля кислоты в растворе равна
|
Если в 2 литрах раствора содержится 0,8 г NaOH, то молярная концентрация раствора равна
|
В уравнении осмотического давления СМ - это
|
Фенолфталеин в щелочной среде имеет цвет
|
Реакции Al(OH)3+3HCl→AlCl3+3H2O
Отвечает следующее ионное уравнение
|
Сильную кислоту можно отличить от слабой по:
|
В растворе какой соли рН будет меньше 7?
|
Произведение растворимости это
|
В растворе содержится 1,6 кг воды и 400 г NaOH. Процентная концентрация раствора равна
|
Растворитель – это компонент раствора
|
Молярная доля это
|
Выбрать способ расчета рН раствора серной кислоты
|
Сильным основанием является
|
рН раствора (NH4)2SO4 рассчитывается следующим образом:
|
Растворимость BaSO4 можно понизить за счет:
|
Произведение растворимости гидроксида алюминия выражается формулой
|
Гидролиз нитрата аммония описывается уравнением
|
В окислительно-восстановительных реакциях K2Cr2O7 является:
|
при восстановлении перманганата калия в сернокислой среде образуется соединение:
|
Окислителем не является
|
В щелочной среде перманганат восстанавливается до степени окисления
|
Окислительно-восстановительная реакция пойдет под номером….
|
При протекании реакции KMnO4+Na2SO3+H2SO4=
Перманганат калия является
|
Правильные продукты реакции KMnO4+Na2SO3+KOH=указаны в номере….
|
равновесное состояние – это когда:
|
Для реакций, протекающих в объеме, скорость процесса определяется уравнением:
|
Во сколько раз возрастет скорость химической реакции при увеличении температуры системы на 200,если температурный коэффициент равен 2?
|
Во сколько раз возрастет скорость химической реакции при увеличении температуры системы на 100,если температурный коэффициент равен 2?
|
Для реакции:
Ba(NO3)2 + H2SO4 BaSO4 + 2HNO3
константа равновесия равна
|
Скорость реакции пропорциональна произведению концентраций реагентов в степенях, равных
|
Согласно правилу Вант-Гоффа, при повышении температуры на 100 скорость химической реакции:
|
Константа равновесия зависит
|
Для реакции:
СаСО3 СаО + СО2
при понижении давления равновесие сместится в сторону
|
Для реакции (считая ее элементарной) H2+I2=2HI скорость прямого процесса определяется уравнением:
|
К простым веществам относятся
|
Химический элемент- это
|
Относятся к основаниям:
|
Химическая формула - это
|
К минералам не относятся:
|
Реакциями соединения называются
|
Количество вещества рассчитывают по формуле –
|
Хлорная кислота это -
|
Сколько моль вещества содержится в 64 г
кислорода?
|
Одним из минералов, входящих в состав вольфрамовых руд, является шеелит. Его формула – CaWO4, а химическое название:
|
Карбонатами называются соли:
|
К благородным газам относятся:
|
К щелочным элементам относятся:
|
В земной коре наиболее распространены элементы
|
Эквивалентная масса кислорода
(г/моль)
|
Эквивалентный объем хлора составляет (л/моль)
|
Эквивалентная масса металла составляет 12.
Чему равна эквивалентная масса его оксида?
|
Эквивалентная масса азота в его оксиде составляет 7. Какой это оксид?
|
Бор использовал в своей модели атома
|
Главное квантовое число может принимать значения
|
Какую максимальную степень окисления может проявлять атом рения?
|
Число квантовых чисел, характеризующих состояние электронов в атомах элементов, равно
|
Порядок заполнения электронами орбиталей атома определяется принципами
|
"Запрет" Паули заключается в том, что
|
Максимальное число электронов на одной орбитали равно
|
Правило Хунда гласит:
|
К s-элементам относятся
|
К p-элементам относятся
|
К d-элементам относятся
|
К f- элементам относятся
|
В атоме кислорода число неспаренных электронов равно
|
В ряду элементов Li, Be, B, C,
N, O, F
Электроотрицательность возрастает или убывает
|
Химическая кинетика – это наука
|
Кинетическое уравнение химической реакции записывается в следующем виде:
|
|
 Скачать 3.08 Mb.
Скачать 3.08 Mb.

 атома никеля число электронов на внешнем уровне составляет:
атома никеля число электронов на внешнем уровне составляет: