Игорь
онстанта равновесия химической реакции: СО2 + С = 2СО имеет вид
В озможные степени окисления Сl озможные степени окисления Сl
|
Элемент, имеющий степень окисления, равной -2:
|
Закон Рауля формулируется следующим образом
|
Понижение температуры замерзания раствора можно найти как
|
Один из продуктов реакции FeCl3+KJ=
|
Ионное произведение чистой воды при 250 С равно
|
Водородный показатель (рН) - это
|
Эквивалентный объем кислорода составляет
|
Эквивалентная масса металла составляет 12. Чему равна эквивалентная масса его оксида?
|
При взаимодействии оксида кальция с водой образуется
|
К группе галогенов относится
|
Какой из указанных гидроксидов может образовать основную соль
|
Какая из данных кислот может образовать кислую соль
|
Ангидридом какой кислоты является Cl2O5
|
Сильной кислотой является
|
Хлорат кальция есть следующая соль
|
Царская водка – это
|
В теории Бора электрон может Вращаться
|
Побочное (орбитальное) число l характеризует
|
Главное квантовое число определяет
|
Главное квантовое число может принимать значения
|
Правило Хунда гласит:
|
Магнитное квантовое число Характеризует
|
Спиновое квантовое число определяет
|
К p-элементам относятся
|
Спиновое квантовое число может принимать значения
|
Cтепень окисления хрома в бихромате аммония равна
|
Максимальная степень окисления марганца равна
|
Химическая кинетика – это наука
|
Кинетическое уравнение химической реакции записывается в следующем виде:
|
Константа скорости химической реакции зависит от
|
По правилу Вант-Гоффа при повышении температуры
на 100 скорость реакции увеличивается
|
Величина К в выражении закона действующих масс называется
|
В молекуле Н2 связь:
|
Для реакции: aA+bBcC+dD
закон действующих масс выражается уравнением:
|
Принцип Ле Шателье заключается в следующем: если на систему, находящуюся в равновесии, оказать какое-либо внешнее воздействие, то равновесие в системе
|
В молекуле хлорида калия связь
|
Для реакции: CaCO3 = CaO + CO2 при
понижении давления равновесие сместится в сторону:
|
Константа ионизации воды равна:
|
Раствором называется:
|
Молярность раствора – это число молей растворенного вещества, приходящееся на
|
Единицы измерения нормальной концентрации -
|
Мольная доля растворенного
вещества показывает:
|
Изменение температуры кипения раствора
рассчитывается по формуле:
|
Критерием принципиальной
осуществимости процесса является
|
Электролиз – это
|
При р, Т = const изменение энергии Гиббса вычисляется
по формуле:
|
Найдите формулу комплексного соединения с
химическим названием: хлорид диакватетраамминоплатины (IV)?
|
Чему равен заряд комплексного
иона в соединении – гексацианоферрат калия (III)?
|
Процентная концентрация нитрата натрия в растворе, содержащем 25 г нитрата
натрия и 75 г воды:
|
В растворе содержится 1 кг воды и 56 г KOH. Моляльная
концентрация раствора равна
|
Присутствие сульфатов в водном растворе можно
определить по образованию белого осадка в присутствии
|
Электролитами называются:
|
Для слабых бинарных электролитов выражение
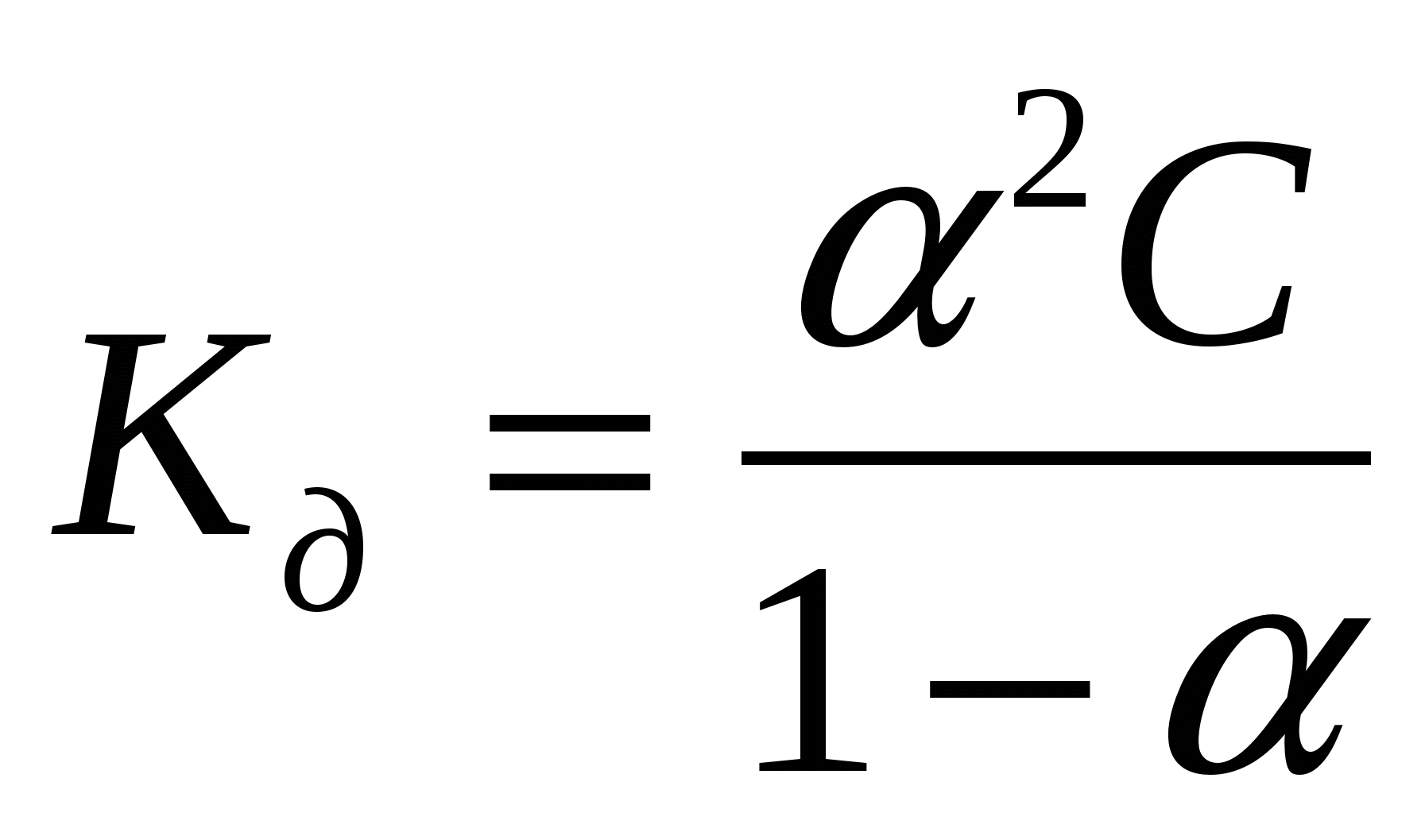 носит название носит название
|
В присутствии кислоты лакмус становится
|
Сильную кислоту можно отличить от слабой по:
|
Значение электродного
потенциала рассчитывается по уравнению:
|
Тиосульфатом натрия является соединение
|
Перхлоратом калия является соединение
|
Строению атома какого элемента отвечает электронная конфигурация 1s22s22p63s23p64s1
|
Нашатырный спирт – это
|
Карбонатом кальция является
|
Из перечисленных соединений кристаллогидратом является
|
Аммиаком является
|
Степень окисления S в ряду соединений H2S, S, SO2, H2SO4
Равна
|
Из перечисленных соединений к оксидам относятся
|
Метаалюминат кальция - это
|
Какова формула
гидроксохлорида магния?
|
Эквивалентный объем Cl2 составляет (л/моль)
|
Эквивалентная масса металла составляет 21. Чему равна
эквивалентная масса его оксида?
|
Главное квантовое число определяет
|
Магнитное квантовое число характеризует
|
Спиновое квантовое число определяет
|
Принцип Паули:
|
Какая из перечисленных электронных конфигураций
возможна?
|
В молекуле Н2 связь
|
Гидролизом называется
|
Соль,
гидролизующаяся только по аниону
|
В присутствии
кислоты лакмус становится
|
Термодинамика - это наука, изучающая
|
Тепловой эффект реакции больше 0,
реакция называется:
|
Изохорическим
называется процесс, протекающий в
системе при
Постоянном
|
Химический процесс называют
эндотермическим, если он протекает с
|
Закон Гесса необходим для
|
Стандартная энтальпия (теплота) образования - это
|
Электролиты – это
|
Слабые электролиты – это
|
Растворами называются
|
Криоскопическая
константа необходима для расчета
|
Размерность нормальной
Концентрации
|
Размерность молярной
Концентрации
|
Размерность моляльной
Концентрации
|
Размерность мольной доли
Растворенного вещества
|
20% раствор Na2SO4 содержит
|
2 М раствор H2SO4
содержит (объём 1 л)
|
1 N раствор H2SO4
содержит (объём 1 л)
|
Какая масса ( г ) LiBr содержится в
2 л 1 N раствора?
|
Объемы растворов
реагирующих веществ
|
На нейтрализацию 50 мл 0,2 N раствора
HCl потребовалось 10 мл раствора NaOH. Какова CN NaOH?
|
Данные соединения не могут находиться
совместно в растворе
|
Химическая
кинетика – это наука
|
Для реакции
aA+bBcC+dD закон действующих масс выражается
уравнением:
|
Окислителями называются
|
Восстановителем является
|
Один из продуктов
реакции: KMnO4+FeSO4+ +H2O=
|
Максимальная степень окисления селена
|
Ионное произведение воды
|
 Скачать 3.08 Mb.
Скачать 3.08 Mb.