З
Влад
акон сохранения массы гласит, что в ходе химической реакции остается постоянной
|
В первой половине XVIII века увеличение массы металла после прокаливания на воздухе объясняли
|
Гашеная известь – это
|
Эквивалентная масса карбоната натрия в реакции:
Na2CO3 + HCl = NaHCO3 + NaCl равна
|
Моль вещества это такое его количество, которое
|
В каком из этих соединений больше массовая доля водорода
|
Максимальная степень окисления железа равна
|
Бор использовал в своей модели атома
|
Главное квантовое число может принимать значения
|
Орбитальное квантовое число может принимать значения
|
Магнитное квантовое число может принимать значения
|
Спиновое квантовое число может принимать значения
|
Порядок заполнения электронами орбиталей атома определяется принципами
|
I правило Клечковского
|
Атом поглощает или излучает энергию при
|
Правило Хунда
|
Энергия химической связи тем больше, чем
|
Физический смысл орбитального квантового числа
(АО – атомная орбиталь)
|
Символы только
d – элементов расположены в ряду
|
Для какого металла в основном состоянии имеет место «провал» электрона типа:
1e
4s → 3d
|
Число неспаренных электронов в атоме золота равно
|
Максимально возможное число электронов на третьем энергетическом уровне
|
Амминокомплексом является
|
Элементом с конфигурацией внешнего слоя 3d104s1 является
|
Невозможна следующая конфигурация в атоме
|
Молекула HF образована следующей химической связью
|
Заряд комплексообразователя в комплексной соли K[Fe(H2O)2(SO4)2] равен:
|
Химическая связь в молекуле KCl называется
|
В ряду элементов Li, Be, B, C, N, O, F электроотрицательность
|
В атоме серы число неспаренных электронов равно
|
Химическая кинетика – это наука
|
Кинетическое уравнение химической реакции записывается в следующем виде:
|
Термодинамика есть наука, изучающая
|
Закон Гесса необходим для
|
Размерность энтальпии
|
При р, Т = const изменение энергии Гиббса вычисляется по формуле:
|
С увеличением температуры энтропия:
|
В результате изотермического процесса вся теплота
|
Пара следующих ионов может находиться совместно в растворе
|
Соль, гидролизующаяся только по катиону
|
Соль, гидролизующаяся только по аниону
|
Соль, гидролизующаяся по катиону и аниону
|
Растворимость – это концентрация насыщенного раствора
|
Нормальность – это, содержащееся в 1 л раствора количество
|
10 мл 0,2 N H2SO4 реагирует с 5 мл гидроксида натрия. Какова нормальная концентрация щелочи?
|
Моляльная концентрация измеряется в
|
Если смешать 35 г калийной селитры и 65 г воды, какова массовая доля KNO3 в растворе:
|
Сколько г гидроксида аммония нужно взять, чтобы получить 2 М раствор?
|
Константа равновесия равна
|
Константа скорости реакции зависит от
|
Осмос – это проникновение через полупронецаемую перегородку в раствор
|
Следующие электролиты при диссоциации в водном растворе образуют ионы водорода:
|
Равновесие процесса
N2 + 3H2 2NH3
при повышении давления сместится в сторону
|
Для реакции
Zn + 2HCl (г) ZnCl2 + H2
при понижении давления равновесие сместится в сторону
|
Раствор отличается от химического соединения
|
Растворитель-это компонент раствора
|
Растворимость хлорида натрия выше в
|
Электролиты – это
|
По величине степени диссоциации электролиты делятся
|
Сильной кислотой является
|
Для слабых бинарных электролитов выражение 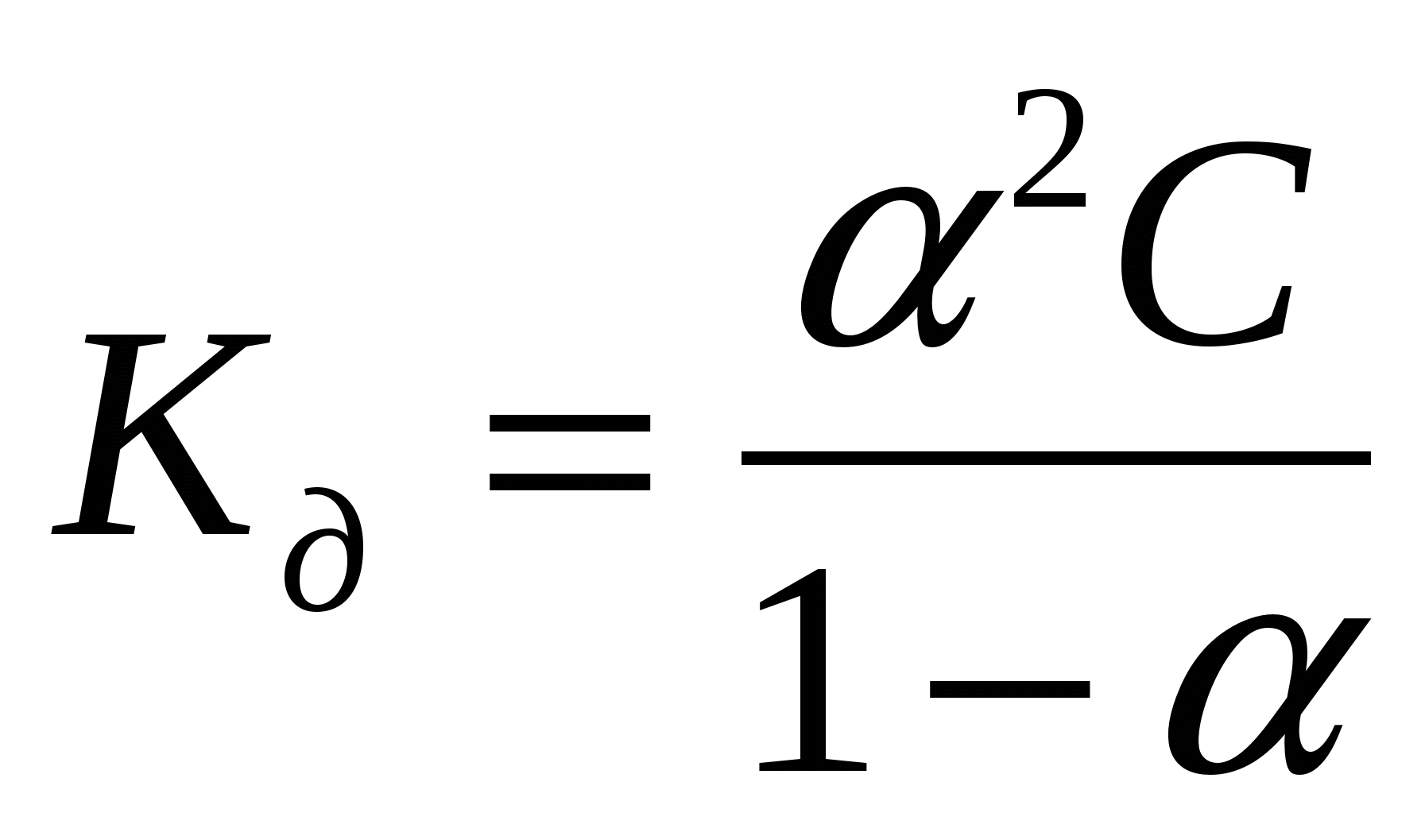
носит название
|
При 250С константа диссоциации уксусной кислоты равна 1,810-5. Степень диссоциации кислоты в 1 N водном растворе равна
|
Из приведенных электролитов выберите самый слабый
|
Слабым основанием является
|
Ионное произведение воды равно
|
Индикаторы – это
|
Фенолфталеин в щелочной среде имеет цвет
|
Лакмус в кислой среде имеет цвет
|
Окраска лакмуса в щелочной среде
|
Значение рН щелочного раствора рассчитывают по формуле
|
рН в 0,0001 N растворе гидроксида калия равен:
|
Среда водного раствора, водородный показатель которого рН = 13,0
|
Диссоциация ортофосфорной кислоты по второй ступени описывается уравнением
|
Реакции
Fe(OH)3 + 3HCl FeCl3 + 3H2O
отвечает следующее ионное уравнение
|
Реакции
Al2(SO4)3 + 3BaCl2 2AlCl3 + 3BaSO4 отвечает следующее ионное уравнение
|
В растворе хлорида цинка среда
|
В растворе сульфата калия среда
|
Электролиз – это
|
Коррозия – это
|
Температура замерзания раствора
|
Изменение температуры кипения раствора рассчитывается по формуле:
|
Окислителями являются
|
Восстановителем является
|
Марганец восстанавливается по схеме Mn+7+5e=Mn+2
|
Укажите, какие из приведенных процессов представляют собой окисление
|
В нейтральной среде взаимодействие KMnO4 с Na2SO3 приводит к образованию:
|
Из KMnO4 в результате реакции KMnO4+FeSO4+H2SO4 образуется следующее вещество
|
В результате реакции K2Cr2O7+Na2SO3+H2SO4 образуется следующее вещество
|
В результате реакции KBr+Cl2 образуется следующее вещество
|
В результате реакции H2SO3+H2S образуется следующее вещество
|
В результате реакции Cu+HNO3(k) образуется следующее вещество
|
В результате реакции KMnO4+Na2SO3+KOH образуется следующее вещество
|
Наиболее характерные степени окисления для железа
|
Имеет степени окисления
–1, 0, +1, +3, +5, +7
|
Степень окисления хрома в дихромате калия
|
Уравнение Нернста для электродов I рода
|
При растворении в щелочах свинец проявляет степень окисления, равную
|
Царская водка – это
|
Малахит – это
|
Горная порода доломит, химический состав которого соответствует формуле CaMg(CO3)2,
относится к классу:
|
Эквивалент химического элемента зависит от
|
Эквивалентный объем водорода составляет
|
Эквивалентная масса металла составляет 9. Чему равна эквивалентная масса его оксида?
|
Эквивалентная масса азота в его оксиде составляет 7. Какова формула оксида?
|
Н
Слава
ормальная концентрация есть отношение
|
М  оляльная концентрация есть отношение оляльная концентрация есть отношение
|
Мольная доля есть отношение
|
Молярная концентрация есть отношение
|
Процентная концентрация есть отношение
|
Присутствие сульфатов в водном растворе можно определить по образованию белого осадка с
|
Осмотическое давление есть такое давление, которое
|
Процесс осмоса характеризуется
|
Кинетическое уравнение химической реакции записывается в следующем виде:
|
Закон Рауля формулируется следующим образом
|
Эбуллиоскопическая константа необходима для расчета
|
Криоскопическая константа необходима для расчета
|
Термодинамика – наука, изучающая
|
Размерность энтальпии:
|
Энергия Гиббса – это термодинамический потенциал в
|
В результате изотермического процесса вся теплота
|
Согласно постулата Планка для идеального кристалла при 0 К равна нулю
|
Математическое выражение первого начала термодинамики имеет следующий вид
|
Закон Гесса необходим для
|
Абсолютный нуль (-273,15 С) – это температура, при которой происходит
|
В результате изотермического процесса вся теплота
|
Энтропия возрастает в процессе
|
Энергия химической связи тем больше, чем
|
Физический смысл орбитального квантового числа
АО – атомная орбиталь
|
Число неспаренных электронов в атоме золота равно
|
 Скачать 3.08 Mb.
Скачать 3.08 Mb.