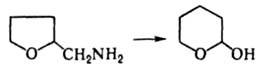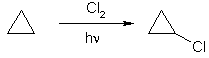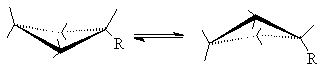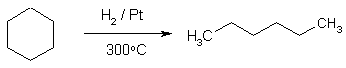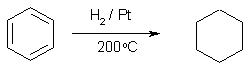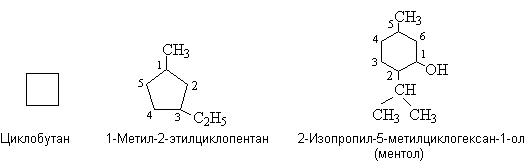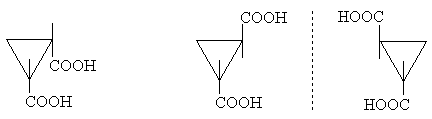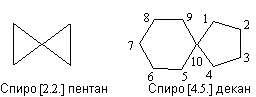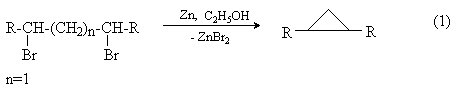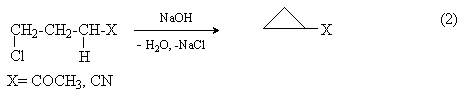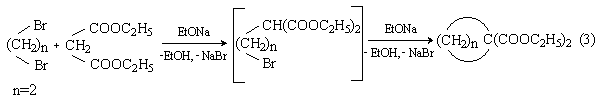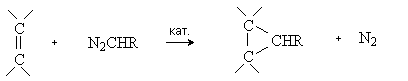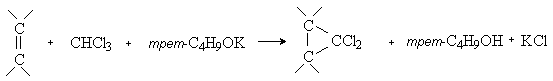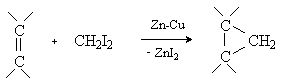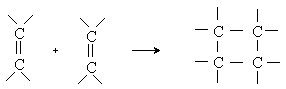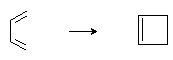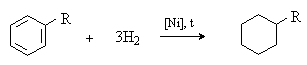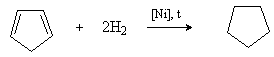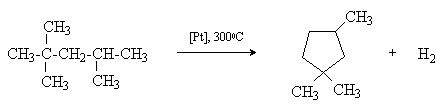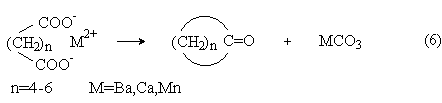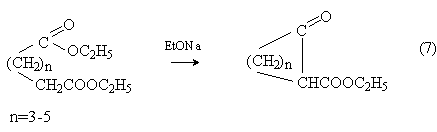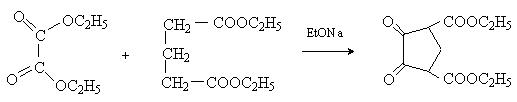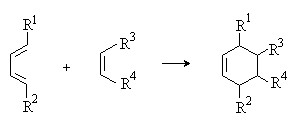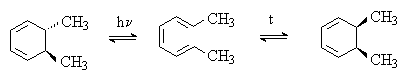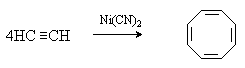|
|
Тема 19. Циклоалканы. Алициклические соединения
АЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
План
Классификация, изомерия, номенклатура.
Методы получения.
Физические свойства и строение.
Химические свойства.
К алициклическим относят все карбоциклические соединения, кроме ароматических.
1. Классификация, номенклатура, изомерия
Алициклы классифицируют по степени насыщенности, размерам цикла, числу циклов, способу их соединения.
Циклоалканы содержат только простые связи, циклоалкены – одну двойную связь, циклоалкадиены – две двойные связи, циклоалкатриены – три и т.д. Циклы с числом атомов более 7 могут содержать тройную связь (циклоалкины).
По размеру цикла различают малые циклы (С3-С4), обычные циклы (С5-С7), средние циклы (С8-С11), макроциклы (С13 и более).
По числу циклов в молекуле различают моно- и полициклические соединения.
Моноциклоалканы имеют общую формулу СnH2n. Их систематические названия образуют, добавляя приставку цикло- к названию алкана с таким же числом атомов углерода. Замещенные циклоалканы и их функциональные производные называют и нумеруют в соответствии с общими правилами.
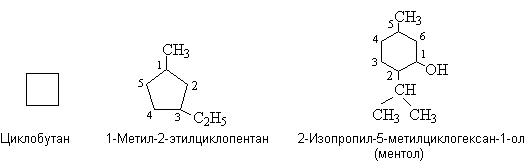
Для моноциклоалканов характерны изомерия углеродного скелета, связанная с разной величиной цикла, изомерия боковых цепей, изомерия положения заместителей в цикле. Моноциклоалканы изомерны алкенам.
При наличии в цикле двух и более заместителей возможна стереоизомерия. Цикл, подобно двойной связи, препятствует свободному вращению, что приводит к существованию цис- и транс- изомеров (для циклов, содержащих не более 7 атомов углерода). Замещенные атомы в цикле могут быть хиральными, что приводит к оптической изомерии. Однако хиральность циклических структур легче устанавливать, оценивая элементы симметрии молекула как целого. Например, цис-циклопропан-1,2-дикарбоновая кислота имеет плоскость симметрии и ахиральна. транс-Изомер не имеет плоскости симметрии и существует в виде пары оптических антиподов.
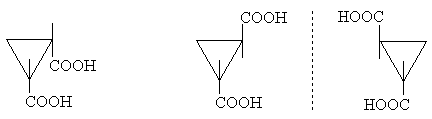
Полициклоалканы имеют общую формулу от СnH2n-2m, где m –число циклов в молекуле. По способу соединения циклов различают изолированные, спирановые, конденсированные и мостиковые структуры.
Изолированные циклы не имеют общих атомов углерода. Для составления их названий обычно используют рациональную номенклатуру.
В спирановых соединениях циклы имеют один общий атом углерода. За основу названия спироалканов берут название алкана с тем же числом атомов углерода и добавляют приставку спиро-. Цифрами в квадратных скобках указывают число атомов углерода в каждом цикле, не считая общего (узлового) атома углерода. Нумерацию начинают с цикла меньшего размера, узловой атом углерода нумеруют последним.
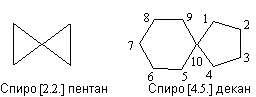
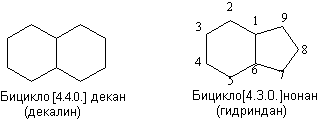
Конденсированные циклы содержат два общих атома углерода.
Мостиковые структуры содержат циклы с тремя и более общими атомами углерода.
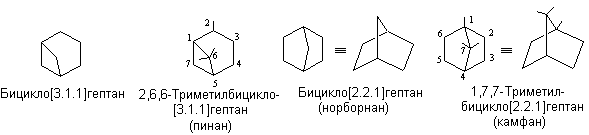
В конденсированных и мостиковых структурах основу названия составляет соответствующий ациклический углеводород с таким же числом атомов углерода. В приставке указывают число циклов (бицикло-, трицикло- т.д.). Для определения числа циклов в полициклоалкане подсчитывают количество связей, которые необходимо разорвать для превращения его в соединение с открытой цепью. Числами в квадратных скобках указывают количество атомов в мостиках, связывающих узловые атомы. Атомы нумеруют, начиная с узлового. Сначала нумеруют цикл большего размера по наиболее длинному пути между двумя узловыми атомами, а затем мостиковые атомы углерода.
Особое место среди полициклоалканов занимают каркасные соединения, в том числе полиэдраны (общая формула СnHn), которые имеют жесткую структуру правильного многогранника.
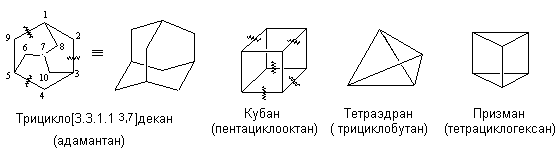
Их номенклатура сложна, поэтому часто используют тривиальные названия. Каркасные соединения представляют собой жесткие напряженные структуры со значительным искажением валентных углов и длин связей. Исключение составляет адамантан, пространственное расположение атомов в котором соответствует кристаллической решетке алмаза.
2. Методы получения
Существует три основных пути синтеза алициклических соединений: 1) из ациклических соединений; 2) из ароматических и гетероциклических соединений; 3) взаимными превращениями алициклов.
К первой группе методов относятся многочисленные реакции циклизации, среди которых можно выделить следующие.
Внутримолекулярная (реже межмолекулярная) циклизация бифункциональных соединений, которые содержат подходящим образом расположенные функциональные группы, способные взаимодействовать с образование С-С связи путем известных реакций замещения, присоединения, отщепления.
Реакции циклоприсоединения - межмолекулярные процессы с образованием цикла из двух ненасыщенных молекул без отщепления каких либо групп или атомов, протекающие, как правило, по синхронному механизму (перициклические реакции).
Циклоолигомеризация непредельных соединений в условиях металлокомплексного катализа.
Среди методов второй группы наибольшее значение имеет гидрирование ароматических соединений с образованием шестичленных алициклов.
Третья группа методов включает реакции расширения или сужения циклов путем перегруппировок.
Использование того или иного метода синтеза зависит прежде всего от размера цикла. Легче других образуются термодинамически устойчивые обычные циклы. Процессы их образования в результате внутримолекулярной циклизации характеризуются низкими энтальпиями активации (низкая энергия напряжения переходного состояния) и энтропиями активации (высокая вероятность образования клешневидной конформации, в которой сближены реакционные центры, участвующие в процессе циклизации). Синтез малых циклов также осуществляется достаточно легко, несмотря на их низкую термодинамическую стабильность, так как процессу циклизации благоприятствует близкое расположение реакционных центров (энтропийный фактор). Наибольшие трудности связаны с синтезом циклов среднего размера, поскольку и энтальпийный фактор (высоконапряженное переходное состояние), и энтропийный фактор (низкая вероятность сближения реакционных центров, расположенных на разных концах молекулы) не благоприятствуют циклизации.
Большинство реакций циклизации приводит к функциональным производным алициклических углеводородов (кетонам, сложным эфирам и др.), из которых они могут быть получены известными методами (восстановление, декарбоксилирование).
Малые циклы
Циклопропан.
1) Реакции 1,3-элиминирования.
1,3-Дигалогениды взаимодействуют с металлами (цинк, магний, натрий, амальгама лития) с образованием циклопропанов. Реакция представляет собой внутримолекулярный вариант синтеза Вюрца.Наилучшие результаты дает применение цинковой пыли в спирте.
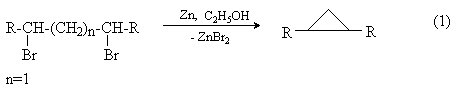
g-Галогенкетоны, сложные эфиры и нитрилы g -галогенкарбоновых кислот как СН-кислоты отщепляют галогеноводороды под действием сильных оснований с образованием функциональных производных циклопропана.
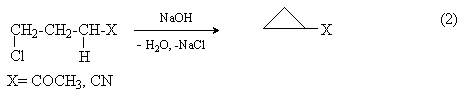
2) Циклоалкилирование 1,2-дигалогеналканами соединений с активной метиленовой группой.
1,2-Дигалогениды алкилируют натриймалоновый эфир и другие соединения с активной СН2-группой с образованием циклических продуктов диалкилирования:
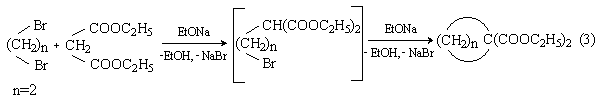
3) Реакции [2+1]-циклоприсоединения (циклопропанирование).
Карбены присоединяются по двойной связи углерод-углерод с образованием циклопропанового кольца:
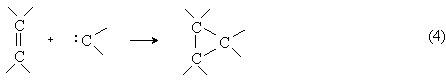
Существует несколько способов циклопропанирования, отличающихся методами генерирования карбенов:
разложением алифатических диазосоединений в присутствии катализаторов – комплексов меди:
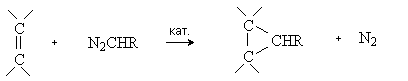
из хлороформа под действием оснований: 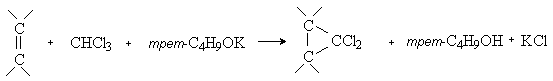
генерированием карбеноидов из дииодметана:
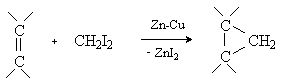
Циклобутан
1) Дегалогенирование 1,4-дигалогеналканов (схема 1, n=2).
2) Циклоалкилирование 1,3-дигалогеналканами соединений с активной метиленовой группой. (схема 3, n=3).
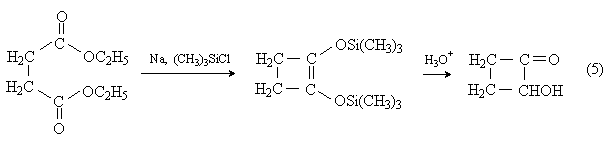
3) Ацилоиновая конденсация.
2-Гидроксибутанон (ацилоин) может быть получен внутримолекулярной ацилоиновой конденсацией диэтилового эфира янтарной кислоты в присутствии триметилхлорсилана:
4) [2+2]-Циклоприсоединение.
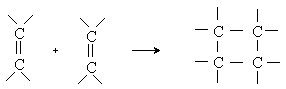
Алкены и их производные вступают в реакции циклоприсоединения с образованием циклобутанового кольца:
Реакции инициируется нагреванием или облучением:
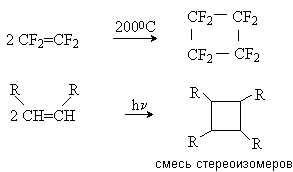
5) Электроциклические реакции 1,3-диенов.
Сопряженные диены вступают в реакцию внутримолекулярной циклизации с образованием новойs -связи по концам сопряженной системы:
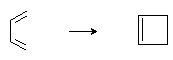
Реакция протекает по синхронному механизму и инициируется термически или фотохимически. Стереохимический результат реакции определяется правилами орбитальной симметрии и зависит от способа инициирования:
Обычные циклы
Циклогексан, циклопентан и их гомологи получают при переработке нефти (нафтены). Синтетически они могут быть получены следующими методами.
1) Восстановление аренов и ненасыщенных алициклических соединений.
Циклогексан и его гомологи получают каталитическим гидрированием бензола и гомологов бензола:
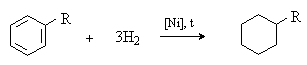
Циклопентан может быть получен гидрированием ненасыщенного алициклического углеводорода циклопентадиена (содержится в продуктах переработки каменного угля и нефти).
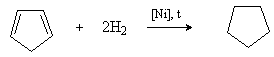
2) Дегидроциклизация алканов.
При пропускании над платиновым катализатором при 3000С алифатических углеводородов с пятью углеродными атомами в цепи происходит их дегидроциклизация с образованием циклопентана и его гомологов, например:
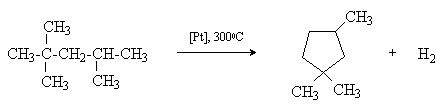
Если алкан содержит цепь из 6 и более атомов углерода, то происходит замыкание шестичленного цикла, который при отсутствии в цикле четвертичного атома углерода далее дегидрируется в бензол или его гомолог.
3) Внутримолекулярная циклизация производных дикарбоновых килот..
Обычные циклы легко образуются в результате внутримолекулярной циклизации a,w -бифункциональных соединений, содержащих функциональные группы, способные взаимодействовать с образованием С-С связи. Такие реакции являются внутримолекулярными аналогами известных межмолекулярных реакций.
Сухая перегонка солей дикарбоновых кислот и щелочно-земельных металлов приводит к образованию циклических кетонов:
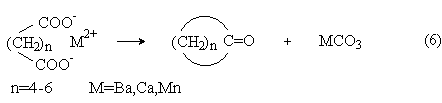
Внутримолекулярной сложноэфирной конденсацией эфиров дикарбоновых кислот (конденсация Дикмана) получают циклические кетоэфиры
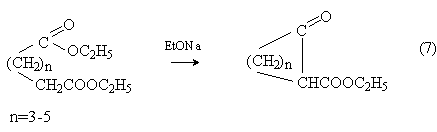
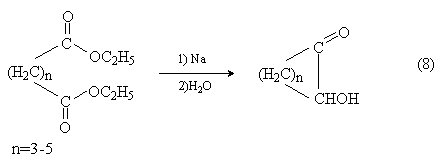
Внутримолекулярная ацилоиновая конденсация дает циклические ацилоины:
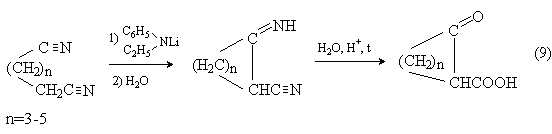
Внутримолекулярная циклизация динитрилов карбоновых кислот (метод Торпа-Циглера) приводит к иминонитрилам и далее к кетокислотам:
4) Межмолекулярная сложноэфирная конденсация.
Перекрестной сложнофирной конденсацией эфиров щавелевой (не содержит атомов водорода вa -положении и не может, следовательно, выступать в качестве метиленовой компоненты) и глутаровой кислот получают производные 1,2-циклопентандиона:
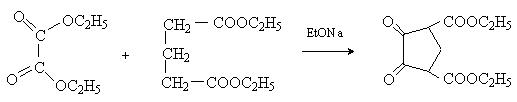
Сложноэфирная конденсация эфира янтарной кислоты дает производные 1,4-гександиона:
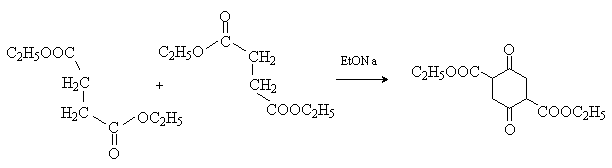
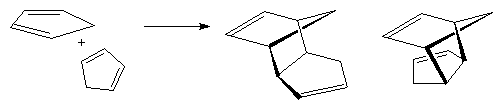
5) Реакции [2+4]-циклоприсоединения (реакция Дильса-Альдера)
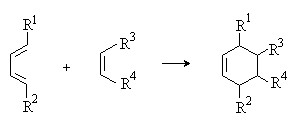
Важный метод синтеза шестичленных циклов. См. лек.№14.
6) Электроциклические реакции сопряженных триенов.
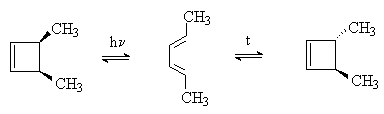
Производные 1,3,5-гексатриена при нагревании или облучении циклизуются в производные 1,3-циклогексадиена. При термической циклизации образуются цис-, а при фотохимической – транс-дизамещенные циклогексадиены:
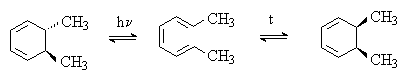
Средние циклы
1) Внутримолекулярная циклизация производных дикарбоновых кислот.
Синтез циклов среднего размера путем внутримолекулярной циклизации, как правило, дает очень низкие выходы целевых продуктов. По причинам, которые были рассмотрены выше, предпочтительным оказывается межмолекулярное взаимодействие, приводящее к линейным димерам и полимерам. Для подавления межмолекулярного взаимодействия реакции проводят в условиях сверхразбавления, которое должно препятствовать межмолекулярному взаимодействию (бимолекулярной реакции). Однако и в этих условиях выходы продуктов циклизации низки.
Исключение составляет ацилоиновая конденсация, которая дает высокие выходы средних циклов (схема 8, n>6). Это гетерогенный процесс, протекающий на поверхности металлического натрия. Гетерогенные условия реакции способствуют циклизации. При высоком разбавлении электронодефицитные центры на концах молекулы адсорбируются на поверхности натрия, сближаются и взаимодействуют с образованием цикла.
2) Реакции циклоолигомеризации.
Циклотетрамеризация ацетилена в присутствии солей никеля дает циклооктатетраен:
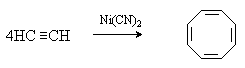
Циклодимеризацией и циклотримеризацией 1,3-бутадиена на металлокомплексных катализаторах получают соответственно 1,5-циклооктадиен и 1,5,9-циклододекатриен:
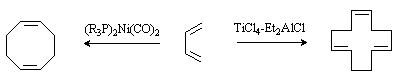
Селективное протекание процесса обеспечивается предварительной координацией ненасыщенного соединения вокруг комплексообразователя за счет образования p -комплекса . В результате этого формируется взаимное расположение молекул субстрата, близкое по геометрии к переходному состоянию, ведущему к образованию циклического продукта определенного строения.
3. Физические свойства и строение
Физические свойства циклоалканов аналогичны свойствам алканов. Это бесцветные нерастворимые в воде вещества. Циклопропан и циклобутан – газы, циклоалканы С5-С11 – жидкости, начиная с С12 – твердые вещества. Температуры кипения и плавления, а также плотности у циклоалканов несколько выше, чем у соответствующих алканов, что связано с большей упорядоченностью циклических структур.
Циклоалканы обладают разной термодинамической стабильностью, которая зависит от размера цикла. Это связано с существованием у циклических молекул напряжения. Напряжение возникает в результате отклонения параметров молекулы от стандартных величин. В циклических структурахсуществует три основных вида напряжения.
Угловое напряжение (напряжение Байера) обусловлено отклонением валентных углов в цикле от стандартных значений.
Торсионное напряжение (напряжение Питцера) – напряжение, вызванное заслоненным положением химических связей.
Напряжение Ван-дер-Ваальса обусловленовзаимодействиями между валентно не связанными атомами при их сближении на расстояние меньшее суммы ван-дер-ваальсовых радиусов. В циклах этот тип напряжения проявляется во взаимодействии между атомами, расположенными на противоположных сторонах. Такие взаимодействия называют трансаннулярными, а возникающее в результате напряжение - трансаннулярным (или напряжением Прелога).
Молекулы стремятся принять конформацию, свободную от всех видов напряжения. Циклические молекулы, как правило, не могут полностью освободиться от напряжения, так как для них снятие одного вида напряжения приводит к увеличению другого. Поэтому они стремятся принять конформацию, в которой сумма всех видов напряжения минимальна.
Напряжение молекулы количественно выражается её избыточной энергией по сравнению со стандартным соединением, в котором все структурные параметры (длины связей, валентные углы, расстояния между валентно не связанными атомами) не отклоняются от стандартных значений и все связи находятся в заторможенных конформациях. Эта избыточная энергия называется энергией напряжения. Энергия напряжения определяется как разность энтальпий образования исследуемого вещества и стандартного вещества. Для циклоалканов стандартом служит линейный алкан с длинной цепью или циклогексан. И тот, и другой практически свободны от всех видов напряжения. Для сравнения термодинамической устойчивости циклоалканов используют энергию напряжения в расчете на одну группу СН2. Наибольшее напряжение существует в малых и средних циклах. Обычные циклы и макроциклы практически свободны от напряжения.
Малые циклы
Циклопропан
Молекулы циклопропана представляет собой правильный треугольник. Связи С-Н расположены в плоскости, перпендикулярной плоскости цикла.

Это означает, что в молекуле циклопропана существует значительное угловое напряжение (валентные углы в цикле 600 вместо 1090 для sp3-гибридизации) и торсионное напряжение (все связи неизбежно находятся в заслоненном положении). Как результат этого, циклопропан имеет наибольшую среди циклоалканов энергию напряжения в расчете на одну группу СН2.
Связи С-С и С-Н в циклопропане отличаются от связей в алканах. Гибридные орбитали атомов углерода в циклопропане неэквивалентны. Орбитали, за счет которых образуются связи С-Н, имеют больший s-характер по сравнению с sp3 –гибридными орбиталями. Орбитали, образующие С-С связи, имеют меньший s-характер и, следовательно, близки по характеру к р-орбиталям. В силу геометрии молекулы при образовании С-С связей не достигается максимальное перекрывание атомных орбиталей. Орбитали перекрываются не на линии, связывающей центры атомов, а в стороне от кольца. Такие связи называют t -связями (“банановые” связи). По своему характеру они занимают промежуточное положение между s - и p -связями. Доказательством частичного p -характера С-С связей в циклопропане является сравнительно низкая энергия ионизации (для пропана 11,5 эВ, циклопропана – 10,5 эВ, пропена – 9,7.эВ), а также способность циклопропанового кольца к сопряжению с p -связями, что проявляется в спектральных характеристиках винилциклопропанов и их химических свойствах.
Циклобутан
сложенная
|
плоская
|
сложенная
|
В случае плоского строения молекула циклобутана должна иметь угловое напряжение (валентные углы в цикле 900 вместо 1090) и торсионное напряжение (все связи находятся в заслоненном положении). В действительности циклобутан имеет неплоское строение. Он существует преимущественно в сложенной конформации с углом между плоскостями 1450. Переход в сложенную конформацию уменьшает торсионное напряжение, так как связи переходят в частично скошенное положение. Однако при этом увеличивается угловое напряжение за счет уменьшения углов. Разница в энергиях между плоской и сложенной конформациями невелика
Искажение валентных углов приводит к тому, что связи в циклобутане изогнуты, но в значительно меньшей степени, чем в циклопропане. Общая напряженность молекулы циклобутана достаточно велика, но она меньше, чем у циклопропана (см. таблицу 44.1).
Обычные циклы
Циклопентан
Плоский циклопентан практически лишен углового напряжения (валентные углы в цикле 1080 вместо 1090), но имеет значительное торсионное напряжение (заслоненное положение связей). Уменьшение энергии реальной молекулы циклопентана происходит за счет вывода из плоскости одного (конформация “конверт”) или двух соседних (конформация “твист”) атомов углерода.

При этом уменьшается торсионное напряжение, так как несколько связей переходят из заслоненного в скошенное положение. Одновременно происходит некоторое искажение валентных углов. Таким образом, молекула циклопентана имеет небольшое угловое и торсионное напряжения. Выигрыш в энергии при переходе из плоской конформации в конформации “конверт” или “твист” составляет 22 кДж/моль. Неплоские конформации циклопентана близки по энергии и быстро переходят друг в друга. При этом поочередно отгибаются все пять углов цикла, который, таким образом, находится в волнообразном движении (“псевдовращение”).
Циклогексан
Незамещенный циклогексан
В случае плоского строения циклогексан имел бы значительное угловое напряжение (валентные углы в цикле 1200 вместо 1090) и торсионное напряжение. Термодинамические измерения показывают, что циклогексан практически лишен всех видов напряжения.
Молекула циклогексана может существовать в виде нескольких неплоских конформаций, в которых сохраняются нормальные валентные углы:
 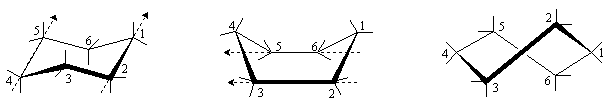
Наиболее устойчивой из них является конформация “кресло”, которая лишена углового и торсионного напряжения. Рассмотрение проекций Ньюмена для любого из четырехуглеродных (бутаноподобных) фрагментов показывает, что в этой конформации нет заслоненных положений С-С и С-Н связей, а расположение С-С- связей такое же, как в скошенной конформации бутана.
Конформация “ванна”, несмотря на нормальные валентные углы, значительно менее устойчива. Это обусловлено торсионным напряжением, так как в заслоненном положении оказываются связи С-Н в положениях 2 и 3, 5 и 6 в основании ванны. Кроме того, возникает ван-дер-ваальсово напряжение между “бушпритными” атомами Н в вершинах “ванны” (положения 1 и 4), которые сближаются на расстояние, меньшее суммы их радиусов. В результате форма “ванны” на 29 кДж/моль превышает по энергии форму “кресла”.
“Твист” –конформация может быть получена из конформации “ванна” путем скручивания её вокруг центральной оси. При этом атомы С1 и С4 удаляются друг от друга, что приводит к устранению ван-дер-ваальсова напряжения, а атомы Н в основании ванны частично выводятся из заслоненного положения, что уменьшает торсионное напряжение. Т. о., конформация “твист” беднее энергией, чем конформация “ванны”, но превышает по энергии конформацию “кресла”.
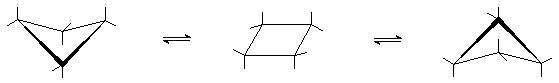
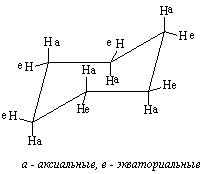
При обычных температурах циклогексан на 99,9% существует в конформации “кресла”. В этой конформации циклогексан имеет два типа связей С-Н: аксиальные (а) иэкваториальные (е). Аксиальные связи ориентированы параллельно оси симметрии цикла и направлены попеременно вверх и вниз. Экваториальные связи расположены под углом 1090 к оси симметрии цикла и направлены также попеременно вверх и вниз. Для незамещенного циклогексана возможны две энергетически равноценные конформации “кресла”, которые превращаются друг в друга путем вращения вокруг С-С связей. Такое превращение называют интерконверсией цикла. При интерконверсии все экваториальные связи переходят в аксиальные и наоборот.
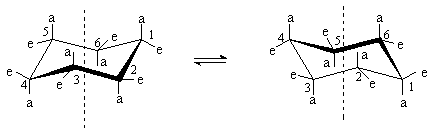
Взаимопревращение между двумя конформациями “кресла” происходит через ряд менее устойчивых форм. Механизм интерконверсии может быть представлен следующей схемой.

“кресло”
|
“полукресло”
|
“твист”
|
“ванна”
|
“твист”
|
“полукресло”
|
“кресло”
|
Конформация “кресло” переходит в “твист”-форму через стадию образования неустойчивой конформации “полукресло”, в которой в одной плоскости находятся четыре соседних атома углерода. Т. о., конформация “полукресло” является переходным состоянием между конформациями “кресло” и “твист”. Далее “твист”-конформация через конформацию “ванны” скручивается в другую сторону и превращается в альтернативную “твист”-конформацию и далее
ДЕМЬЯНОВА ПЕРЕГРУППИРОВКА, расширение или сужение алициклов на один атом углерода при дезаминировании первичных аминов азотистой к-той. Расширение изучено для 3-8-членных циклов, сужение - для 4- и 6-членных, напр.:
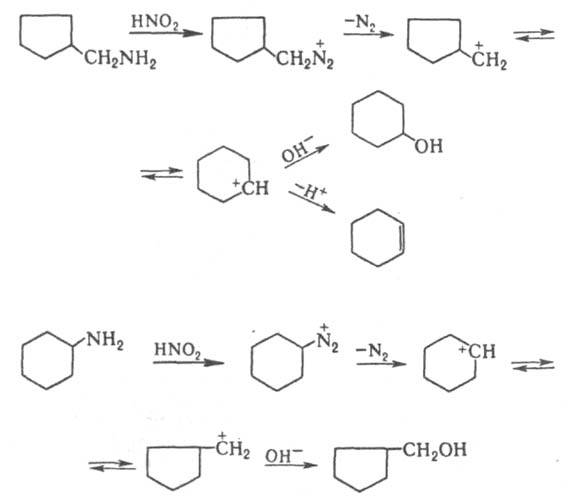
Механизм р-ции включает образование карбениевых ионов. Подобно Демьянова перегруппировке осуществляется р-ция HNO2 с нек-рыми 5-членными азот-, кислород- или серосодержащими гетероциклич. аминами, напр.:
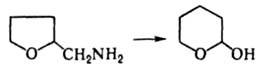
Демьянова перегруппировка родственна Тиффено реакции, в к-рой под действием HNO2 происходит превращение 1-аминометилциклоалкан-1-олов с расширением цикла. Демьянова перегруппировка применяется гл. обр. в синтезе полициклич. соединений. Открыта перегруппировка Н. Я. Демьяновым в 1903.
Строение циклоалканов
Свойства циклоалканов в зависимости от размера цикла имеют свои особенности, и поэтому целесообразно рассматривать их для каждого цикла отдельно. Строение циклических соединений изучалось еще в прошлом веке, и были попытки найти закономерности, объясняющие своеобразие реакционной способности каждого цикла. Адольфом фон Байером была предложена теория напряжений валентных углов, согласно которой молекула тем стабильнее, чем ближе значения валентных углов к нормальному. Эта теория объясняла, почему циклопропан мало устойчив, но она не смогла объяснить высокую устойчивость циклогексана, потому что исходила из представлений о плоской геометрии циклов. Действительно, в циклопропане валентный угол соответствует углу в равностороннем треугольнике (60°), тогда как нормальный валентный угол sp3-С-атома равен 109,5°. Это означает, что циклопропановое кольцо испытывает большое напряжение и стремится раскрыться, поэтому циклопропан ведет себя в некоторых реакциях как алкен.
Структурные измерения и квантово-химические расчеты молекулы циклопропана дают следующие геометрические параметры:
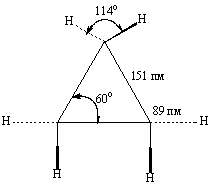
Объяснение строения циклопропана в свете этих данных заставляет предположить, что связи в кольце образованы гибридными орбиталями с вкладом s-характера лишь 17% против 25% при гибридизации sp3 (об этом можно судить, например, по величине энергии ионизации: циклопропан 10,5 эВ, пропан 11,7 эВ, пропен 9,7 эВ). Внешние орбитали имеют 33% s-вклада (т.е. ближе к sp2-гибридизации).
Сравнение величин теплот сгорания ряда циклоалканов в расчете на одну метиленовую группу показывает, что циклопропан является самым богатым энергией циклоалканом (38,5 кДж/моль). За точку отсчета принят циклогексан (0 кДж/моль).
Циклопропан проявляет химические свойства как алканов, так и непредельных соединений. Гидрирование, взаимодействие с бромо- и хлороводором в воде, бромом при нагревании и на свету приводит к раскрытию цикла.
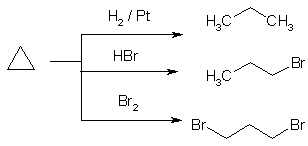
Напротив, при действии хлора на свету он, аналогично алканам, подвергается замещению – хлорированию.
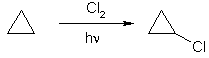
Циклобутан, как и другие циклоалканы с циклом больше трехчленного, имеет неплоское кольцо. Оно представляет собой геометрическую фигуру с перегибом по линии соединяющей противоположные углеродные атомы, что обусловлено внутримолекулярным отталкиванием атомов водорода. Поэтому монозамещенные циклобутаны существуют в двух конформациях, которые, однако, легко переходят друг в друга и не могут быть разделены.
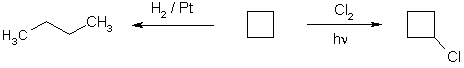
Кольцо циклобутана более устойчиво к действию многих реагентов, чем кольцо циклопропана. Для него более характерными являются реакции замещения, однако каталитическое гидрирование приводит к раскрытию кольца.
Молекула циклопентана образует правильный пятиугольник с внутренним углом 105°, близким по величине к валентному углу тетраэдрического атома углерода. Однако, вследствие внутримолекулярного отталкивания атомов водорода, происходит искажение плоскости молекулы.

Циклопентан проявляет свойства, характерные для алканов и реакции раскрытия цикла для него нехарактерны. Повышенный интерес вызывает циклопентадиен. Он является активным субстратом в реакциях диенового синтеза, при хранении обратимо димеризуется с образованием эндо- и экзо-аддуктов Дильса-Альдера. При перегонке оба димера превращаются в исходный циклопентадиен с примесью полимерных продуктов.
Если бы молекула циклогексана была плоской, как предполагал А. ф. Байер, то в ней наблюдалось бы значительное напряжение валентных углов (120° против 109,5°). Сейчас известно, что циклогексан неплоский, четыре атома углерода находятся в одной плоскости, а два выходят из нее. Возможны три пространственные конформации циклогексана: кресло – С-атомы расположены по разные стороны плоскости, ванна – по одну. Из-за внутримолекулярного отталкивания атомов водорода более выгодна форма кресла (на 29,3 кДж/моль). Промежуточное положение занимает конформация, которую называют твист-формой – это искаженная ванна, она на 6,3 кДж/моль выгоднее ванны.
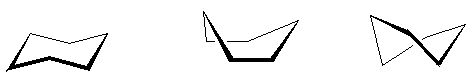
Кресло Ванна Твист
Когда молекула циклогексана находится в конформации кресла, атомы водорода в ней можно различить на экваториальные (ориентированные ближе к плоскости кольца) и аксиальные.
Однако, в химическом отношении все атомы водорода равноценны, т.к. конформации быстро переходят друг в друга. Реакционная способность циклогексана аналогично алканам и для него характерны реакции свободнорадикального замещения: хлорирование, нитрование по М. Коновалову. Однако в отличие от циклопропана и циклобутана каталитическое гидрирование требует жестких условий
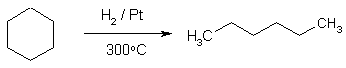
Из всех циклоалканов циклогексан имеет самое устойчивое кольцо: величина теплоты сгорания в расчете на одну метиленовую группу, равная 659 кДж/моль, принята за нулевую при сравнении с другими циклоалканами.
При пропускании циклогексана или его алкилзамещенных через никелевый или платиновый катализатор при 200 °С происходит дегидрирование кольца и его превращение в ароматическую систему. Эта реакция, однако, препаративного значения не имеет, т.к. производные бензола зачастую доступнее производных циклогексана с теми же заместителями.
 |
|
|
 Скачать 162.54 Kb.
Скачать 162.54 Kb.