АХ лабораторный практикум2012. Аналитическая химия лабораторный практикум
 Скачать 4.82 Mb. Скачать 4.82 Mb.
|
Анализ смеси катионов III группыЦель работы: провести качественный анализ раствора, в котором возможно присутствие ионов Fe2+, Fe3+, Zn2+, Al3+, Cr3+, Mn2+. Сущность работы. Согласно сульфидной классификации ионы Fe2+, Fe3+, Zn2+, Al3+, Cr3+, Mn2+ относятся к III аналитической группе. На некоторые из них есть селективные реакции, с помощью которых можно открыть конкретный ион в присутствии всех остальных, не проводя разделение. Так, ионы Fe2+, Fe3+ и Zn2+ открывают в предварительных испытаниях, действуя реагентами K3[Fe(CN)6], K4[Fe(CN)6] и дитизоном соответственно. Другие ионы, находящиеся в растворе, не мешают их обнаружению. Однако многие ионы III аналитической группы необходимо отделить друг от друга перед проведением характерных реакций. В лабораторной работе для этой цели используется пероксидный метод систематического анализа смеси катионов III группы, предполагающий использование избытка NаОH в присутствии Н2О2. Разделение с применением Н2О2 и избытка NаОН основано на различных окислительно-восстановительных свойствах катионов III группы и амфотерном характере гидроксидов Al(OH)3, Cr(OH)3 и Zn(OH)2. В ходе разделения сначала все ионы вступают в реакцию со щелочью, образуя нерастворимые гидроксиды:
Затем при добавлении избытка щелочи амфотерные гидроксиды растворяются: Cr(OH)3↓ + 3OH– = [Cr(OH)6]3– Zn(OH)2↓ + 2OH– = [Zn(OH)4]2– Al(OH)3↓ + 3OH– = [Al(OH)6]3– В результате часть катионов остается в растворе, а часть находится в осадке в виде малорастворимых гидроксидов. Затем под действием Н2О2 в щелочной среде происходит окисление гидроксидов Fe(OH)2 и Mn(OH)2 в осадке и гидроксохромита [Cr(OH)6]3– в растворе: 2Fe(OH)2↓ + Н2О2 = 2Fe(OH)3↓ Mn(OH)2↓ + Н2О2 = MnО(OH)2↓ + Н2О 2[Cr(OH)6]3– + 3Н2О2 = 2CrО42– + 8Н2О + 2ОН– В результате разделения ионов внутри III аналитической группы получаются раствор и осадок следующего состава:
При анализе раствора необходимо провести обнаружение только ионов Al3+ и Cr3+, поскольку Zn2+ открывается в предварительных испытаниях. При анализе осадка необходимо открыть только ионы Mn2+, так как наличие или отсутствие ионов Fe2+ и Fe3+ также устанавливается в ходе предварительных испытаний. Растворять осадок не надо, потому что используется характерная реакция обнаружения Mn2+ по образованию комплексного соединения H[Mn(C2O4)2] при действии раствора щавелевой кислоты на осадок MnО(OH)2. Однако проведению этой реакции мешает Fe(OH)3. Его необходимо замаскировать до выполнения реакции на Mn2+, если по результатам предварительных испытаний в пробе обнаружены ионы Fe2+ и/или Fe3+. Маскирующим агентом является NaF, который образует с ионами Fe3+ прочные фторидные комплексы: Fe(OH)3 + 6NaF Na3[FeF6] + 3NaOH Для обнаружения отдельных ионов в лабораторной работе используют следующие характерные реакции:
Выполнение работы. Получают пробу для проведения анализа, записывают ее номер в лабораторный журнал. Описывают внешний вид раствора (окраска, прозрачность). Далее используют отдельные порции исследуемого раствора для проведения предварительных испытаний и систематического хода анализа. 1. Предварительные испытания Определение реакции среды. Определяют значение рН раствора с помощью универсальной индикаторной бумаги, нанеся каплю раствора на полоску универсальной индикаторной бумаги стеклянной палочкой и сравнив полученную окраску с цветной шкалой. Проба на присутствие Fe2+. Ион Fe2+ открывают первым, так как он легко окисляется кислородом воздуха до Fe3+. Небольшую порцию раствора подкисляют 2 н. НСl и приливают к ней 1–2 капли раствора K3[Fe(CN)6], стараясь не перемешивать содержимое пробирки. Выпадение синего осадка Fe3[Fe(CN)6]2 свидетельствует о наличии иона Fe2+. Следует иметь в виду, что в присутствии катионов III группы осадок будет менее интенсивно окрашен. Если основной эффект не проявился, то необходимо зафиксировать побочные эффекты, которые могут наблюдаться за счет возможного присутствия ионов Fe3+, Mn2+ и Zn2+. Проба на присутствие Fe3+. К отдельной порции исследуемого раствора, подкисленной 2 н. HCl, прибавляют несколько капель раствора K4[Fe(CN)6]. Выпадение синего осадка Fe4[Fe(CN)6]3 свидетельствует о наличии иона Fe3+. Присутствие катионов III группы несколько изменяет темно-синий цвет осадка. Следует иметь в виду, что растворы солей Fe2+ всегда содержат примесь Fe3+ за счет окисления кислородом воздуха, поэтому в отчете необходимо указать не только окраску раствора, но и ее интенсивность. Проба на присутствие Zn2+. В центр полоски фильтровальной бумаги наносят каплю раствора дитизона и каплю анализируемого раствора. Появление малиново-красного окрашивания свидетельствует о присутствии ионов Zn2+. Для сравнения полезно провести холостой опыт и модельный опыт:
2. Систематический ход анализа 2.1. Разделение катионов внутри группы. К 10–12 каплям анализируемого раствора прибавляют при тщательном перемешивании концентрированный раствор NaOH до щелочной реакции по индикаторной бумаге. Затем прибавляют еще 5–8 капель раствора NaOH и 4–5 капель 3%-ного раствора H2O2. После прекращения реакции содержимое пробирки нагревают на водяной бане для разложения избытка Н2О2. Необходимо убедиться, что реакции прошли до конца: после проведения такой обработки раствор может быть либо бесцветным, либо желтым, а осадок – бурым, если он образовался. Затем отделяют осадок от раствора путем центрифугирования. В результате катионы III группы оказываются разделенными: фильтрат содержит анионы 2.2 Анализ фильтрата Обнаружение Cr3+. Для установления наличия ионов Cr3+ их окисляют до При проведении реакции в отсутствии амилового спирта синяя окраска также образуется, однако она менее интенсивна и быстро исчезает. Обнаружение Al3+. В центр полоски фильтровальной бумаги наносят 1–2 капли фильтрата, затем 1 каплю раствора HCl. Помещают полоску над склянкой с концентрированным раствором аммиака и держат ее 1–2 мин в парáх аммиака. Затем на пятно наносят каплю раствора ализарина и снова держат бумагу в парáх аммиака. Пятно окрашивается в фиолетовый цвет, характерный для ализарина в аммиачной среде. Бумагу подсушивают, наносят на пятно 1–2 капли раствора уксусной кислоты и снова подсушивают. При этом фиолетовая окраска ализарина исчезает. Если в пробе присутствуют ионы Al3+, то пятно становится розово-красным. 2.3. Анализ осадка Обнаружение Mn2+. Ионы Mn2+ открывают, действуя щавелевой кислотой на осадок MnО(OH)2. Проведению реакции мешает Fe(OH)3, поэтому его предварительно маскируют. Проведение реакции в отсутствие Fe(OH)3 К осадку после центрифугирования осторожно, по стенке пробирки пипеткой вводят 2 н. раствор Н2С2О4. В присутствии MnО(OH)2 образуется малиново-розовое комплексное соединение марганца H[Mn(C2O4)2]. Образующееся соединение неустойчиво, поэтому раствор перемешивать не следует. Проведение реакции в присутствии Fe(OH)3 К осадку добавляют несколько кристалликов NaF, а затем вводят Н2С2О4, как описано выше. Лабораторная работа № 3 Анализ смеси анионов I–III аналитических групп Цель работы: провести качественный анализ раствора, в котором возможно присутствие анионов Сущность работы. Согласно классификации анионов, основанной на растворимости солей бария и серебра, ионы В отличие от катионов, анионы различных групп не мешают открытию друг друга, поэтому анализ предложенной смеси можно выполнить дробным методом, т. е. в отдельных порциях исследуемого раствора, не проводя групповых разделений. При анализе смеси анионов групповые реагенты чаще всего применяют не для разделения групп, а для того, чтобы установить их наличие или отсутствие в ходе предварительных испытаний. Если установлено отсутствие анионов всей группы, то не следует проводить реакции на отдельные анионы. Таким образом, проведение групповых реакций значительно облегчает работу и экономит время. В работе используются следующие групповые реакции:
При проведении предварительных испытаний на анионы делают также пробу на выделение газов, действуя на раствор 2 н. H2SO4. При этом анионы летучих кислот разлагаются с выделением пузырьков газа. Из анионов, которые могут быть в анализируемом растворе, такой эффект дают только Анионы I аналитической группы не мешают обнаружению друг друга, а внутри II и III аналитических групп необходимо провести разделение ионов. Ионы I– мешают открытию ионов Cl–, поэтому их предварительно отделяют, используя селективное растворение осадков галогенидов серебра в NH4OH (конц.). Сначала действуют групповым реагентом AgNO3 в 2 н. НNO3, в результате оба иона переходят в осадок: Cl– + AgNO3 AgCl + I– + AgNO3 AgI + Затем добавляют NH4OH (конц.), в котором осадок AgCl растворяется с образованием аммиаката, а AgI – не растворяется вследствие различия в значениях произведений растворимости ( 10–10 и 10–17 соответственно): AgCl↓ + 2NH4OH = [Ag(NH3)2]Сl + 2H2O Осадок AgI отбрасывают, а в полученном фильтрате открывают ионы Cl–. Ионы При проведении характерных реакций на анионы для доказательства их присутствия часто необходимо не только убедиться в выпадении осадка, но и провести испытание на его растворимость в растворах различных реагентов. В работе используются следующие характерные реакции:
Выполнение работы. Получают пробу для проведения анализа, записывают ее номер в лабораторный журнал. Описывают внешний вид раствора (окраска, прозрачность). Далее используют отдельные порции исследуемого раствора для проведения предварительных испытаний и систематического хода анализа. 1. Предварительные испытания Определение реакции среды. Определяют значение рН раствора с помощью универсальной индикаторной бумаги, нанеся каплю раствора на полоску универсальной индикаторной бумаги стеклянной палочкой и сравнив полученную окраску с цветной шкалой. Проба на анионы I группы. К 2 каплям нейтрального или слабощелочного раствора (рН 7–8) добавляют 2–3 капли раствора BaCl2. Образование белого осадка указывает на присутствие анионов I группы. Проба на анионы II группы. К 2–3 каплям исследуемого раствора прибавляют 2–3 капли AgNO3. При этом может образоваться осадок, содержащий нерастворимые соли серебра с анионами I и II аналитических групп. К нему прибавляют несколько капель HNO3 для растворения солей, образованных анионами I группы: Ag2SO4 + 2HNO3 2AgNO3 + Н2SO4 Ag2СO3 + 2HNO3 2AgNO3 + СO2 + Н2O Ag3РO4 + 3HNO3 3AgNO3 + Н3РO4 Если осадок не растворяется в азотной кислоте, то это указывает на присутствие анионов II группы. Проба на выделение газов. К небольшой порции анализируемого раствора добавляют несколько капель 2 н. раствора серной кислоты и наблюдают, выделяются ли пузырьки газа в момент ее приливания. Образование газа указывает на возможность присутствия Реакция является не очень чувствительной, поэтому даже при отсутствии аналитического эффекта необходимо провести характерные реакции на ионы 2. Открытие анионов I группы Если предварительные испытания показали наличие анионов I группы, то проводят их осаждение групповым реагентом из отдельной порции анализируемого раствора объемом 1–2 мл, как при проведении пробы на анионы I группы. Осадок отделяют от раствора центрифугированием и проверяют полноту осаждения. Обнаружениесульфат-ионов. К полученному осадку прибавляют избыток соляной кислоты и тщательно перемешивают стеклянной палочкой. Если осадок не растворился полностью, то это указывает на присутствие сульфат-ионов. Одновременно необходимо зафиксировать, выделяются ли пузырьки газа при попытке растворения осадка. Обнаружение карбонат-ионов. Если растворение осадка в соляной кислоте сопровождается выделением пузырьков газа, то следует проверить присутствие карбонат-ионов по помутнению раствора Ba(OH)2. Реакцию проводят в специальном приборчике, представляющем собой пробирку, плотно закрытую пробкой с отверстием, в которое вставляется отводная трубка. На дно пробирки помещается анализируемый раствор, сюда же добавляют 2 н. раствор соляной кислоты, после чего пробирку плотно закрывают пробкой. Отводную трубочку быстро опускают в пробирку с раствором Ba(OH)2. В случае выделения CO2 баритовая вода мутнеет вследствие образования BaCO3. Обнаружениефосфат-ионов. В пробирку добавляют 2–3 капли раствора MgCl2, 2–3 капли 2 М раствора аммиака и столько же раствора хлорида аммония. Полученную магнезиальную смесь нагревают на водяной бане и добавляют к ней несколько капель анализируемого раствора. В случае присутствия фосфат-ионов выпадает белый кристаллический осадок MgNH4PO4. 3. Открытие анионов II группы Обнаружение иодид-ионов. К отдельной порции анализируемого раствора прибавляют 2–3 капли 2 н. раствора серной кислоты и несколько капель бензола или хлороформа (органический слой будет сверху). Затем в эту же пробирку по одной капле добавляют хлорную воду, каждый раз хорошо взбалтывая ее содержимое. При наличии в растворе иодид-ионов появится фиолетовая окраска бензольного или хлороформного слоя за счет растворения I2. Если добавить слишком много хлорной воды, то окраска не появится из-за дальнейшего окисления I2 до иодноватой кислоты: I2 + 5Cl2 + 6H2О = 2HIO3 + 10HCl Обнаружение хлорид-ионов. К отдельной порции анализируемого раствора добавляют несколько капель 2 н. HNO3 до кислой реакции и несколько капель AgNO3. Образовавшийся осадок отделяют от раствора центрифугированием, промывают дистиллированной водой, после чего к нему добавляют 25%-ный раствор NH4OH. Тщательно перемешивают содержимое пробирки стеклянной палочкой. При наличии в растворе иодид-ионов осадок растворяется не полностью. Нерастворившийся осадок AgI отделяют центрифугированием и отбрасывают. Фильтрат помещают в другую пробирку и добавляют 3–4 капли раствора KBr. Появление обильной мутиAgBr указывает на присутствие в исследуемом растворе хлорид-ионов. 4. Открытие анионов III группы Обнаружение нитрит-ионов. Характерную реакцию на Пробирочная реакция. К 2–3 каплям анализируемого раствора добавляют 1–2 капли 2 М HCl или CH3COOH и 2–3 капли раствора KI. Раствор буреет вследствие выделения I2. При добавлении 1–2 капель крахмала появляется темно-синяя окраска. Капельная реакция. На фильтровальную бумагу наносят последовательно каплю раствора крахмала, каплю 2 М CH3COOH и каплю раствора KI. Капля должна оставаться бесцветной. Вносят каплю анализируемого раствора. Если нитриты присутствуют, то появляется синяя окраска. Обнаружение нитрат-ионов. Обнаружению Проведение реакции в отсутствие В тщательно вымытую пробирку добавляют 3–4 капли анализируемого раствора, смачивая им стенки пробирки. Затем по стенке пробирки аккуратно пускают 1 каплю дифениламина, приготовленного на концентрированной серной кислоте (осторожно!). Появление интенсивной синей окраски указывает на присутствие Большие количества ионов I– могут помешать этой реакции за счет проявления побочного аналитического эффекта – коричневого окрашивания. Проведение реакции в присутствии NO2– К 4 каплям анализируемого раствора добавляют на кончике шпателя мочевину (карбамид), после чего в полученную смесь по каплям прибавляют 2–4 капли раствора H2SO4, перемешивая раствор стеклянной палочкой. Через некоторое время отдельную порцию испытывают на нитрит-ион реакцией с KI в присутствии крахмала. Только убедившись в полноте удаления Лабораторная работа № 4 Анализ смеси сухих солей Цель работы: провести анализ предложенной смеси сухих солей на содержание в ней катионов и анионов: – Проба А – смесь сухих солей, образованных катионами I и/или II аналитических групп и анионами различных групп; – Проба Б – смесь сухих солей, образованных катионами III аналитической группы и анионами различных групп. Сущность работы. В качестве контрольной задачи предлагается смесь сухих солей, в состав которой входят изученные ранее катионы и анионы. Поскольку анализ проводится «мокрым путем», то анализируемую смесь пpeждe всего необходимо растворить. При растворении смесей солей в воде могут протекать химические реакции между различными компонентами смеси. Например, при растворении смеси сухих солей Ba(NO3)2 и K3PO4 произойдет реакция осаждения: 3Ba2+ + 2PO43– Ba3(PO4)2 а при растворении смеси сухих солей FeCl3 и NaI – окислительно-восстановительная реакция: 2Fe3+ + 2I– 2Fe2+ + I2 Протекание этих реакций усложняет ход анализа, поэтому для выполнения лабораторной работы предлагается специально подобранная смесь сухих солей, полностью растворимая в воде. После перевода пробы в раствор проводят его анализ на наличие катионов и анионов. Катионы открывают, используя систематический ход анализа, а анионы – дробный. Анализ целесообразно начинать с обнаружения катионов, так как наличие некоторых из них свидетельствует об отсутствии ряда анионов. Следует учесть, что число открытых катионов и анионов может совпадать либо не совпадать. Например, в смеси солей KCl, NaCl, NH4Cl и MgCl2 присутствуют 4 катиона и 1 анион. Выполнение работы. Получают пробу для проведения анализа, записывают ее номер в лабораторный журнал. Описывают внешний вид пробы (окраска кристаллов, расплывание на воздухе). Растворяют пробу в дистиллированной воде, добавляя ее небольшими порциями и перемешивая раствор стеклянной палочкой. Большой объем воды использовать не следует, поскольку раствор будет сильно разбавленным, что усложнит анализ. Описывают внешний вид полученного раствора (окраска, прозрачность) и определяют значение рН с помощью универсальной индикаторной бумаги. Далее используют отдельные порции раствора для проведения предварительных испытаний, обнаружения катионов и анионов. Проба А. Смесь солей, образованных катионами I и/или II аналитических групп и анионами различных групп. Анализ проводят в следующем порядке: 1) предварительные испытания и систематический ход анализа катионов по методике, описанной в работе № 1; 2) вывод по результатам анализа катионов – каких анионов в смеси не может быть, учитывая, что смесь растворилась в воде без остатка; 3) предварительные испытания и дробный ход анализа анионов по методике, описанной в работе № 3. Если сделан вывод об отсутствии ряда анионов, то не следует проводить реакции с целью их обнаружения; 4) окончательный результат анализа. Проба Б. Смесь солей, образованных катионами III аналитической группы и анионами различных групп. Анализ проводят в следующем порядке: 1) предварительные испытания и систематический ход анализа катионов по методике, описанной в работе № 2; 2) вывод по результатам анализа катионов – каких анионов в смеси не может быть, учитывая, что смесь растворилась в воде без остатка; 3) предварительные испытания и дробный ход анализа анионов по методике, описанной в работе № 3, из которой должны быть исключены все операции с явно отсутствующими анионами; 4) окончательный результат анализа. ГРАВИМЕТРИЧЕСКИЙ метод АНАЛИЗА При проведении гравиметрического анализа измеряется аналитический сигнал – масса гравиметрической формы (ГФ). На основании полученного аналитического сигнала проводится расчет результатов анализа по уравнению реакции или с использованием гравиметрического фактора (F). Техника выполнения основных операций в гравиметрии Осаждение проводят для выделения того или иного компонента образца из раствора в виде малорастворимого соединения. Осаждение считают количественным в том случае, если остаточная концентрация иона в растворе не превышает 10–6 моль/л. Осадитель приливают в стакан с раствором по палочке, перемешивая раствор после добавления каждой порции. Потом проверяют полноту осаждения: дают осадку собраться на дне стакана и к прозрачному раствору (фильтрату) добавляют несколько капель осадителя, наблюдая, не появится ли муть в местах падения этих капель. Если муть не появляется, то можно считать, что полнота осаждения достигнута. Фильтрование и промывание осадка проводят для отделения осадка от раствора и очистки его от адсорбированных примесей. Аморфные осадки отфильтровывают через 5–10 мин после осаждения, дав осадку собраться на дне стакана. Отделять осадок от раствора можно с помощью фильтрующих тиглей или фильтровальной бумаги. В гравиметрии чаще всего применяют специальные бумажные фильтры, которые называются беззольными. После сжигания фильтра остается зола, масса которой мала и указана на упаковке, поэтому при необходимости в результат взвешивания можно внести поправку. Беззольные фильтры выпускаются разного диаметра и разной степени пористости, которую обозначают специальной лентой, опоясывающей пачку фильтров (табл. 6). Выбор фильтра конкретной степени пористости определяется природой осадка. Размер фильтра выбирают не по объему жидкости, которую нужно профильтровать, а по объему осадка – он должен занимать не более половины сложенного конусом фильтра. Чаще всего употребляются фильтры, имеющие диаметр 6, 9 и 12 см. Таким образом, для проведения операции фильтрования химик-аналитик должен выбрать подходящий по пористости и размерам беззольный фильтр. Таблица 6 Виды фильтров, используемых в гравиметрии
В а б в ыбранный фильтр перегибают по диаметру пополам, затем полученный полукруг перегибают еще раз пополам. После этого разворачивают фильтр, чтобы образовался конус (рис. 4, а), и вставляют его в воронку (рис. 4, б). Смачивают фильтр дистиллированной водой и осторожно прижимают его края к стенкам воронки так, чтобы фильтр плотно, без зазоров прилегал к ней. Край фильтра должен быть ниже края воронки на 5–8 мм. 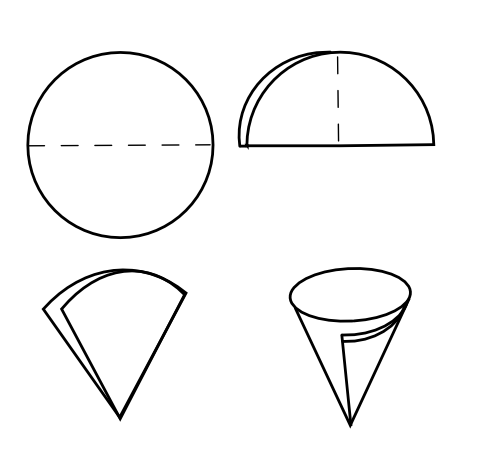  а б Рис. 4. Подготовка воронки с фильтром для фильтрования: а – складывание фильтра; б – подготовленная к работе воронка с фильтром В       оронку с фильтром вставляют в кольцо штатива. Под нее подставляют стакан или коническую колбу для сбора фильтрата так, чтобы носик воронки касался внутренней стенки стакана. оронку с фильтром вставляют в кольцо штатива. Под нее подставляют стакан или коническую колбу для сбора фильтрата так, чтобы носик воронки касался внутренней стенки стакана.П  осле подготовки и установки в кольцо воронки с фильтром можно приступать к фильтрованию методом декантации. Осадок должен находиться на дне стакана, его не следует взмучивать. Если взмутить осадок, то после внесения на фильтр первых порций жидкости с осадком фильтрование сильно замедлится, так как частицы осадка забьют поры фильтра. осле подготовки и установки в кольцо воронки с фильтром можно приступать к фильтрованию методом декантации. Осадок должен находиться на дне стакана, его не следует взмучивать. Если взмутить осадок, то после внесения на фильтр первых порций жидкости с осадком фильтрование сильно замедлится, так как частицы осадка забьют поры фильтра.С  такан с осадком подносят к воронке, осторожно вынимают палочку из стакана, чтобы ни одна капля раствора не попала мимо фильтра. Ставят палочку почти вертикально над воронкой в той части фильтра, где он сложен втрое (палочка не должна касаться фильтра!), подносят стакан и по палочке сливают жидкость на фильтр (рис. 5). Уровень жидкости на фильтре должен быть на 4–5 мм ниже его края. Стеклянная палочка должна быть или в руке над воронкой, или в стакане. Нельзя класть ее на стол! такан с осадком подносят к воронке, осторожно вынимают палочку из стакана, чтобы ни одна капля раствора не попала мимо фильтра. Ставят палочку почти вертикально над воронкой в той части фильтра, где он сложен втрое (палочка не должна касаться фильтра!), подносят стакан и по палочке сливают жидкость на фильтр (рис. 5). Уровень жидкости на фильтре должен быть на 4–5 мм ниже его края. Стеклянная палочка должна быть или в руке над воронкой, или в стакане. Нельзя класть ее на стол!П 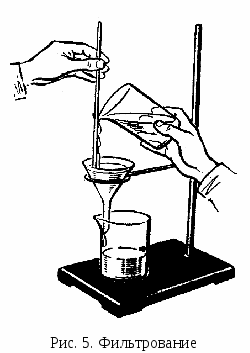 осле этого приступают к промыванию осадка методом декантации. Наливают в стакан промывную жидкость, перемешивают осадок палочкой, дают ему отстояться несколько минут. Затем прозрачную жидкость сливают по палочке на фильтр, оставляя основную часть осадка в стакане. Операцию повторяют несколько раз. После каждой промывки проверяют полноту промывания осадка. Для этого в пробирку отбирают несколько капель промывной жидкости, вытекающей из воронки, и проводят качественную реакцию на отмываемый ион. Промывку прекращают только в случае отрицательной реакции. осле этого приступают к промыванию осадка методом декантации. Наливают в стакан промывную жидкость, перемешивают осадок палочкой, дают ему отстояться несколько минут. Затем прозрачную жидкость сливают по палочке на фильтр, оставляя основную часть осадка в стакане. Операцию повторяют несколько раз. После каждой промывки проверяют полноту промывания осадка. Для этого в пробирку отбирают несколько капель промывной жидкости, вытекающей из воронки, и проводят качественную реакцию на отмываемый ион. Промывку прекращают только в случае отрицательной реакции. После этого с помощью небольших порций промывной жидкости, взмучивая осадок и не давая ему отстаиваться, переносят его на фильтр. Для перенесения на фильтр осадка, оставшегося на стенках стакана и палочке, поступают следующим образом. В стакан наливают промывную жидкость небольшими порциями и сдвигают в нее осадок со стенок стакана резиновым наконечником стеклянной палочки. Затем ополаскивают палочку промывной жидкостью над стаканом, берут четвертинку беззольного фильтра и протирают им палочку и стакан, снимая частицы осадка. Потом этот кусочек фильтра с частицами осадка присоединяют к собранному на фильтре основному осадку. После этого фильтр с осадком извлекают из воронки. С помощью стеклянной палочки отделяют край фильтра от стенок воронки в той части, где он сложен в три слоя (рис. 6, а), и загибают их над осадком, полностью закрывая последний (рис. 6, б). Пакетик с осадком извлекают из воронки, складывают, как показано на рис. 6, в, помещают в фарфоровый тигель (рис. 6, г) и озоляют.   Рис. 6. Перенос фильтра с осадком в тигель: а – отделение фильтра от края воронки; б – извлечение фильтра из воронки; в – складывание фильтра с осадком; г – перенос фильтра с осадком в тигель Д  ля фильтрования осадков, которые разлагаются при высокой температуре, например органических, применяют стеклянные фильтрующие тигли – стеклянные тигли с вплавленными фильтрующими пластинками из прессованного пористого стекла (рис. 7). Стеклянные фильтрующие тигли выпускаются с различным размером пор, которые обозначаются номерами. С увеличением номера фильтра пористость уменьшается. ля фильтрования осадков, которые разлагаются при высокой температуре, например органических, применяют стеклянные фильтрующие тигли – стеклянные тигли с вплавленными фильтрующими пластинками из прессованного пористого стекла (рис. 7). Стеклянные фильтрующие тигли выпускаются с различным размером пор, которые обозначаются номерами. С увеличением номера фильтра пористость уменьшается.Озоление и прокаливание проводятся с целью перевода осаждаемой формы в гравиметрическую. Фильтр с осадком озоляют при температуре 400°С в электропечи. При этом бумага превращается в золу, минуя стадию горения. Бумага не должна гореть, поскольку пламя может унести частицы осадка. Когда бумага полностью обуглится, приступают к прокаливанию осадка при более высокой температуре. Затем тигель с помощью тигельных щипцов (рис. 8) переносят в эксикатор. Тигель захватывают щипцами за края, а не обхватывают его. После охлаждения тигля до комнатной температуры его взвешивают. Затем повторяют прокаливание в течение 30 мин и помещают тигель в эксикатор, ждут, пока он не охладится до комнатной температуры, и  вновь взвешивают. Операцию повторяют до тех пор, пока два последних взвешивания не будут отличаться друг от друга не более чем на 0,0002 г. вновь взвешивают. Операцию повторяют до тех пор, пока два последних взвешивания не будут отличаться друг от друга не более чем на 0,0002 г.Такая операция называется прокаливанием до постоянной массы. В процессе работы тигель с осадком должен находиться либо в печи, либо в эксикаторе. Хранить его на воздухе недопустимо! Тигель вынимают из эксикатора только для взвешивания. Э 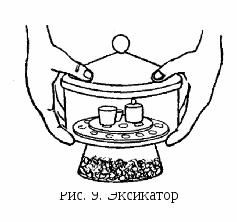 ксикатор – это специальный сосуд, служащий для защиты предметов от поглощения влаги из воздуха. В нижней части эксикатора находится осушающее вещество. Эксикатор снабжен притертой крышкой, шлиф которой смазан вазелином. Для того чтобы открыть или закрыть крышку эксикатора, ее сдвигают в сторону. Если в эксикатор помещают сильно нагретый тигель, то не следует сразу плотно закрывать крышку, нужно слегка сдвинуть ее для выхода воздуха, а затем уже плотно закрыть. Перенося эксикатор с места на место, необходимо придерживать крышку большими пальцами обеих рук (рис. 9), так как она может упасть и разбиться. ксикатор – это специальный сосуд, служащий для защиты предметов от поглощения влаги из воздуха. В нижней части эксикатора находится осушающее вещество. Эксикатор снабжен притертой крышкой, шлиф которой смазан вазелином. Для того чтобы открыть или закрыть крышку эксикатора, ее сдвигают в сторону. Если в эксикатор помещают сильно нагретый тигель, то не следует сразу плотно закрывать крышку, нужно слегка сдвинуть ее для выхода воздуха, а затем уже плотно закрыть. Перенося эксикатор с места на место, необходимо придерживать крышку большими пальцами обеих рук (рис. 9), так как она может упасть и разбиться.В    ысушивание проводят при более низкой температуре в сушильном шкафу. Для высушивания навесок веществ их помещают в стеклянные бюксы (рис. 10) или фарфоровые тигли. ысушивание проводят при более низкой температуре в сушильном шкафу. Для высушивания навесок веществ их помещают в стеклянные бюксы (рис. 10) или фарфоровые тигли. Рис. 10. Стеклянные бюксы При высушивании осадков с целью получения гравиметрической формы используют стеклянные фильтрующие тигли. При работе с ними не рекомендуется проводить высушивание при температуре выше 200С. Взвешивание гравиметрической формы проводят на аналитических весах с точностью 0,0001 г. Оборудование для гравиметрического анализа Э  лектропечи лабораторные. Электропечь лабораторная SNOL 8,2/1100 (рис. 11) предназначена для термообработки веществ при температуре от 50 до 1100С. Работа с ней требует предельной собранности, осторожности и соблюдения всех правил безопасности во избежание получения термических ожогов. Студенты могут пользоваться печью только после обучения приемам безопасной работы и под контролем преподавателя. лектропечи лабораторные. Электропечь лабораторная SNOL 8,2/1100 (рис. 11) предназначена для термообработки веществ при температуре от 50 до 1100С. Работа с ней требует предельной собранности, осторожности и соблюдения всех правил безопасности во избежание получения термических ожогов. Студенты могут пользоваться печью только после обучения приемам безопасной работы и под контролем преподавателя.Печь включается нажатием тумблера на передней панели, при этом загорится сигнальная лампа. Управление температурным режимом производится с помощью кнопок «больше» или «меньше», расположенных на пульте управления. Нажимая на них, устанавливают на нижнем дисплее необходимую температуру. На верхнем дисплее высвечивается значение текущей температуры в камере электропечи. После окончания работы необходимо отключить печь нажатием тумблера. Весы лабораторные электронные (рис. 12) – это точные измерительные приборы, предназначенные для статического взвешивания грузов. Принцип действия весов основан на компенсации веса груза электромагнитной силой, которая создается системой автоматического уравновешивания. В зависимости от требуемой точности в лабораториях используют аналитические (рис. 12, а)или технические весы (рис. 12, б). Погрешность взвешивания на аналитических весах составляет ±0,0001 г, предельная нагрузка – 210 г. Аналитические весы имеют защитный кожух. Погрешность взвешивания на технических весах составляет ±0,01 г, предельная нагрузка – 510 г. Для обеспечения воспроизводимости результатов взвешивания весы должны стоять ровно и устойчиво. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


 NаОН, Н2О2,t°
NаОН, Н2О2,t°