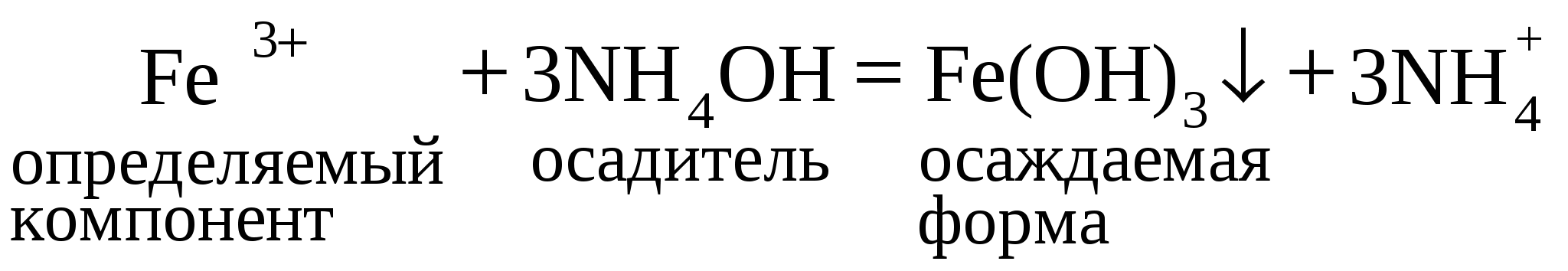АХ лабораторный практикум2012. Аналитическая химия лабораторный практикум
 Скачать 4.82 Mb. Скачать 4.82 Mb.
|
|
| ||||||||||||||||||||||||||||||||||||||||||
| | М(Fe3+) = 55,847 г/моль | М(Fe2(SO4)3 · 6H2O) = 507,971 г/моль |
| М(Fe2O3) = 159,69 г/моль | F (Fe3+ по Fe2O3) = 0,6994 | |
| | С использованием ПО «Практикум по АХ и ФХМА»:
| |
Лабораторная работа № 6
Определение салициловой кислоты
Цель работы: определить содержание салициловой кислоты в пробе.
Сущность работы. Метод осаждения можно применять не только для анализа различных неорганических катионов и анионов, но и для определения ряда органических веществ, которые можно перевести в осадок. Так, салициловая кислота в щелочной среде окисляется йодом с образованием желтого осадка тетраиодфениленхинона:
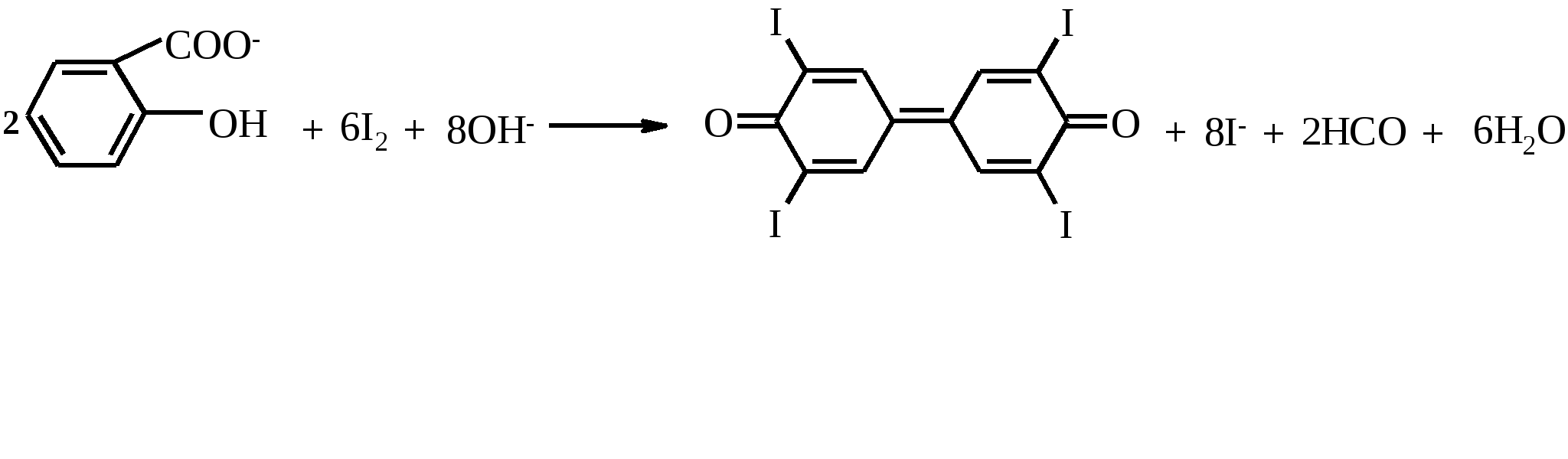 Тетраиодфениленхинон является одновременно и осаждаемой, и гравиметрической формами. После его высушивания и взвешивания можно рассчитать содержание салициловой кислоты в пробе.
Тетраиодфениленхинон является одновременно и осаждаемой, и гравиметрической формами. После его высушивания и взвешивания можно рассчитать содержание салициловой кислоты в пробе.Объектом анализа является препарат салициловой кислоты, содержащий индифферентные примеси. Поскольку салициловая кислота С6Н4(ОН)СООН (брутто-формула НС7Н5О3) является кристаллическим веществом, то ее необходимо предварительно перевести в раствор. В воде она растворяется плохо, поэтому ее переводят в растворимое состояние, добавляя раствор Na2CO3.
Салициловая кислота (pKa = 2,97) намного сильнее угольной (pKa,1 = 6,35) и вытесняет ее из карбоната натрия с образованием хорошо растворимого салицилата натрия. За счет протекания этой кислотно-основной реакции препарат хорошо растворяется:
С6Н4(ОН)СООН + Na2CO3 С6Н4(ОН)СООNa + NaНCO3
Кроме того, Na2CO3 создает щелочную среду, необходимую для протекания реакции иодирования салицилат-иона. Под действием иода в щелочной среде происходит окислительно-восстановительная реакция, в результате которой образуется тетраиодфениленхинон (брутто-формула С12Н4О2I4).
Продукт имеет очень высокую молярную массу, равную 687,777 г/моль, что обеспечивает большую точность и чувствительность описанной методики анализа. Учитывая, что салициловая кислота имеет гораздо меньшую молярную массу (138,121 г/моль), для анализа достаточно взять совсем небольшую навеску препарата.
Реакция иодирования салицилата имеет сложный механизм и протекает достаточно медленно, поэтому требуется выждать определенное время для ее завершения.
При гравиметрическом определении органических веществ осаждаемую форму чаще всего не прокаливают, а высушивают в сушильном шкафу, чтобы не произошло ее разложения при высокой температуре. В этом случае для фильтрования осадка применяют стеклянный фильтрующий тигель.
Осадок тетраиодфениленхинона необходимо отмыть от примесей солей – карбоната, гидрокарбоната и иодида натрия. В качестве промывной жидкости применяют дистиллированную воду.
Оборудование и реактивы: аналитические весы, сушильный шкаф, химический стакан (100–150 мл), стеклянная палочка, конические колбы, штатив, стеклянный фильтрующий тигель, мерные цилиндры, 0,025 моль/л I2, 1 моль/л Na2CO3.
Выполнение работы
1. Взятие точной навески пробы.На технических весах взвесить пустой тигель или бюкс. Поместить в него примерно 0,05 г пробы и снова взвесить тигель на технических весах. Поместить тигель с веществом на аналитические весы, взвесить его, записать значение. Снять с весов тигель с веществом, осторожно, не распыляя, пересыпать навеску вещества в стакан. Тигель с оставшимися частицами вещества вновь взвесить на аналитических весах, записать значение массы. По разнице двух взвешиваний на аналитических весах найти точную массу взятой навески.
2. Растворение пробы. Пробу растворяют в растворе карбоната натрия, перемешивая стеклянной палочкой, и разбавляют водой до 50 мл.
3. Осаждение. К анализируемому раствору приливают 30-40 мл раствора йода при перемешивании. Через 2 ч проверяют полноту осаждения. В течение этого времени проводят следующую операцию!
4. Доведение тигля до постоянной массы. Стеклянный фильтрующий тигель доводят до постоянной массы, высушивая его в сушильном шкафу при температуре высушивания осадка, т. е. при 80°С, и взвешивая на аналитических весах после каждого высушивания и охлаждения до комнатной температуры.
5. Фильтрование и промывание. Осадок фильтруют через стеклянный фильтрующий тигель, доведенный до постоянной массы, и промывают 3 раза дистиллированной водой.
6. Высушивание и взвешивание. Тигель с осадком сушат при 80°С в сушильном шкафу до постоянной массы и взвешивают.
7. Расчет результатов анализа. Вычисляют массовую долю салициловой кислоты в пробе ω, %.
| | М(C12H4O2I4) = 687,777 г/моль | F (НС7Н5О3 по C12H4O2I4) = 0,4016 |
| М(НС7Н5О3) = 138,121 г/моль | | |
| | С использованием ПО «Практикум по АХ и ФХМА»:
| |
Лабораторная работа № 7
Определение воды и потерь при прокаливании в природных
и технологических объектах
Цель работы: с использованием гравиметрического метода отгонки определить в различных объектах по указанию преподавателя:
вариант 1 – содержание гигроскопической воды;
вариант 2 – содержание кристаллизационной воды;
вариант 3 – потери при прокаливании.
Сущность работы. Количество гигроскопической, кристаллизационной воды и потери при прокаливании веществ определяют по разности масс взятой навески пробы до и после высушивания или прокаливания, т. е. с использованием косвенного метода отгонки.
Перед проведением анализа образец необходимо тщательно растереть в ступке и взять точную навеску на аналитических весах. Высушивание или прокаливание проводится при определенной температуре. Термическая обработка продолжается до прекращения убыли массы навески образца. Разность в массе вещества до и после обработки соответствует массе воды (и летучих веществ), удаленной из образца.
Гигроскопическая вода (влага) – это вода, которая адсорбируется из воздуха частицами твердого вещества. Содержание ее в веществе непостоянно, оно изменяется при изменении температуры и влажности воздуха. Изменение количества гигроскопической воды влияет на массовые доли всех других составных частей вещества. Для устранения колебаний состава вещества в зависимости от колебаний влажности результаты анализа веществ, содержащих заметные количества гигроскопической влаги, пересчитывают на абсолютно сухое вещество. Для этого предварительно определяют содержание гигроскопической воды – влажность образца.
Такое определение выполняют при анализе самых разнообразных материалов (полистирол, уголь, цемент, известь, глины, каолин, песок, мел и др.). Высушивание проводят при температуре 105–110°С. Влажность ω(H2O), %, рассчитывают по формуле
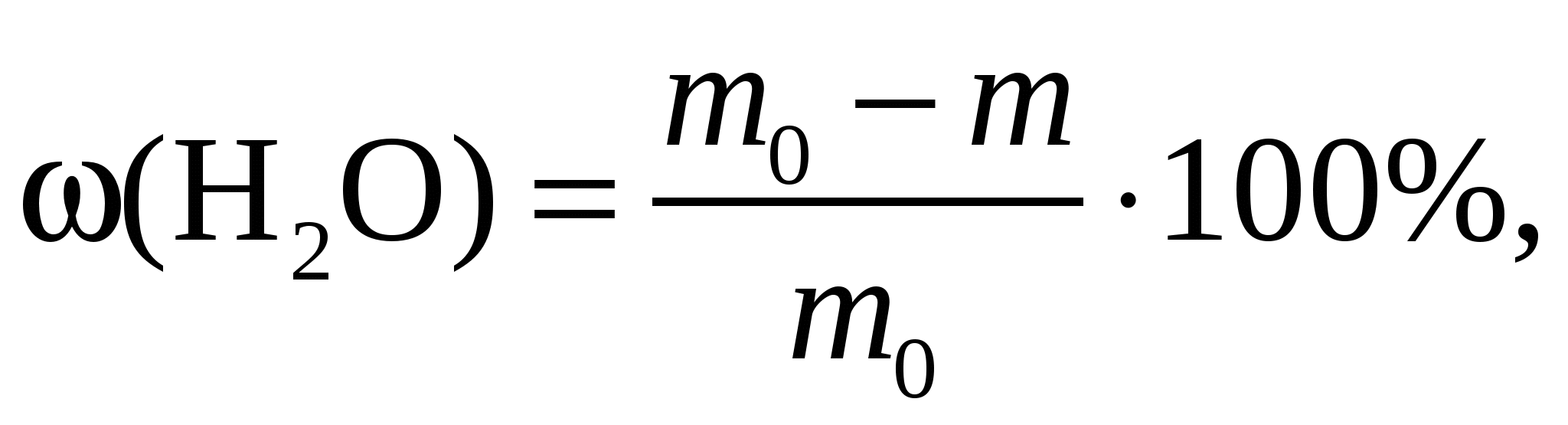 (1)
(1)где m0 и m – массы образца до и после сушки.
Кристаллизационная вода – это вода, входящая в структуру кристаллов веществ (кристаллогидратов). Содержание кристаллизационной воды в них обычно отвечает определенным химическим формулам (BaCl2 · 2H2O, CuSO4 · 5H2O, Na2B4O7 · 10H2O и т. п.). При хранении некоторые кристаллогидраты «выветриваются» – теряют часть кристаллизационной воды при комнатной температуре, а другие – «расплываются», поглощая влагу из воздуха и насыщаясь ей.
При нагревании кристаллизационная вода выделяется из кристаллогидрата, на чем основано определение кристаллизационной воды в кристаллогидратах методом отгонки. Температура дегидратации для различных кристаллогидратов различна (см. ).
Массовую долю кристаллизационной воды рассчитывают по формуле (1). При анализе химически чистых кристаллогидратов можно рассчитать количество моль воды, приходящееся на 1 моль вещества, т. е. установить формулу кристаллогидрата.
Потери при прокаливании (п. п. п.). При прокаливании материалов улетучиваются гигроскопическая влага, химически связанная вода, СО2 (за счет термического разложения карбонатов и сгорания органических примесей), а также другие летучие продукты. Прокаливание образцов проводят в электропечи при 900–1000°С. Потери при прокаливании ω(п. п. п.), %, рассчитывают по формуле
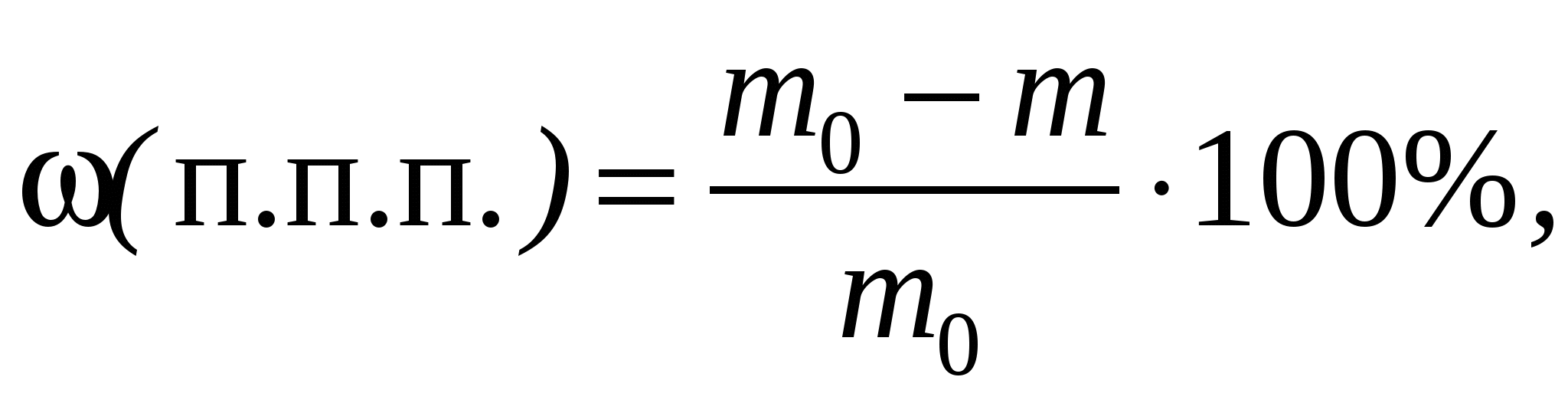 (2)
(2)где m0 и m – массы образца до и после прокаливания.
Оборудование и реактивы: аналитические и технические весы, сушильный шкаф или электропечь, ступка для растирания, бюкс, тигель.
Выполнение работы
Подготовка бюкса к работе (вар. 1, 2). Тщательно вымытый бюкс с открытой крышкой сушат в сушильном шкафу в течение 30–40 мин. Затем переносят тигельными щипцами в эксикатор и охлаждают, не закрывая бюкс крышкой, в течение 20–25 мин. Охлажденный до комнатной температуры бюкс закрывают крышкой и взвешивают на аналитических весах. Высушивание бюкса повторяют до тех пор, пока результаты последовательных взвешиваний будут отличаться не более чем на 0,0002 г.
Подготовка тигля к работе (вар. 3). Тигель прокаливают в электропечи при 900°С до достижения постоянной массы.
Вариант 1. Определение гигроскопической воды. Образец измельчают и растирают в фарфоровой ступке. Затем взвешивают пустой бюкс, помещают в него около 1 г растертой пробы и снова взвешивают. Крышку ставят на бюкс ребром так, чтобы пары воды свободно выходили наружу, и помещают бюкс в сушильный шкаф. Высушивание ведут в течение 1–1,5 ч при 105–110°С. Затем бюкс переносят в эксикатор и охлаждают, после чего закрывают крышкой и взвешивают. Высушивание и взвешивание образца повторяют до достижения постоянной массы.
По разности масс бюкса с навеской и пустого бюкса определяют массу отобранной навески. Затем по разности масс бюкса с навеской и бюкса с высушенным образцом находят массу удаленной гигроскопической воды. По полученным данным рассчитывают массовую долю (%) гигроскопической воды в образце.
Вариант 2. Определение кристаллизационной воды.Навеску кристаллогидрата 0,2–0,3 г отбирают в бюкс на технических весах, затем бюкс с отобранной навеской (при закрытой крышке) взвешивают на аналитических весах.
После взвешивания открывают крышку бюкса, повернув ее на ребро, и ставят бюкс с кристаллогидратом в сушильный шкаф (электропечь), задав необходимую температуру, на 1,5–2 ч. После охлаждения в эксикаторе в течение 20–25 мин взвешивают на аналитических весах бюкс с обезвоженной солью. Весь цикл повторяют до тех пор, пока кристаллизационная вода полностью не удалится (повторное высушивание – 30 мин), о чем свидетельствует достижение постоянной массы бюкса с высушенной солью.
По разности масс бюкса с навеской и пустого бюкса определяют массу отобранной навески. Затем по разности масс бюкса с навеской и бюкса с обезвоженной солью находят массу удаленной кристаллизационной воды.
По полученным данным рассчитывают массовую долю (%) кристаллизационной воды в кристаллогидрате. Устанавливают формулу кристаллогидрата, т. е. число моль воды, приходящееся на 1 моль соли. Сопоставляют полученные результаты с теоретическими значениями исходя из формулы кристаллогидрата.
Вариант 3. Определение потерь при прокаливании. Образец измельчают в ступке. Для удаления гигроскопической воды порошок высушивают до постоянной массы в сушильном шкафу при 105–110°С (см. вар. 1).
Затем берут навеску 0,5 г высушенного вещества в тигель и прокаливают 25–30 мин в электропечи при 900°С. Тигель охлаждают в эксикаторе и взвешивают. Прокаливание образца повторяют до достижения постоянной массы.
По формуле (2) рассчитывают ω(п. п. п.), %, по отношению к высушенной навеске образца.
| | Формула кристаллогидрата | Температура дегидратации, °С |
| BaCl2 · 2H2O | 120–125 | |
| | CaSO4 · 2H2O | 160 |
| | CuSO4 · 5H2O | 140–145 |
| | H2C2O4 · 2H2O | 110–112 |
| | KAl(SO4)2 · 12H2O | 230 |
| | Na2CO3 · 10H2O | 270 |
| | Na2SO4 · 10H2O | 300 |
| | С использованием ПО «Практикум по АХ и ФХМА»:
| |

ТИТРИМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА
При проведении титриметрического анализа измеряется аналитический сигнал – объем рабочего раствора (титранта), который затрачен на реакцию с определяемым веществом. Расчет результатов анализа в титриметрии проводят по закону эквивалентов, согласно которому вещества реагируют между собой в эквивалентных количествах.
Техника выполнения операций титриметрического анализа
Взятие точной навески выполняют при приготовлении первичных стандартных растворов и взвешивании проб анализируемых веществ. Берут точную навеску двумя способами:
1. На технических весах вначале взвешивают пустой тигель, а затем – тигель с веществом. Помещают тигель с веществом на аналитические весы и взвешивают (с точностью 0,0001 г). Осторожно пересыпают, не распыляя, вещество через воронку в колбу. Тигель с оставшимися частицами вещества вновь взвешивают на аналитических весах. По разности двух взвешиваний на аналитических весах находят массу навески. Этот способ называется «взятием навески по разности», он применяется наиболее часто.
2
а
 . Взвешивают на технических, а затем на аналитических весах (с точностью 0,0001 г) чистый сухой тигель. Затем помещают его на технические весы, насыпают в него и отвешивают (с точностью 0,01 г) анализируемое вещество. После этого тигель с веществом взвешивают на аналитических весах. Разность двух взвешиваний на аналитических весах дает массу взятой навески. Взвешенное вещество осторожно, не распыляя, пересыпают через воронку в колбу, после чего смывают водой оставшиеся в тигле и на воронке частицы вещества.
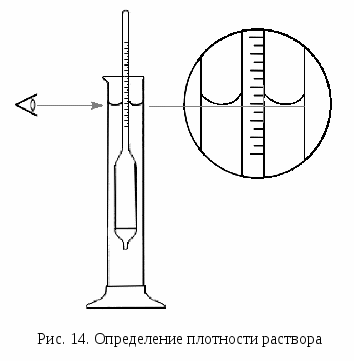
. Взвешивают на технических, а затем на аналитических весах (с точностью 0,0001 г) чистый сухой тигель. Затем помещают его на технические весы, насыпают в него и отвешивают (с точностью 0,01 г) анализируемое вещество. После этого тигель с веществом взвешивают на аналитических весах. Разность двух взвешиваний на аналитических весах дает массу взятой навески. Взвешенное вещество осторожно, не распыляя, пересыпают через воронку в колбу, после чего смывают водой оставшиеся в тигле и на воронке частицы вещества. Определение плотности жидкости проводится при приготовлении вторичного стандартного раствора из более концентрированного. Для этих целей используется денсиметр (ареометр), который представляет собой полый герметически закрытый цилиндрический стеклянный поплавок с нанесенной на него шкалой. По глубине погружения денсиметра определяют плотность жидкости.
Исследуемую жидкость наливают в высокий стеклянный цилиндр. В нее погружают денсиметр. Необходимо следить за тем, чтобы жидкость не выливалась из цилиндра и денсиметр не касался дна и стенок цилиндра (рис. 14). Отсчет показаний денсиметра проводят по верхнему делению шкалы, выступающему на уровне поверхности жидкости. Денсиметр при этом не должен вращаться и касаться стенок цилиндра. Отсчет по шкале денсиметра проводят сверху вниз с точностью до половины цены деления.
Р
 азбавление концентрированных растворов кислот и щелочей проводят путем вливания данных растворов в воду (а не наоборот), чтобы предупредить их разбрызгивание. Для разбавления концентрированных растворов используют посуду для приближенного измерения объема – мерные цилиндры и мерные стаканы.
азбавление концентрированных растворов кислот и щелочей проводят путем вливания данных растворов в воду (а не наоборот), чтобы предупредить их разбрызгивание. Для разбавления концентрированных растворов используют посуду для приближенного измерения объема – мерные цилиндры и мерные стаканы. Измерение объемов растворов точной мерной посудой является основной операцией в титриметрии.
К
 точной мерной посуде относятся мерные колбы, пипетки и бюретки. Уровень жидкости в них выводится до совмещения нижнего края мениска с меткой (глаза должны находиться на уровне метки). В случае окрашенных растворов совмещают с отметкой верхний край мениска, так как нижний плохо виден.
точной мерной посуде относятся мерные колбы, пипетки и бюретки. Уровень жидкости в них выводится до совмещения нижнего края мениска с меткой (глаза должны находиться на уровне метки). В случае окрашенных растворов совмещают с отметкой верхний край мениска, так как нижний плохо виден.Мерными колбами пользуются для разбавления исследуемого раствора до определенного объема и приготовления первичных стандартных растворов (рис. 15). Все мерные колбы имеют длинную узкую шейку (горло), на которую нанесена круговая метка и указана вместимость (мл) при 20°С.
Раствор, находящийся в колбе, доводят до метки дистиллированной водой в несколько приемов. Сначала наливают воду примерно до половины вместимости колбы и кругообразными движениями перемешивают содержимое колбы. Затем добавляют дистиллированную воду на 0,5–1,0 см ниже метки, после чего доводят до метки, добавляя воду по каплям из капельной пипетки до тех пор, пока вогнутый мениск своей нижней частью не совпадет с линией метки. При этом мерную колбу держат за верхнюю часть шейки (выше метки) так, чтобы метка находилась на уровне глаз (рис. 16).
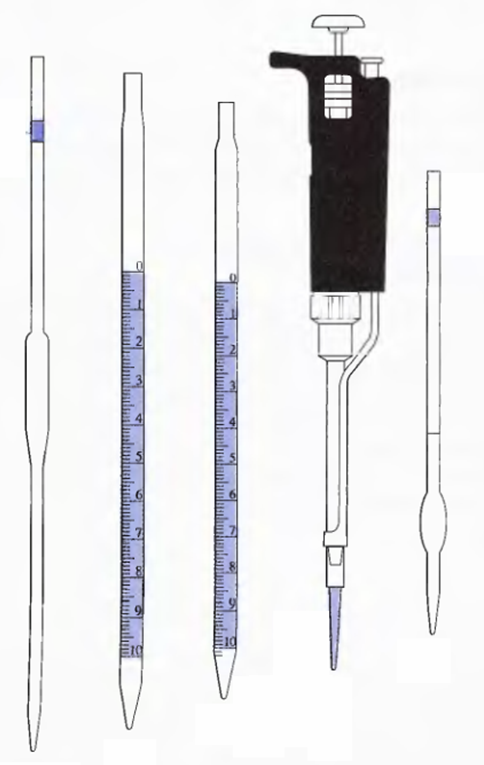
а б в г д
Рис. 16. Пипетки:
а, д – пипетки Мора; б, в – градуированные пипетки; г – автоматическая пипетка
На горле колбы, заполненной раствором, над меткой не должно быть капель жидкости. Нельзя держать мерную колбу за ее нижнюю часть, иначе может произойти искажение объема за счет тепла, сообщаемого рукой. Следует также помнить, что вода, как и раствор в колбе, должна иметь температуру рабочего помещения. После доведения уровня жидкости до метки колбу закрывают пробкой и хорошо перемешивают полученный раствор, переворачивая колбу вверх-вниз несколько раз.
Пипетки используются для точного отмеривания определенного объема раствора и переноса его из одного сосуда в другой (отбор аликвотной части). Пипетки бывают двух типов:
– пипетки Мора, или мерные (рис. 16, а, д), которые представляют собой длинные узкие трубки с расширением в середине; в верхней узкой части пипетки имеется кольцевая метка, до которой пипетку наполняют жидкостью;
– градуированные (рис. 16, б, в) – измерительные пипетки, напоминающие по форме бюретки и имеющие такую же калибровку.
Кроме того, могут использоваться автоматические пипетки (рис. 16, г).
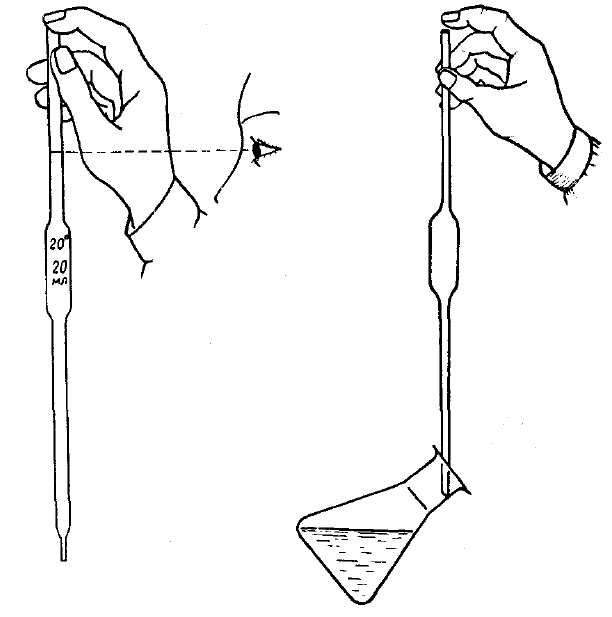
Пипетки рекомендуется заполнять растворами при помощи резиновых груш. Погрузив нижний конец пипетки в жидкость, всасывают в нее раствор так, чтобы уровень жидкости поднялся выше метки. Затем быстро закрывают верхнее отверстие пипетки указательным пальцем и, приоткрывая его, дают жидкости медленно стекать до тех пор, пока нижний край мениска не достигнет метки. При этом глаза должны находиться на уровне метки (рис. 17, а).
Пипетку с раствором переносят в заранее приготовленную для этой цели коническую колбу (рис. 17, б). Приставляют нижний конец пипетки к внутренней стенке колбы и, держа ее вертикально, дают жидкости вытечь. Затем прикасаются кончиком пипетки к стенке сосуда и ждут 15–20 с, пока вытекут остатки раствора. Небольшую часть раствора, которая остается в пипетке, нельзя выдувать или стряхивать.
а б
Рис. 17. Отбор аликвоты пипеткой Мора:
а – правильное положение руки и глаз при отборе аликвоты; б – перенос аликвоты в колбу для титрования
После окончания работы пипетки промывают и помещают в специальный штатив.
Бюретки представляют собой цилиндрические трубки с суженным концом, к которому при помощи резиновой трубки присоединена оттянутая стеклянная трубочка (рис. 18, б). Для титрования растворами веществ, которые разрушают резину, используют бюретки со стеклянными кранами (рис. 18, а).
Бюретку закрепляют строго вертикально (рис. 18, д) в штативе и заполняют раствором титранта до уровня, превышающего нулевую отметку. Наполняют бюретку через воронку.
Н
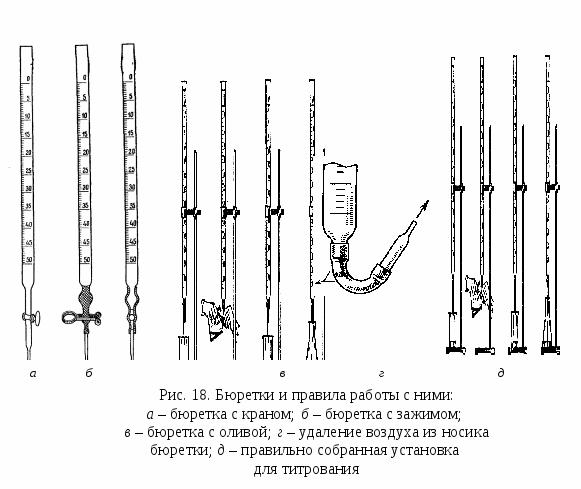 еобходимо внимательно следить за тем, чтобы в бюретке и ее нижней узкой трубке (капилляре) не оставалось пузырьков воздуха. Для их удаления отгибают капилляр кверху (рис. 18, в, г) и, подставив под него пустую коническую колбу или стакан, выпускают жидкость до тех пор, пока весь воздух не будет удален. Воронку обязательно снимают, после чего устанавливают уровень жидкости в бюретке на нулевое деление. Если воронку не снять, то во время титрования с нее могут стечь оставшиеся капли раствора, и измерение объема окажется неточным. Уровень прозрачных растворов устанавливают по нижнему краю мениска, а непрозрачных – по верхнему краю.
еобходимо внимательно следить за тем, чтобы в бюретке и ее нижней узкой трубке (капилляре) не оставалось пузырьков воздуха. Для их удаления отгибают капилляр кверху (рис. 18, в, г) и, подставив под него пустую коническую колбу или стакан, выпускают жидкость до тех пор, пока весь воздух не будет удален. Воронку обязательно снимают, после чего устанавливают уровень жидкости в бюретке на нулевое деление. Если воронку не снять, то во время титрования с нее могут стечь оставшиеся капли раствора, и измерение объема окажется неточным. Уровень прозрачных растворов устанавливают по нижнему краю мениска, а непрозрачных – по верхнему краю.Титрование проводится с целью точного измерения объема стандартного раствора реагента (титранта), израсходованного на реакцию с определяемым веществом.
Перед началом титрования лабораторную посуду необходимо вымыть и сполоснуть дистиллированной водой. Бюретку, кроме того, надо сполоснуть раствором титранта, а пипетку – анализируемым раствором.
Аликвоту анализируемого раствора с помощью пипетки помещают в коническую колбу. Затем создают условия для протекания реакции: добавляют необходимые реагенты, проводят дополнительные операции и т. д.
Опускают капилляр бюретки в коническую колбу с анализируемым раствором так, чтобы он был направлен в центр колбы и находился в верхней части ее горла. Проводят титрование: нажимая левой рукой на шарик, находящийся в резиновой трубке (оливу), сливают по каплям жидкость из бюретки в колбу, непрерывно перемешивая ее содержимое. Сначала титрант сливают тонкой струйкой. Когда окраска индикатора в месте падения капель титранта начнет изменяться, начинают приливать раствор осторожнее, по каплям, следя за тем, чтобы они попадали в раствор, а не оставались на стенках колбы. Титрование прекращают, как только наступает резкое изменение окраски индикатора от приливания одной капли титранта, и записывают объем израсходованного раствора.
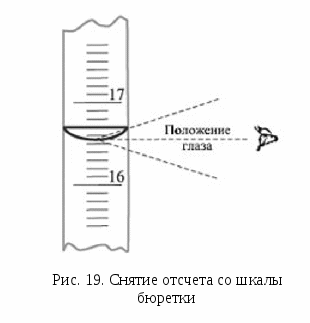
Отсчет проводят по нижнему краю мениска, при этом глаза должны находиться на уровне мениска (рис. 19). Отсчеты нужно записывать с точностью до десятых долей миллилитра, например 14,0 мл, а не 14 мл. Допускается снимать показания с точностью до половины цены деления шкалы, например 14,05 мл.
Перед каждым титрованием следует обязательно установить уровень жидкости в бюретке на нуле.
Д
 ля получения достаточно точных результатов титрования необходимо, чтобы объем раствора, затрачиваемый на титрование, не превышал вместимости бюретки и в то же время не был слишком мал. Обычно при титровании стараются брать такие аликвоты титруемого раствора, чтобы на титрование его затрачивалось 10–20 мл рабочего раствора.
ля получения достаточно точных результатов титрования необходимо, чтобы объем раствора, затрачиваемый на титрование, не превышал вместимости бюретки и в то же время не был слишком мал. Обычно при титровании стараются брать такие аликвоты титруемого раствора, чтобы на титрование его затрачивалось 10–20 мл рабочего раствора.Титрование проводят несколько раз, чтобы получить не менее 3 близких значений объема (V ≤ 0,1 мл).
По окончании работы титрант из бюретки сливают, бюретку моют и промывают дистиллированной водой.