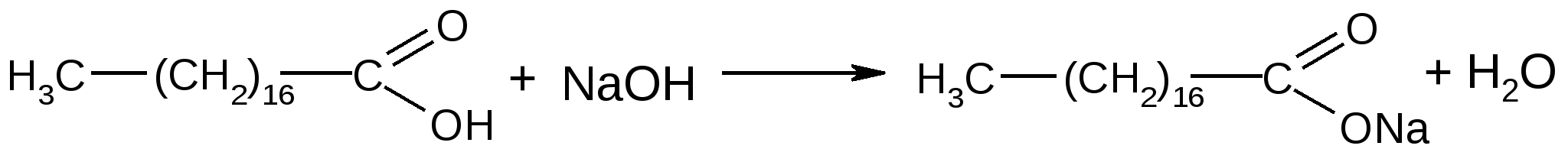Лекция 7 Нитрофенилалкиламины. Анализ производных нитрофенилалкиламинов, гидроксифенилалифатичеких аминокислот и арилгидроксипропаноламинов
 Скачать 0.86 Mb. Скачать 0.86 Mb.
|
|
Анализ производных нитрофенилалкиламинов, гидроксифенилалифатичеких аминокислот и арилгидроксипропаноламинов ПРОИЗВОДНЫЕ НИТРОФЕНИЛАЛКИЛАМИНа Группу составляют левомицетин и его эфиры – левомицетина стеарат и левомицетина сукцинат. История создания: Левомицетин (хлорамфеникол) относится к группе антибиотиков широкого спектра действия. Он действует против Гр(+) и Гр(-) бактерий, а также против риккетсий. Впервые выделен в 1947 году из культуральной жидкости актиномицета Streptomyces venezuelae и уже через 2 года синтезирован в США. В нашей стране группой ученых под руководством академика М.М. Шемякина получен вначале рацемат (синтомицин), затем левовращающий изомер – левомицетин, полностью идентичный американскому препарату хлорамфеникол. По химической структуре он относится к производным п-замещенного нитробензола. Анализ химической структуры: (ошибки в циф.обозначениях) 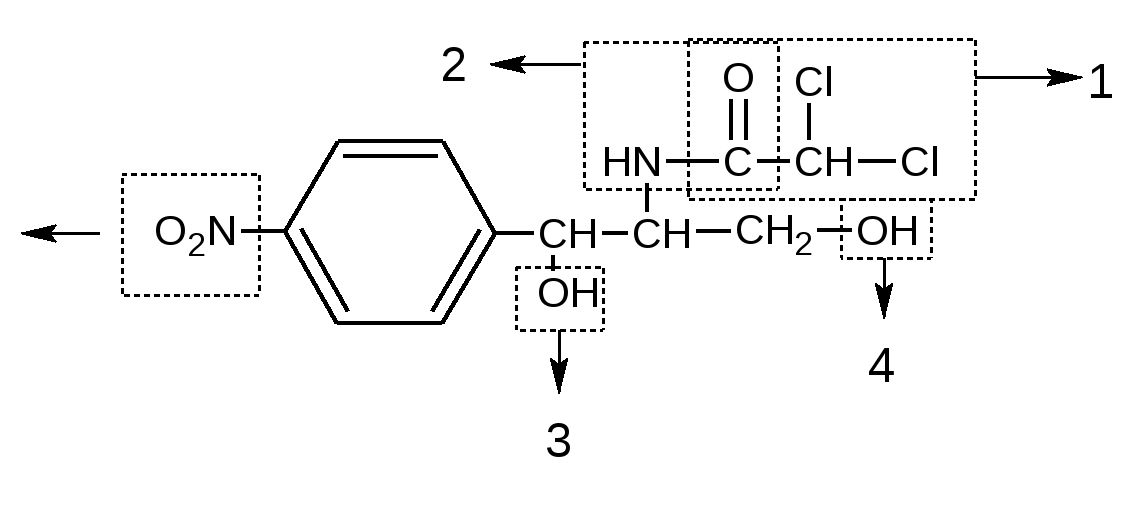
Функциональные группы 1. ковалентно связанный хлор 2.Амидная группа 3. Вторичный спиртовой гидроксил 4. Первичный спиртовой гидроксил 5. Ароматическая нитро-группа Изомерия 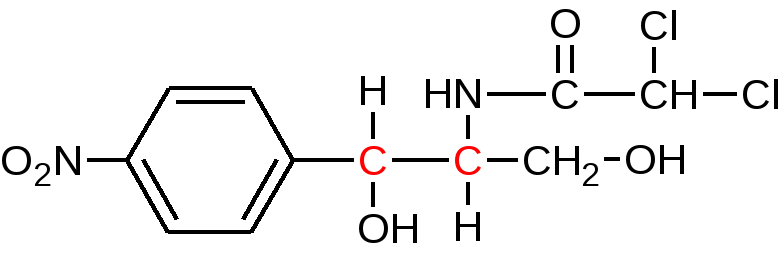 Левомицетин имеет рядом два ассиметрических атома углерода, следовательно, возможно существование четырех оптически деятельных изомеров и двух рацематов. Или в виде двух пар пространственных антиподов: D(-),L(+)-эритро-изомеры (со строением цис-) и D(-),L(+)-трео-изомеры (со строением транс-). Они отличаются между собой пространственным расположением гидроксила и водорода у первого углерода боковой цепи (трео- по разные стороны, эритро- по одной стороне углеродной цепи): 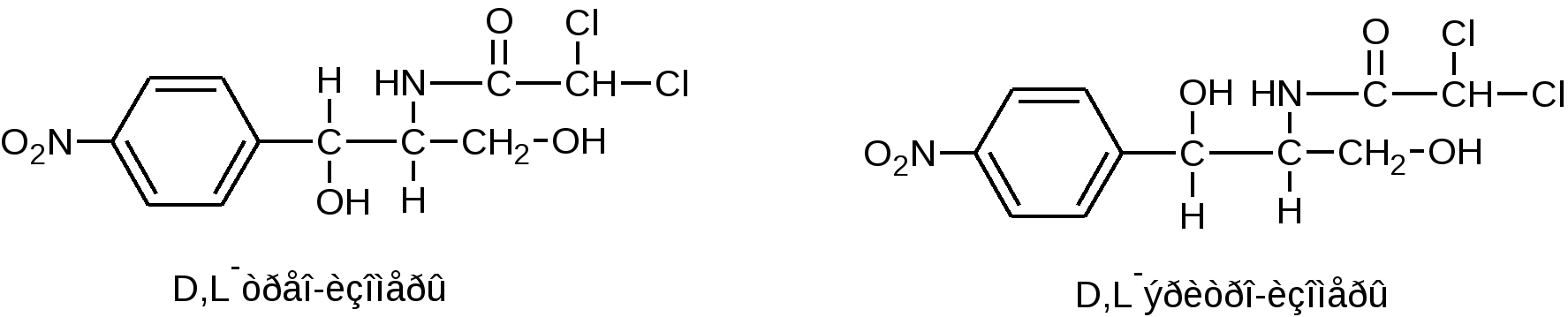 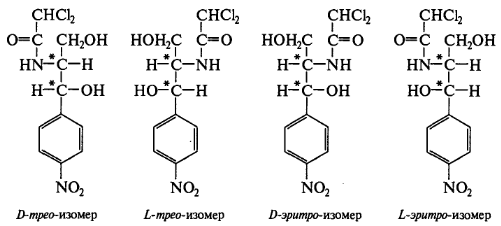 По характеру конфиryрации асимметрического атома углерода в положении С1 оптически активные соединения относят к Д- и L-ряду. Оптическая активность зависит от конфиrypации всех асимметрических атомов углерода, поэтому как в Д-ряду, так и в L-ряду могут быть и левовращающие (-) и правовращающие (+) изомеры. Знак вращения (+) или (-) указывается в скобках после обозначения конфиryрации. Эритро-изомеры очень токсичны и не применяются в медицине. Природный левомицетин, применяющийся в медицине, - это D(-)-трео-изомер. L(+) трео-изомер физиологически не активен, поэтому трео-рацемат обладает 50% активности левомицетина и называется синтомицином. Хлорамфеникол Chloramphenicol (МНН) Левомицетин Leavomycetinum (ЛН)  D(-)-трео-1-(п-нитрофенил)-2-дихлорацетиламинопропандиол-1,3 Описание: белый или белый со слабым желтовато-зеленым оттенком кристаллический порошок без запаха горького вкуса. Растворимость: мало растворим в воде, легко растворим в спирте, растворим в этилацетате, нерастворим в хлороформе. Физико-химические свойства 1. Поглощают свет в УФ-области спектра как ароматические соединения и за счёт группировок с двойными (кратными) связями (карбонильная и нитрогруппа). 2. Являются оптически активными веществами. У хлорамфеникола направление оптического вращения зависит от вида растворителя: 5% раствор хлорамфеникола в этаноле вращает плоскость поляризации вправо (+); 5% раствор в этилацетате - влево (-) ФС. Химические свойства обусловлены функциональными группами: 1. ароматическая нитрогруппа; 2. амидная группа; 3. спиртовые гидроксилы первичный и вторичный; 4. ковалентно связанный хлор; Подлинность 1. ИК-спектр (по МФ III): сравнивают со спектром сравнения или со спектром, полученным со стандартным образцом ЛВ. 2. ФС УФ-спектр поглощения. 0,002% раствор (растворитель - вода) в области 220-400 нм имеет максимум поглощения λmах=278 нм и минимум поглощения λmin=237 нм. 3. ФС Удельный показатель поглощения (E1см1%) Е1%1см от 290 до 305 при длине волны 278 нм (0,002% водный раствор). 4. ФС Удельное вращение [α]D20 от +18° до +21° (5% раствор в 95% спирте). 5. ФС Температура плавления149—153°. 6. ФС 5% раствор хлорамфеникола в этаноле вращает плоскость поляризации вправо (+); 5% раствор в этилацетате - влево (-). П.п. 3 –5 физические константанты подлинности и чистоты Реакции подлинности
Реакция основана на образовании аци-соли, гидролитическом расщеплении и восстановительной минерализации. Реакция идёт в несколько стадий. При нагревании препарата со щелочью образуется желтое окрашивание, при дальнейшем нагревании, переходит в красно-оранжевый цвет(аци-соль). При кипячении окрашивание усиливается до кирпично-красного (азо-соединение) и выделяется аммиак. Его определяют по запаху или посинению красной лакмусовой бумаги. После отделения осадка в фильтрате, подкисленном азотной кислотой, определяют хлорид-ион реакцией осаждения с раствором серебра нитрата. 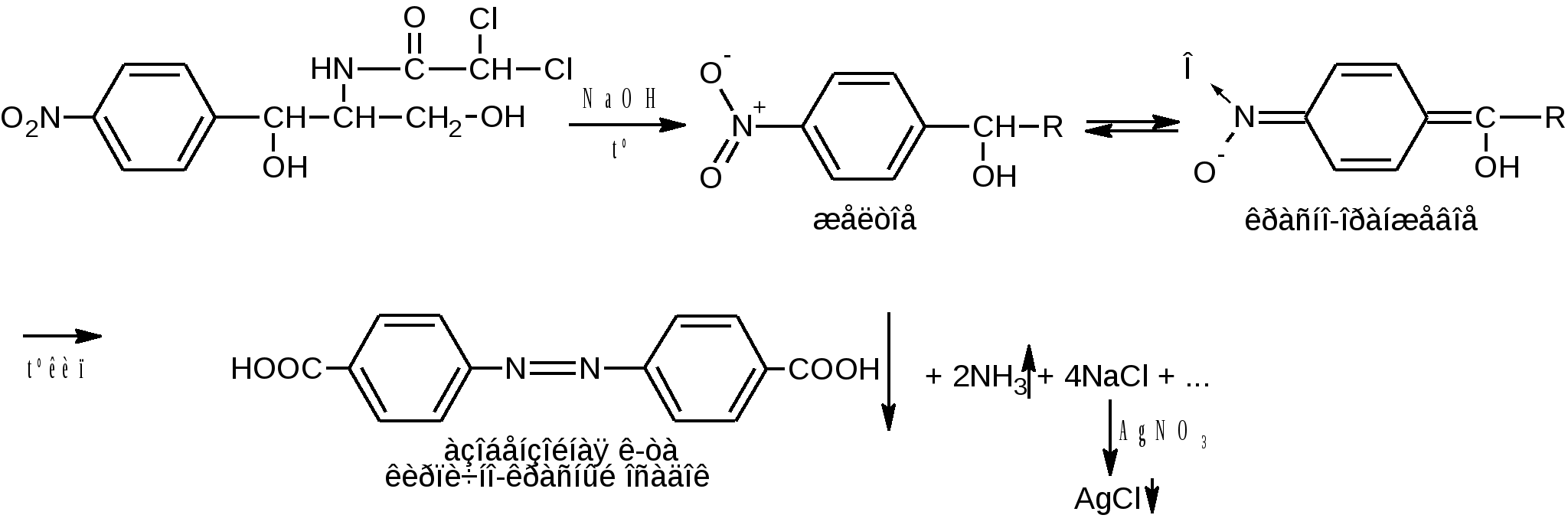 Образовавшееся азосоединение можно объяснить диспропорционированием левомицетина. При этом спиртовые гидроксилы окисляются, а нитрогруппа восстанавливается. Эта реакция специфична и доказывает многие характерные особенности структуры левомицетина:
Эта реакция является общей, для хлорамфеникола и его эфиров
после восстановления нитрогруппы цинковой пылью в кислой среде при нагревании (Zn в H2SO4 или НСI конц.) до первичной ароматической аминогруппы. Одновременно с восстановлением идет легкая минерализация (дегалогенирование – отщепляются атомы хлора). 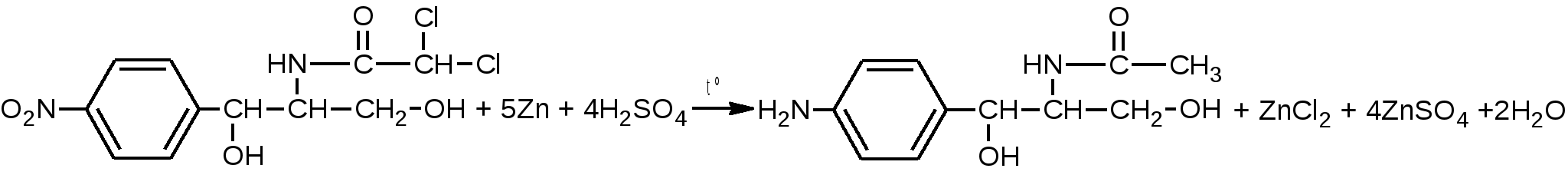 После диазотирования нитритом натрия в среде НСI разв соль диазония сочетают:
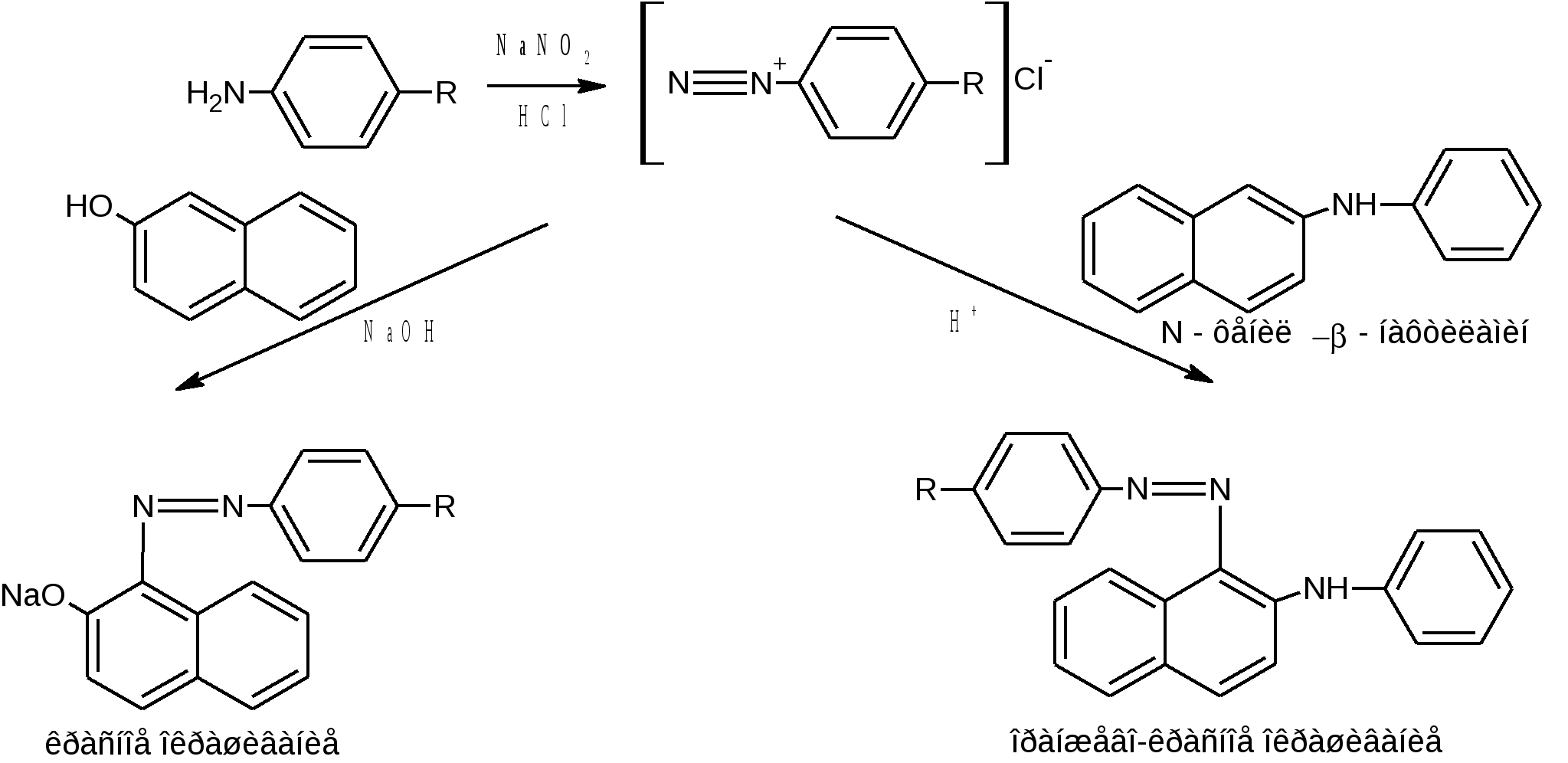 Возможна капельная реакция образования азокрасителя после частичного восстановления нитрогруппы до нитрозогруппы цинковой пылью в среде кальция хлорида при нагревании. В качестве азосоставляющей используют α-нафтиламин в уксуснокислой среде (фиолетовое окрашивание). 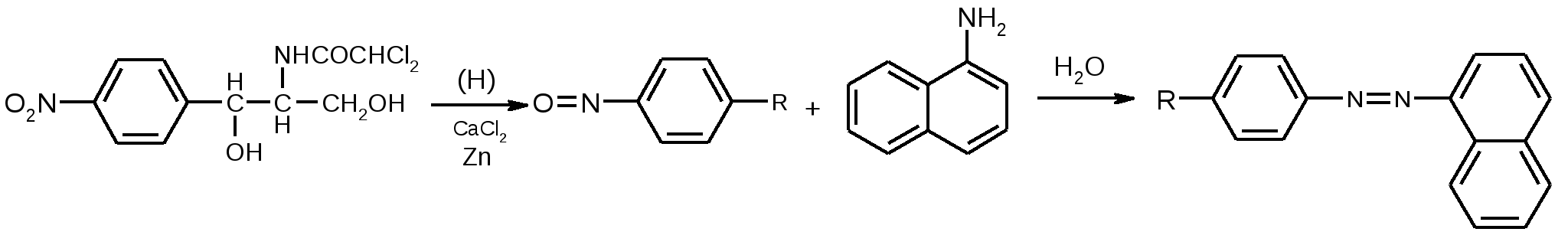 Фиолетовое окрашивание
За счет слабо-кислых свойств спиртового гидроксила в сочетании с аминогруппой. Левомицетин образует окрашенный растворимый комплекс с солями тяжелых металлов аналогично эфедрину. 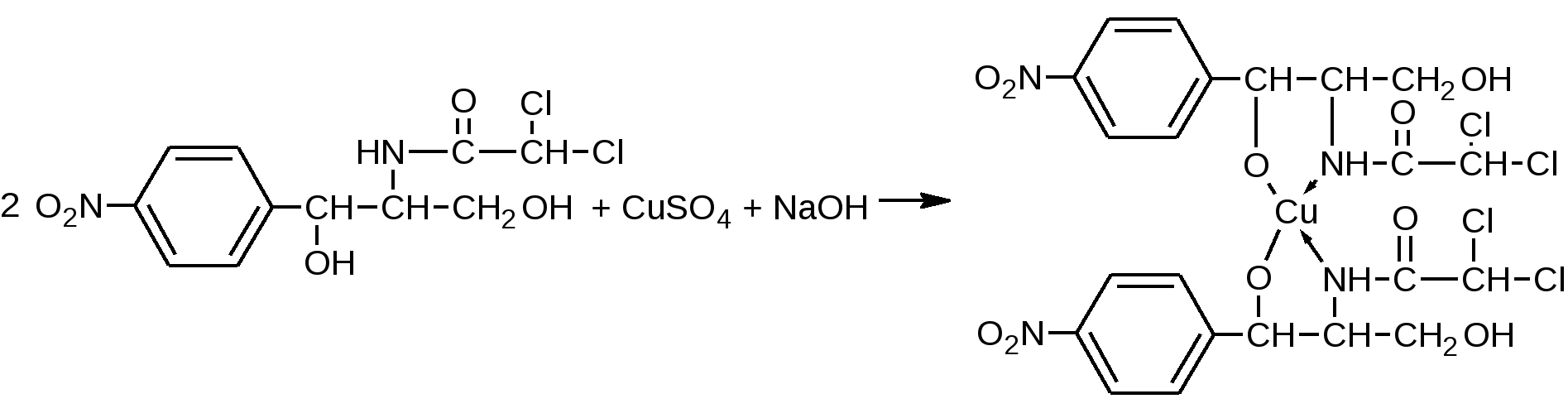 сине-фиолетовое окрашивание Образующееся комплексное соединение извлекается в слой н-бутанола, окрашивая его в сине-фиолетовый цвет. Возможен вариант комплексообразования за счёт двух спиртовых гидроксилов 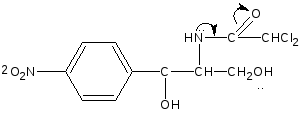 + CuSO4 + 4NaOH  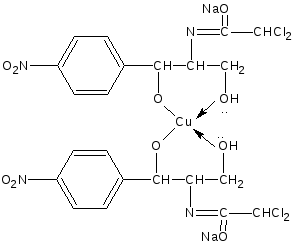  + Na2SO4 + 4H2O Чистота 1.Кислотность (потенциометрически) 2.Общие примеси в пределах эталона хлорид-ионы, сульфатная зола и тяжелые металлы. Специфические примеси: 1. Посторонние примеси (исходные и промежуточные продукты) методом ТСХ на пластинках «Силуфол». Пластинки просматривают в УФ-свете, должно быть не более трёх посторонних пятен, по интенсивности и величине не превышающих пятна свидетелей. Количественное определение
Метод основан на диазотировании первичной ароматической аминогруппы, полученной после восстановления ароматической нитрогруппы.  fэкв.(хлорамф) = 1 Титрант – нитрит натрия, среда – разв соляная кислота, инд – внешний, йод-крахмальная бумага 2KI + 2NaNO2 + 4HCl → I2 + 2NO↑ + 2NaCl + 2KCl + 2H2O
Индикатор: крахмал. Добавляют в конце титрования и титруют до исчезновения синего окрашивания. 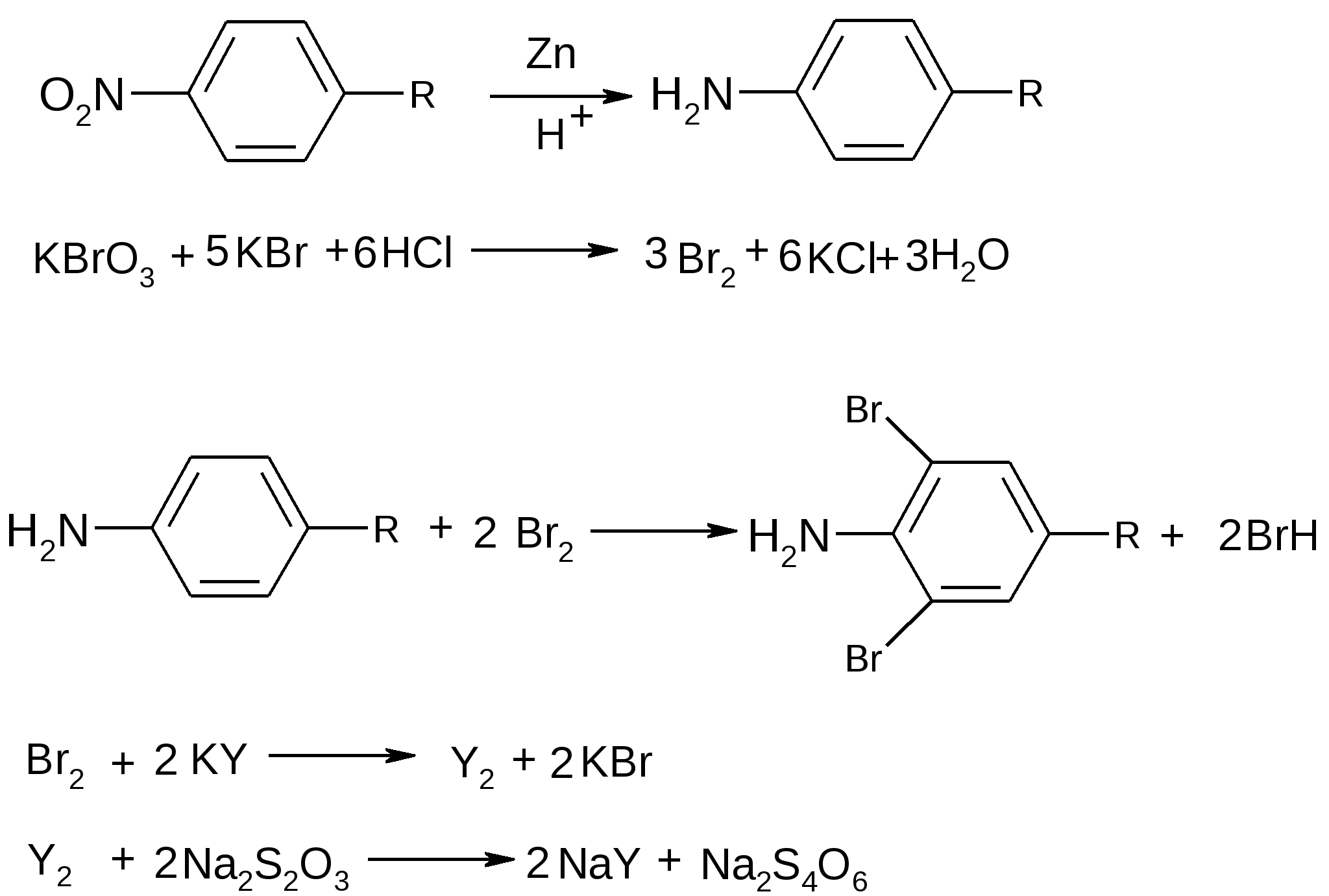 Кстех = 3/2, т.к из 1 моль КВrOз образуется 3Br2 , а на бромирование надо только 2 моль Br2, , т. е. ⅔ моля КВrO3; Кстех = 1 = 3/2, ⅔ титрант готовят с учетом УЧ 1/ 6 КВrO3, fэкв = Кстех · УЧ = 3/2 · 1/ 6 = ¼; М.э. = fэкв · М.м = М.м/4 Т= Ст-та · М.э. 1000 С% =VКВrOз · К · TКВrOз· 100% а
Для количественного определения хлорамфеникола в субстанции расчет по РСО, для таблеток левомицетина – расчет по удельному показателю поглощения. СФМ в УФ- области Формулы расчета концентрации Сх при использовании РСО (раствора стандартного образца) Из закона бугера-Ламберта следует величина оптической плотности прямо пропорциональна величине концентрации раствора и толщине слоя. Dх = D0 Сх = Dх · C0 Сх C0 D0 где Dх - оптическая плотность испытуемого раствора; D0- оптическая плотность раствора стандартного образца; Сх - концентрация испытуемого раствор; C0 - концентрация раствора стандартного образца. С% = Dх · C0(%) · Vк1 · Vк2 . D0 ·а· Vпр 1 2 3 Формулу условно делим на 3 части 1 часть – основа из закона Бугера– Ламберта – Бера 2 часть – учет разведения (колбы, пипетки), где а – навеска сухого вещества в граммах, порошка таблеток или объем раствора, взятый для анализа Vк1, Vк2 – объем разведения (1колбы и 2 колбы) Vпр –объем пробы (пипетки) взятой из 1разведения (Vк1 ) для приготовления 2 разведения (Vк2 ) 3 часть –пересчет на лекарственную форму – Если C0(%) РСО для субстанции (порошка) С% = Dх · C0(%) · Vк1 · Vк2 D0 ·а· Vпр 1 2 3 – Если C0(%) РСО для таблеток, где Рср.– средний вес таблетки С г/табл = Dх · C0(%) · Vк1 · Vк2 · Рср. D0 ·а· Vпр · 100% 1 2 3 Формулы расчета концентрации Сх при использовании удельного показателя поглощения Е1%1см Согласно закону Бугера-Ламберта-Бера величина D прямо пропорциональна величине концентрации раствора и толщине слоя. Dх = Сх(%) ∙ Е1%1см ∙ l , где l – толщина слоя жидкости (кюветы) в см, Е1%1см (константа) Удельный показатель поглощения – это оптическая плотность раствора, содержащего 1,0 вещества в 100 мл (1%) раствора при толщине слоя 1 см. если l =1 см, то Dх = Сх(%) ∙ Е1%1см Сх(%) = Dх. Е1%1см – для таблеток С г/табл = Dх ·Vк1 · Vк2 · Рср. Е1%1см ·а· Vпр · 100% 1 2 3
Титрант раствор меди (II) сульфата (0,01 моль/л), индикатор мурексид. Проводят контрольный опыт, чтобы точнее определить переход окраски в точке эквивалентности.


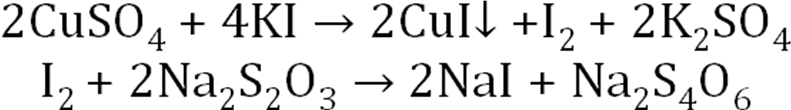 Сульфат меди выделяется в эквивалентном количестве, вступившем в реакцию с левомицетином. На 2 моль левомицетина – 1 моль сульфата меди М.э. = 2М Индикатор: крахмал. Добавляют в конце титрования и титруют до исчезновения синего окрашивания.
Минерализацию проводят кипячением с растворами натрия гидроксида и водорода пероксида. > t0 H2O2 (3%), NaOH R  – CHCl2 2NaCl – CHCl2 2NaCl Образовавшийся натрия хлорид титруют раствором серебра нитрата, либо раствором ртути (II) нитрата. NaCl +AgNO3 →Ag Cl↓ +Na NO3 fэкв.(хлорамф) = ½
С% = α∙100 / l∙[α] Хранение: список Б, ХУТ из оранжевого стекла. Левомицетин относительно устойчив. Однако в водных растворах, под действием неблагоприятных факторов: солнечного света, температуры, солей тяжелых металлов, могут происходить реакции окисления, восстановления, конденсации, при этом образуются: 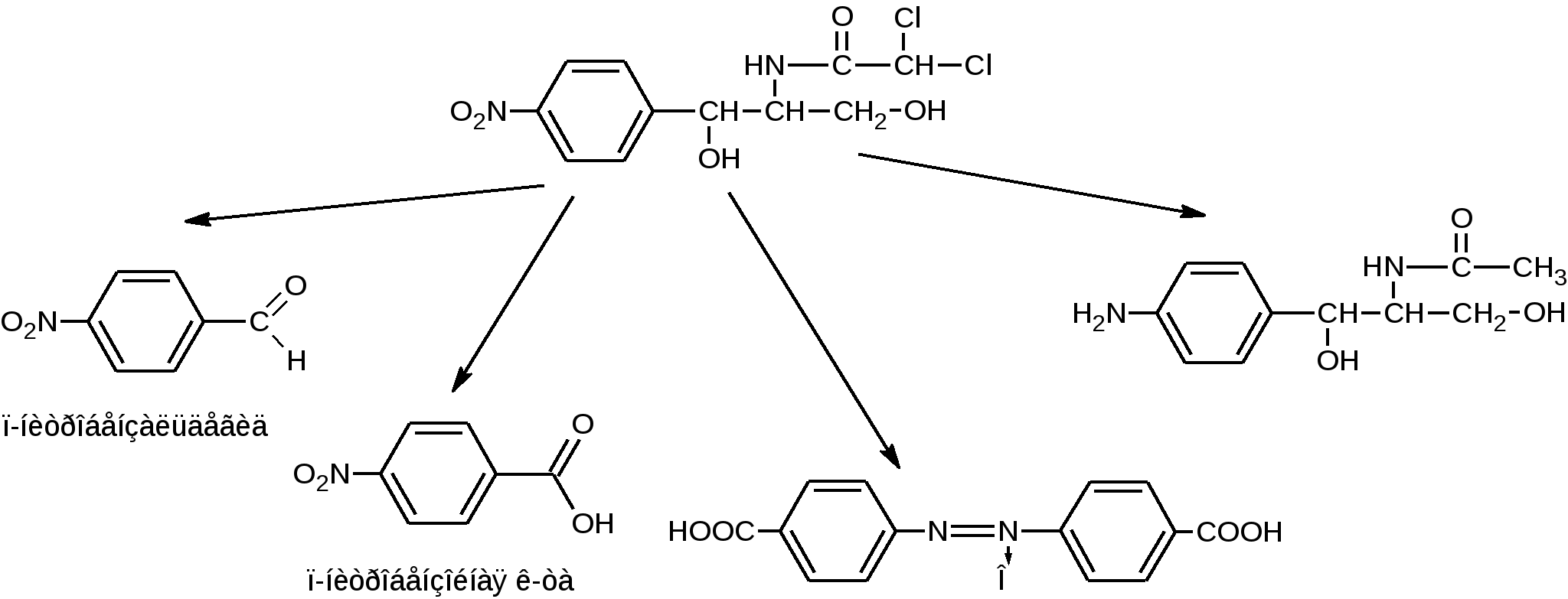 Применение: антибиотик широкого спектра действия. Применение: антибиотик широкого спектра действия.Хлорамфеникола стеарат – Левомицетина стеарат Chloramphenicol Stearate (МНН) Leavomycetini Stearas (ЛН)  D(-)-трео-1-п-нитрофенил-2-дихлорацетиламинопропандиола-1,3-3-стеарат Описание: белый или белый с желтоватым оттенком кристаллический порошок практически без запаха и вкуса. Растворимость: практически нерастворим в воде, трудно растворим в спирте, легко растворим в хлороформе и ацетоне с образованием мутных растворов. Подлинность Физические константы 1.Удельное вращение [α]D20 = от +15˚ до +20˚ (5% раствор в 95% спирте). Растворение проводят при нагревании до 40˚, в случае необходимости фильтруют. 2. Температура плавления. 88-90˚С. Реакции подлинности Помимо всех реакций, характерных для левомицетина, дает реакцию на стеариновую кислоту – реакция отличия левомицетина стеарата от левомицетина

Чистота
Количественное определение
- для субстанции – расчет по раствору стандартного образца Содержание левомицетина в препарате должно быть не менее 51,0% и не более 55,0%. - для таблеток – расчет по удельному показателю поглощения 2. Обратная алкалиметрия – омыление щелочью и титрование избытка гидроксида натрия соляной кислотой. 3. Все методы, применимые для левомицетина. Хранение: список Б, ХУТ. Применение: антибиотик широкого спектра действия. Этот эффект обусловлен активным левомицетином, который освобождается из сложного эфира при ферментативном гидролизе в ЖКТ после перорального приема. Основное его достоинство – отсутствие горького вкуса, что расширяет возможности его применения в педиатрии. Формы выпуска: порошок, таб 0,25, гранулы, суспензия. Левомицетина сукцинат растворимый Хлорамфеникола натрия сукцинат (растворимый) Chloramphenicol sodium succinate (МНН) Laevomycetini succinas solubile (ЛН) 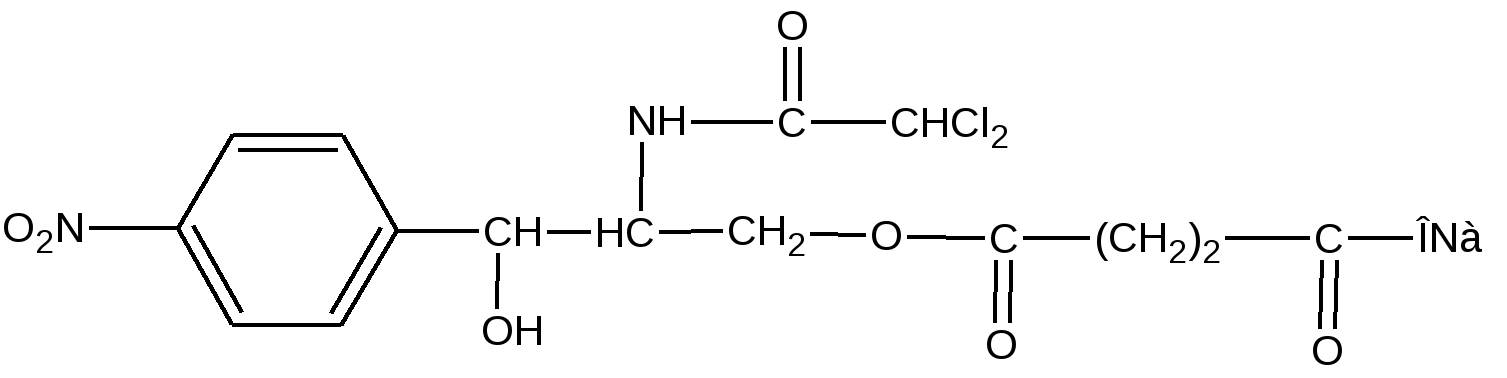 D(-)-трео-1-п-нитрофенил-2-дихлорацетиламинопропандиола-1,3-3-сукцинат натрия Описание: сухая пористая масса белая или с желтоватым оттенком, со слабым специфическим запахом, горького вкуса, гигроскопичен. Растворимость: легко растворим в воде, мало растворим в спирте. Подлинность 2. УФ-спектр поглощения. 0,04% раствор (растворитель - вода) в области 230-350 нм имеет максимум поглощения λmах=276 нм. 3. Удельный показатель поглощения (E1см1%) при λmах=276 нм. 4. Удельное вращение после кипячения с обратным холодильником в НСI 20% + метиловый спирт[α]D20 = от -110 до -12,60 . Реакции подлинности
 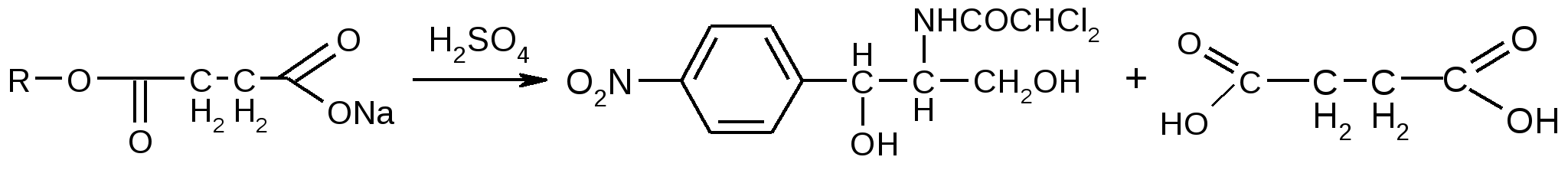 янтарная кислота янтарная кислота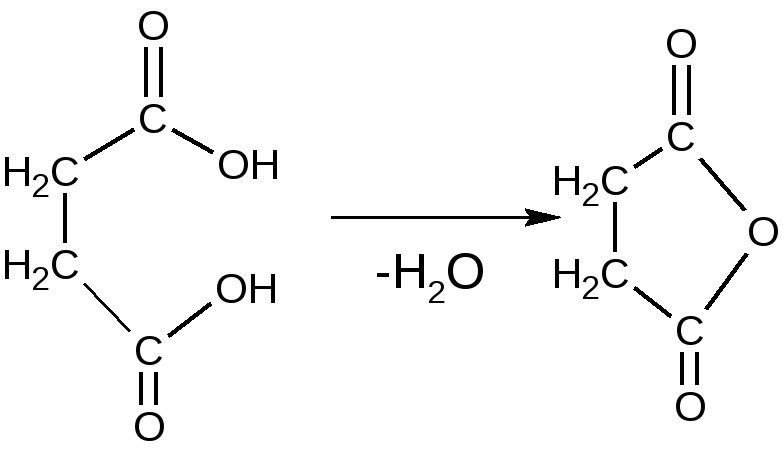 Гидроксамовая реакция вписать реакцию самостоятельно! Чистота
Количественное определение
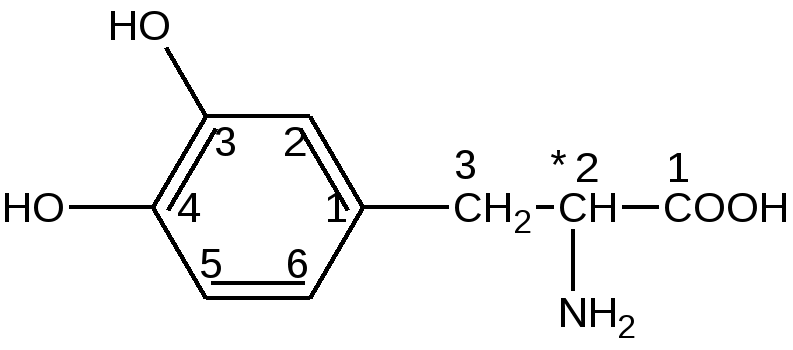
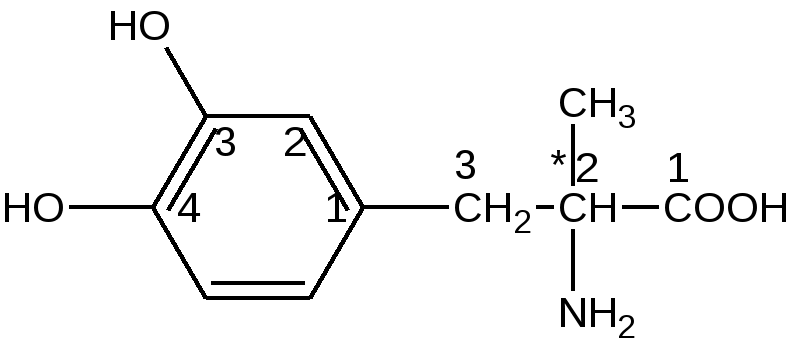
Хранение: список Б, сухое, защищенное от света место, температура хранение не больше 20°С. Выпускается во флаконах по 1,0 и 0,5 в расчете на левомицетин. Применение: антибиотик для инъекций. 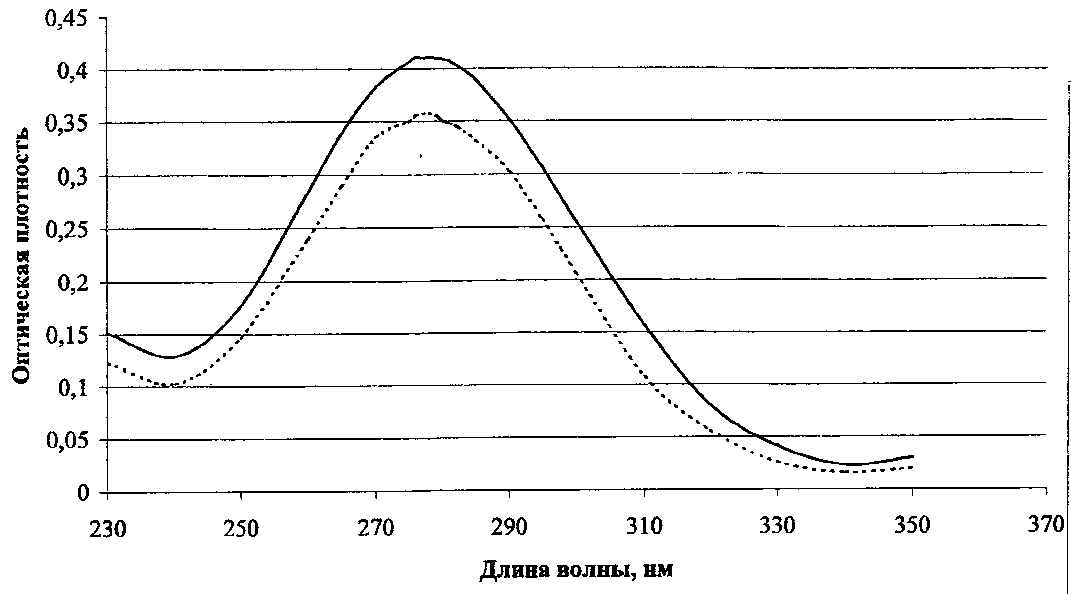 Рис. 16. УФ- спектр левомицетина: раствор РСО левомицетина; таблетки левомицетина 0,5г ПРОИЗВОДНЫЕ ОКСИФЕНИЛАЛИФАТИЧЕСКИХ АМИНОКИСЛОТ По химическому строению эта группа лекарственных веществ являются аналогами природной аминокислоты L-тирозина: 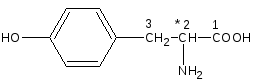 Особого внимания в данной группе ЛС заслуживают леводопа и метилдопа. Они имеют сходную химическую и, соответственно, методы качественного и количественного анализа. Леводопу применяют для лечения паркинсонизма, заболевания центральной нервной системы, вызванного снижением содержания допамина в базальных ганглиях мозга. Леводопа или Дофа (см. тему«Арилалкиламины, гидроксифенилалкиламины») - это биогенное вещество, которое в организме образуется из тирозина и является предшественником допамина (дофамина). Леводопа (ДОФА) легко проникает через гематоэнцефалический барьер, накапливается в головном мозге и при декарбоксилировании превращается в допамин. Сам допамин для лечения паркинсонизма не используется, т.к. плохо проникает через гематоэнцефалический барьер. Метилдопу применяют как гипотензивное средство. В организме при декарбоксилировании метилдопа сначала превращается в аметилдопамин, а затем при j3-гидроксилировании в боковой цепи в аметилнорадреналин, который оказывает противоположное норэпинефрину (норадреналину) действие: норэпинефрин (норадреналин) повышает артериальное давление, а метилнорадреналин, наоборот, понижает. Лекарственные вещества группы гидроксифенилалифатических аминокислот
Леводопа: L-3-(3’,4’-диоксифенил)-2-аминопропионовая кислота Метилдопа: L-3-(3’,4’-диоксифенил)-2-митиламинопропионовая кислота сесквигидрат Описание и растворимость леводопа – белый или почти белый кристаллический порошок без запаха, мало растворим в воде, не растворим в этаноле, хлороформе и эфире. Плохая растворимость в воде – следствие существования в виде прочных внутренних солей. метилдофа – белый или желтовато-белый кристаллический порошок или кусочки без запаха, растворим в воде и спирте, трудно в эфире, очень легко растворим в соляной кислоте. Изомерия оба препарата левовращающие изомеры. Химическиесвойства Обусловлены наличием функциональных групп: 1. Фенольный гидроксил. 2. Первичная алифатическая аминогруппа. 3. Карбоксильная группа. Лекарственные вещества проявляют свойства фенолов и алифатических α-аминокислот. Как аминокислоты проявляют амфотерные свойства:
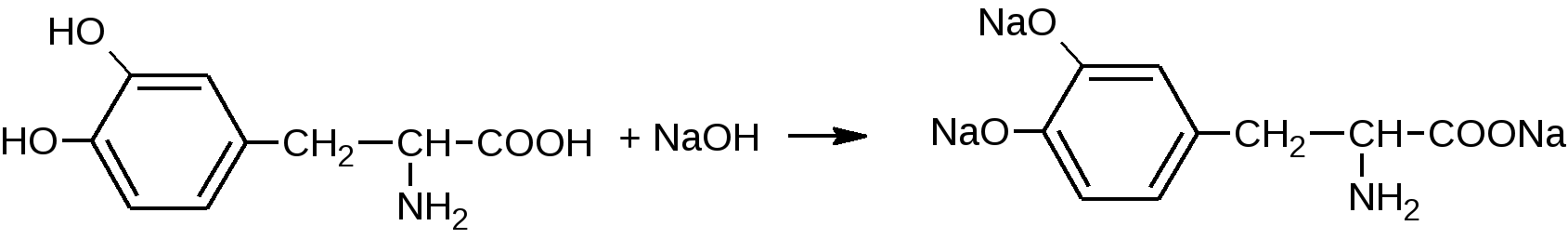 И в гидрокарбонатах щелочных металлов, образуя мононатриевую соль только по карбоксильной группе.
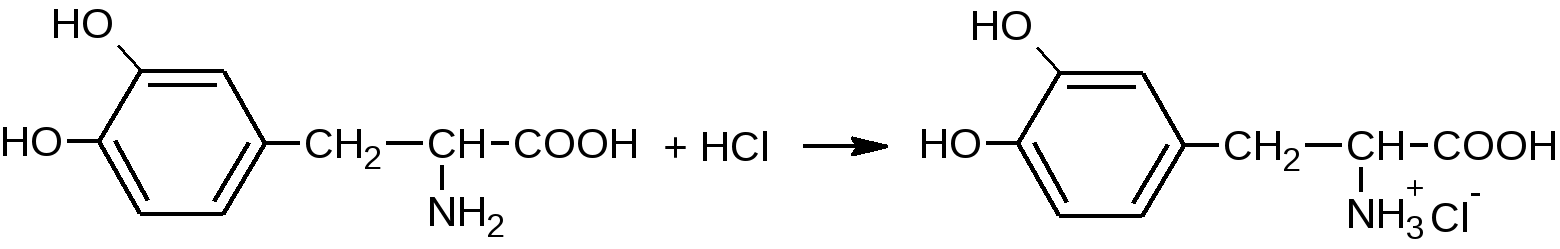  Подлинность (согласно ФС МФ III) 1. ИК-спектр. Сравнивают со спектром сравнения или со спектром, полученным со стандартным образцом ЛВ. Особенность – при возможности проведения СФМ в ИК-области, химические реакции не проводят 2. Удельное вращение [αD20]: [αD20]= от -1600 до -1670 (леводопа) , [αD20] = от -250 до -280 (метилдопа) 3. Температура плавления. ЛВ можно отличить друг от друга по физическим константам. Реакции подлинности (общие)
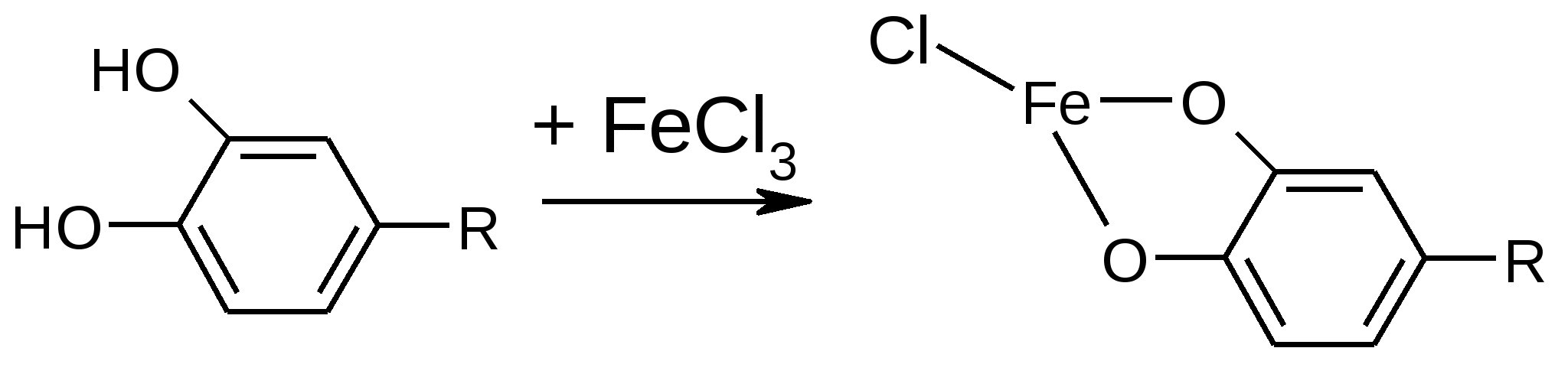
 Аминокислотный остаток тоже окисляется по общим правилам окисления аминокислот. Например. В случае мягкого окисления аминокислоты с нитритом натрия в кислой среде образуют желто-оранжевое окрашивание. Если затем добавить гидроксид натрия, то образуется темно-красное:  2. Реакции на аминокислотный фрагмент 3) ФС Реакция с нингидрином «нингидриновая проба» - для всех аминокислот (см. «Алифатические аминокислоты»). При нагревании появляется сине-фиолетовое окрашивание.   4) Реакция комплексообразования с солями меди (II) в щелочной среде – аналогично алифатическим аминокислотам: 
Леводопа: фиолетовое окрашивание, которое при кипячении переходит в бледно-желтое, а при добавлении карбоната натрия опять в фиолетовое. Метилдопа: оранжевое или янтарное окрашивание.  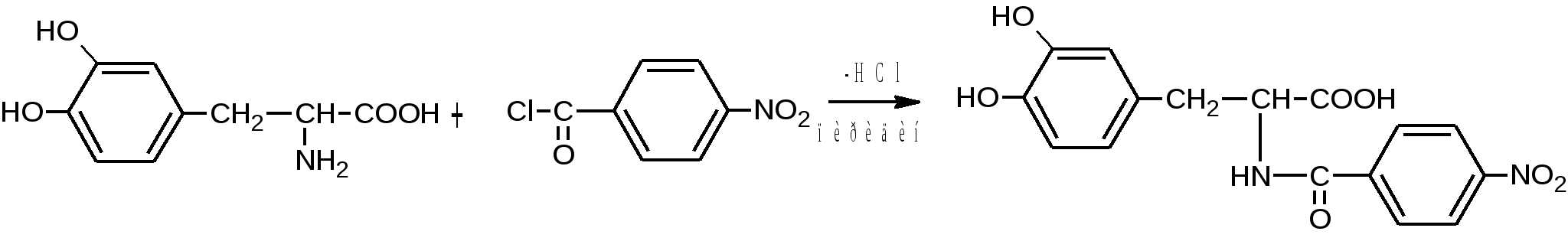 Чистота
Количественное определение: 1.ФС – кислотно-основное титрование (ацидиметрия) в среде неводного (протогенного) растворителя. Протогенные растворители: для леводопы - лед. уксусная кислота СН3СООН+НСООН безводн.; для метилдопы - лед. уксусная кислота СН3СООН+диоксан. Титрант - хлорная кислота, Индикатор - кристаллический фиолетовый. Растворение: 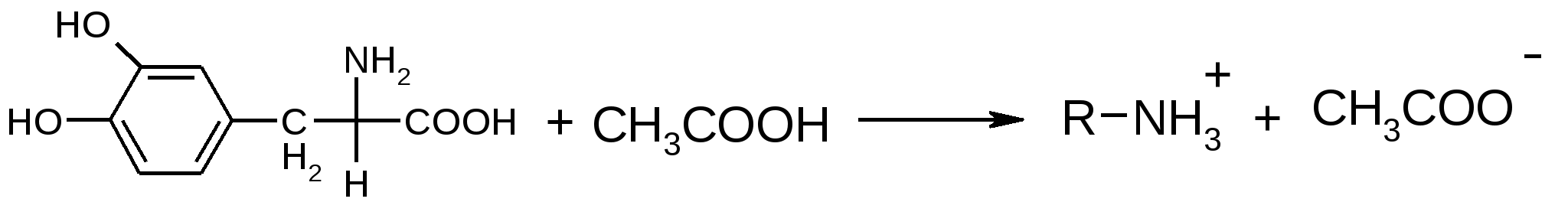 Титрант: Титрование: 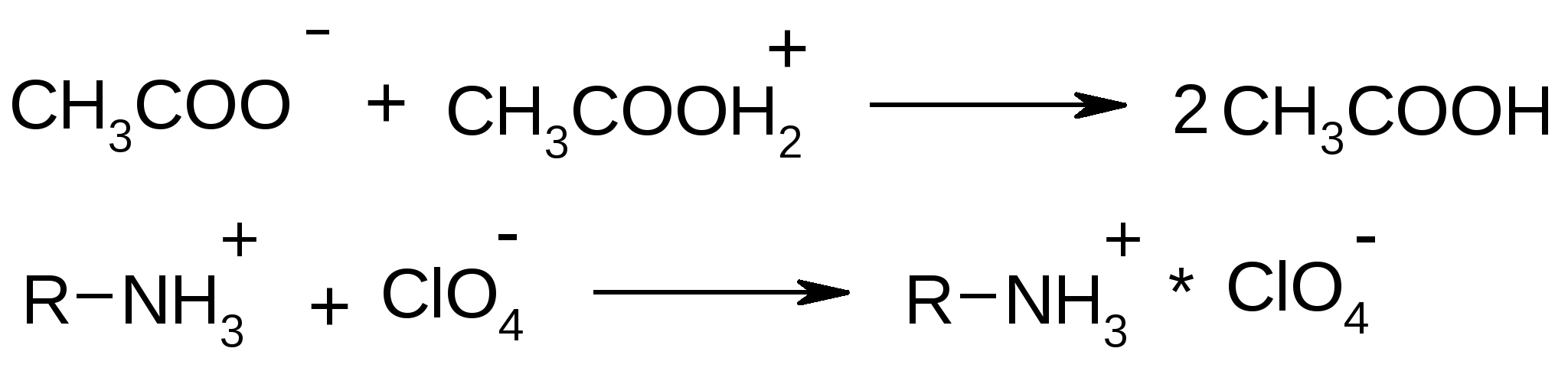 Суммарно: 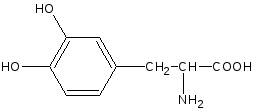 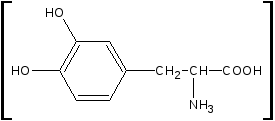 (CH3COOHлед.) + HClO4  ClO4-
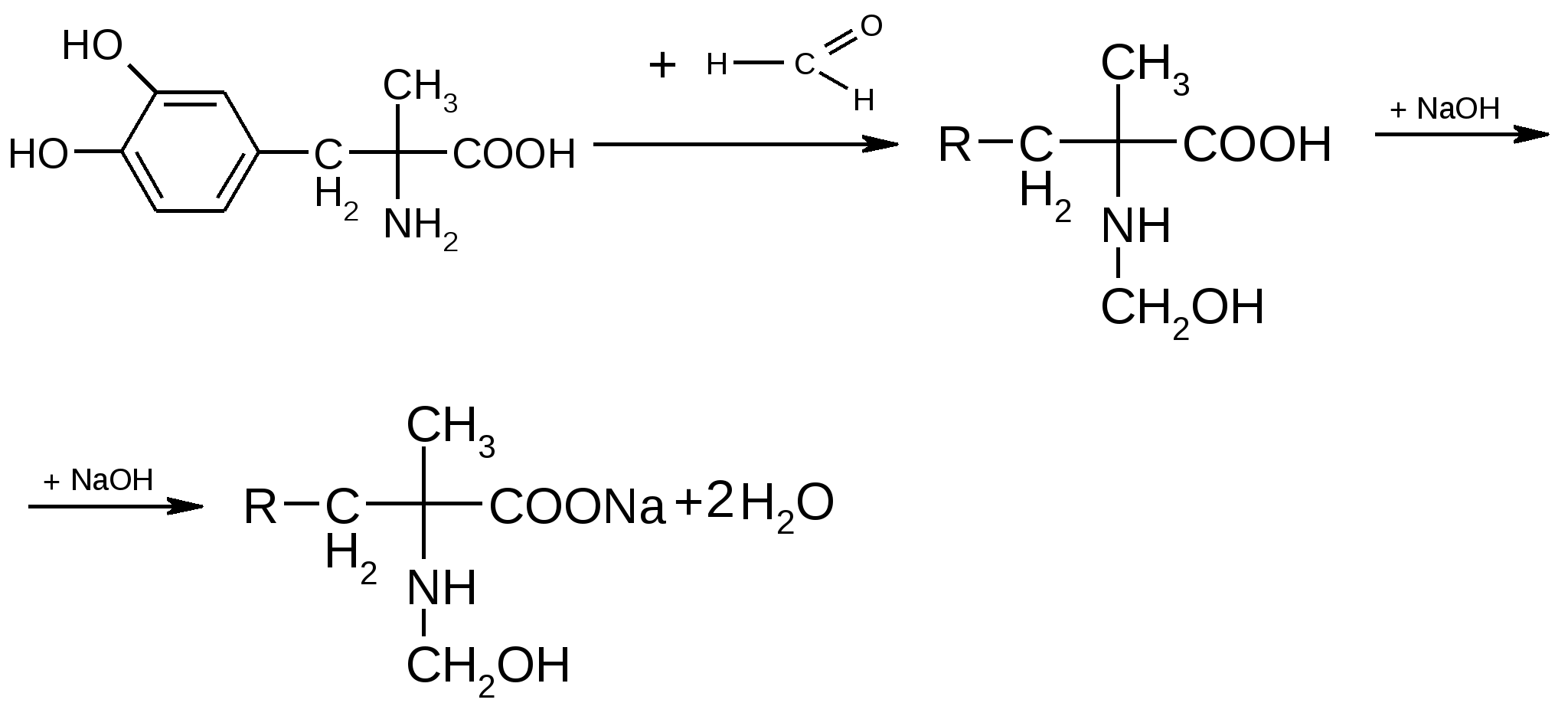  4.Поляриметрия за счет наличия ассиметрического атома углерода. 5. ФЭК по цветным реакциям 6. Метод Кьельдаля Хранение: по списку Б в хорошо укупоренной таре, предохраняющей от действия света, а леводопу – в прохладном, темном месте, вдали от прямого света (т.к. легко окисляются). Применение: Леводопа- антипаркинсоническое средство, назначают при болезни Паркинсона и паркинсонизме. Метилдопа - гипотензивное средство, для лечения гипертонии. Метаболизм Леводопа при введении в организм проникает через ГЭБ, декарбоксилируется и превращается в дофамин, восполняя его недостаток в ЦНС, который наблюдается при болезни Паркинсона. Таким образом, леводопа – это предшественник БАВ дофамина. Сам дофамин через ГЭБ не проникает и для этой цели не применяется. 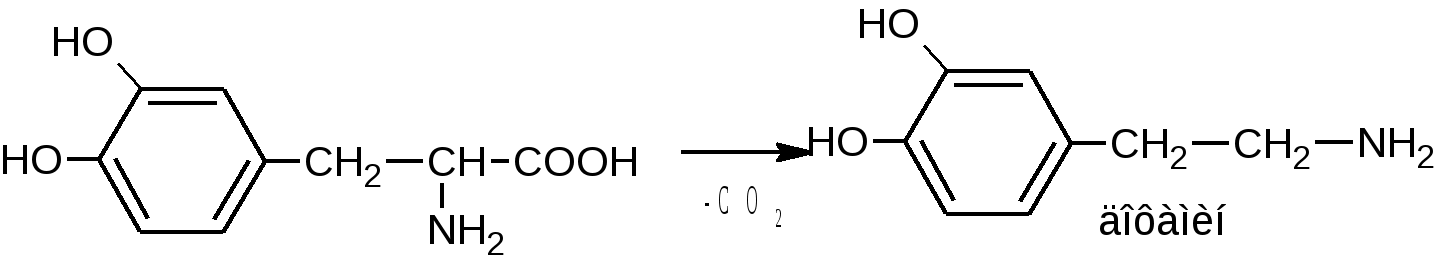 Метилдофа – гипотензивное средство при введении в организм проникает через ГЭБ в ЦНС и превращается сначала в α-метилдофамин, а затем в α-метилнорадреналин, который, стимулируя центральные α2-адренорецепторы, уменьшает поток симпатических импульсов из ЦНС и снижает высвобождение норадреналина из нервных окончаний, что приводит к снижению АД. 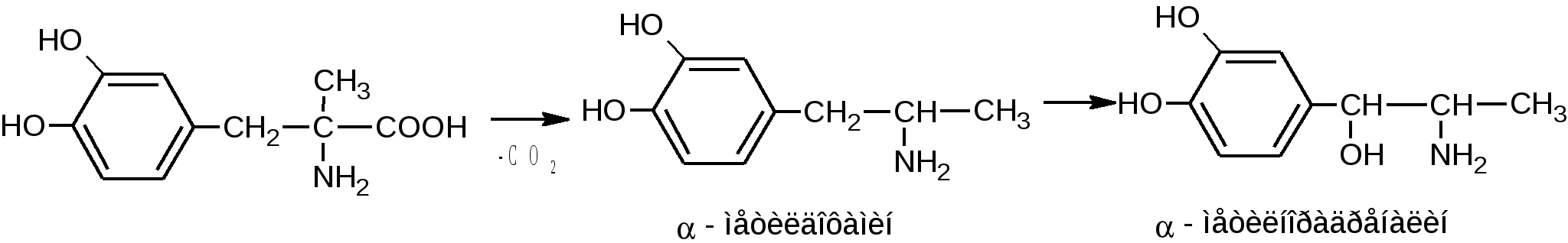 ПРОИЗВОДНЫЕ АРИЛГИДРОКСИПРОПАНОЛАМИНОВ ЛВ группы относятся к β-адреноблокаторам (пропранолола гидрохлорид, атенолол, тимолола мелеат). Они содержат гидроксиаминопропанольную группу. 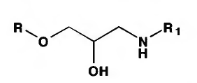 Пропранолола гидрохлорид Propranolol Hydrochloride (МНН) Анаприлин Anaprilinum(ЛН) 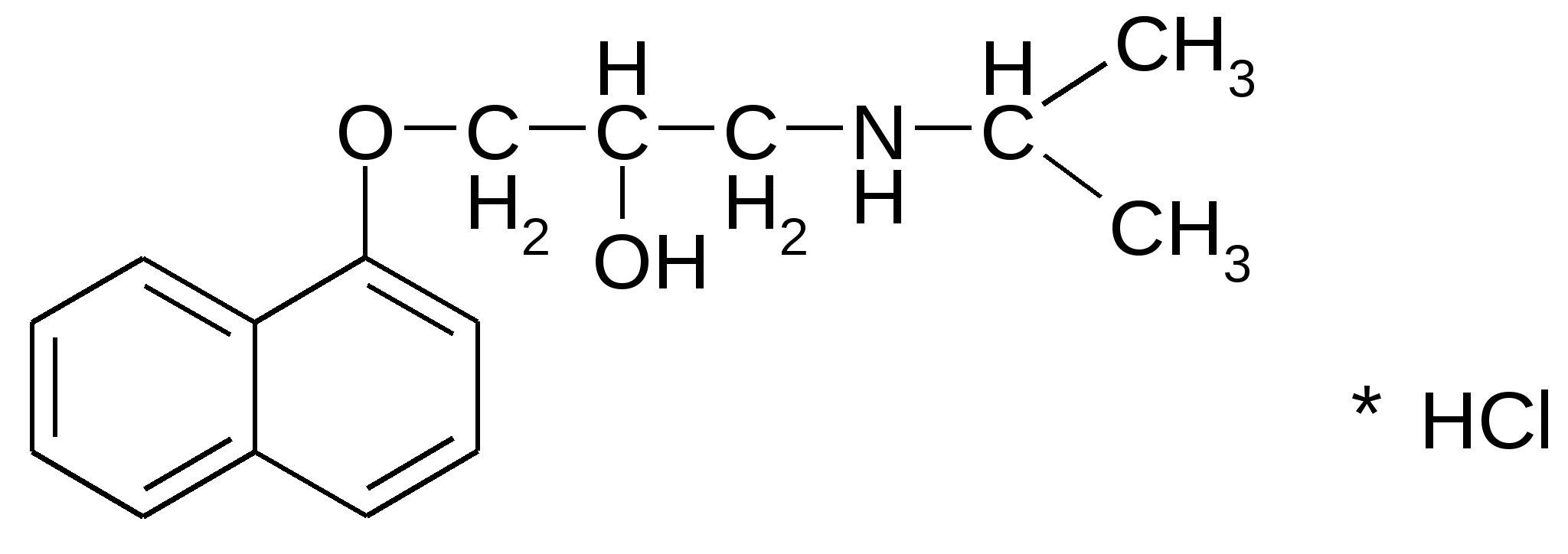 (±)-1-изопропиламино-3-(1’-нафтокси)-2-пропанола гидрохлорид Описание Белый кристаллический порошок без запаха, горького вкуса. Растворим в воде и спирте, не растворим в эфире и бензоле. Растворение в воде сопровождается появлением опалесценции или мути, исчезающих при подкислении раствора 2-3 каплями минеральной кислоты. Подлинность
Реакции
ЛВ - соль, поэтому можно вытеснить слабое органическое основание в виде белого осадка сильным основанием гидроксидом натрия. Основание извлекают эфиром и отгоняют эфир на водяной бане. Определяют Т°пл основания анаприлина(пропронолола) (92°-97°).
Чистота
Количественное определение 1.ФС КОТ в среде протогенного растворителя: ледяной уксусной кислоты и диацетата ртути. Индикатор – кристаллический фиолетовый (до голубого) или потенциометрически со стеклянным индик. электродом. 2. ФС СФМ в УФ-области–раствор для инъекций. 3. Алкалиметрия по связанной хлороводородной кислоте. 4. Аргентометрия по хлорид-иону (см. новокаин, эфедрин, изадрин) Хранение: список Б, ХУТ, в защищенном от света месте, при комнатной температуре. Применение: бета 1– адреноблокатор длительного действия. Антиангинальное, гипотензивное и антиаримтмическое при гипертонической болезни и аритмии. 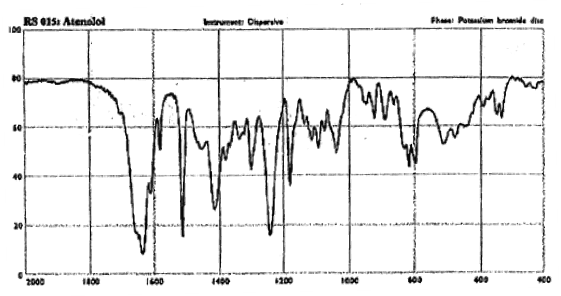 Рис. 1. ИК-спектр атенолола в диске с КВг |

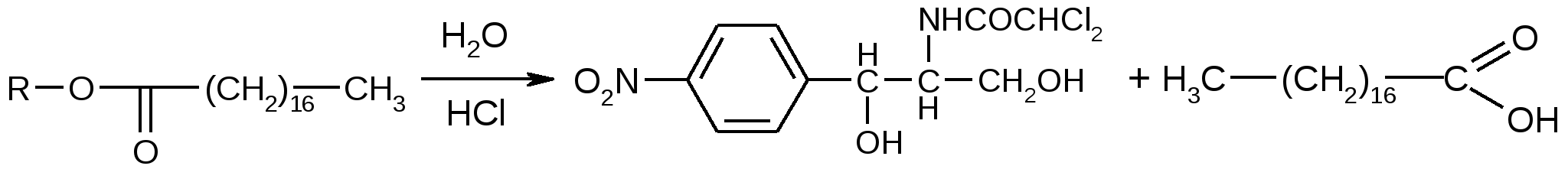 стеариновая кислота
стеариновая кислота