неотложка. Асфиксия новорожденных
 Скачать 354.54 Kb. Скачать 354.54 Kb.
|
|
Патогенез. При СД недостаточная секреция глюкагона в ответ на гипогликемию и снижение эпинефринового (адреналинового) ответа являются одной из причин развития гипогликемий. Клиническая картина гипогликемических состояний связана с энергетическим голодом центральной нервной системы. Нейрогликопенические симптомы: снижение интеллектуальной деятельности (трудности с концентрацией внимания, проблемы с кратковременной памятью, неуверенность в себе, растерянность, вялость, заторможенность), головокружение, нарушенная координация движений, пошатывание при ходьбе, парастезии, диплопия, «мушки» перед глазами, нарушение цветого зрения, проблемы со слухом, сонливость, загруженность, гемиплегии, парезы, судороги, нарушение сознания, кома в результате влияния на ЦНС низкого содержания глюкозы. Автономные симптомы: тремор, холодный пот, бледность кожных покровов, тахикардия, повышение АД, чувство тревоги и страха в результате повышения активности эпинефрина. Как правило, симптомы нейрогликопении возникают раньше автономных симптомов, однако часто остаются незаметными для больных детей и их родителей. У маленьких детей в клинической картине преобладают немотивированное поведение, беспричинные капризы, нередко отказ от еды, включая сладости, выраженная сонливость. В первые годы жизни влияние гипогликемий на состояние центральной нервной системы особенно неблагоприятно (Е). 1-я ст. — легкая. Пациент хорошо осознает свое состояние и самостоятельно купирует гипогликемию. Дети младше 5–6 лет в большинстве случаев не способны сами себе помочь; 2-я ст. — средняя. Пациенты не могут самостоятельно купировать гипогликемию и нуждаются в посторонней помощи, однако в состоянии принимать углеводы per os; 3-я ст. — тяжелая. Пациенты находятся в полубессознательном, или бессознательном, или коматозном состоянии, нередко в сочетании с судорогами, и нуждаются в парентеральной терапии (глюкагон в/м или в/в введение глюкозы). Лечение гипогликемий заключается в немедленном приеме внутрь быстро всасывающихся углеводов: сок, таблетки глюкозы, сахар, мед, варенье, карамель), не используют шоколад, шоколадные конфеты, мороженое из-за медленного всасывания. В среднем для ребенка весом 30 кг необходимо около 10 г глюкозы, а при весе 45 кг — 15 г для повышения уровня гликемии на 3–4 ммоль/л, при использовании фруктозы или сахарозы это количество немного увеличивается. Контрольное исследование гликемии осуществляется через 10–15 мин, при необходимости прием углеводов повторяют. Через 20-30 мин. повторяют контроль гликемии для подтверждения адекватного уровня гликемии (Е). При улучшении самочувствия или нормализации уровня гликемии следует принять сложные углеводы (фрукты, хлеб, молоко) для профилактики рецидива гипогликемии с контролем уровня гликемии через 20–30 мин. При развитии тяжелой гипогликемии (бессознательное состояние, м.б. с судорогами и рвотой), необходимы неотложные меры. При тризме - разжать челюсти и фиксировать язык во избежание его западения и асфиксии. Вводится глюкагон (в/м, п/к или в/в) 0,5 мг в возрасте до 12 лет, 1,0 мг — в более старшем возрасте (или 0,1–0,2 мг/кг). При отсутствии глюкагона (либо недостаточной реакции на него) в/в вводят 20–80 мл 10% раствора глюкозы —до полного восстановления сознания, обычно от 200 до 500 мг/кг массы. При отсутствии эффекта возможно назначение дексаметазона в дозе 0,5 мг/кг. Если сознание не восстановлено, несмотря на достижение достаточного уровня сахара в крови (оптимально - небольшая гипергликемия), необходимо дополнительное обследование для исключения отека мозга и черепно-мозговой травмы (из-за возможного падения ребенка при потере сознания). Необходим дальнейший тщательный мониторинг глюкозы в крови, поскольку после тяжелой гипогликемии часто наблюдается рвота, возможны также рецидивы тяжелой гипогликемии. Ребенку могут потребоваться дополнительные приемы пищи или в/в капельное введение глюкозы (10% раствор 2–5 мг/кг/мин или 1,2–3,0 мл/кг/ч). 8. Гипогликемия новорожденных В неонатальном периоде имеются некоторые особенности выведения новорожденных из гипогликемического состояния (табл. 9.6, 9.7). В случае обнаружения ребенка, получающего инсулинотерапию, в бессознательном состоянии, рекомендуется немедленно ввести то же количество глюкагона подкожно или внутримышечно. У маленьких детей в клинической картине преобладают немотивированное поведение, беспричинные капризы, нередко отказ от еды, включая сладости, выраженная сонливость. В первые годы жизни влияние гипогликемий на состояние центральной нервной системы особенно неблагоприятно Профилактика и лечение неонатальной гипогликемии
Лечение неонатальных гипогликемий при отсутствии стабильного положительного эффекта от введения р-ра декстрозы
9. Синдром дыхательных расстройств у новорожденных Синдром дыхательных расстройств или «респираторный дистресс-синдром» (РДС) новорожденного представляет расстройство дыхания у детей в первые дни жизни, обусловленное первичным дефицитом сурфактанта и незрелостью легких. Основные причины развития РДС у новорожденных детей: • Нарушение синтеза и экскреции сурфактанта альвеолоцитами 2-го типа, связанное с функциональной и структурной незрелостью легочной ткани; • Врожденный качественный дефект структуры сурфактанта (крайне редко). Факторы риска Предрасполагающие факторы развития РДС, которые могут быть выявлены до рождения ребенка или в первые минуты жизни: 1. Развитие РДС у сибсов; 2. Гестационный диабет и сахарный диабет 1-го типа у матери; 3. Гемолитическая болезнь плода; 4. Преждевременная отслойка плаценты; 5. Преждевременные роды; 6. Мужской пол плода при преждевременных родах; 7. Кесарево сечение до начала родовой деятельности; 8. Асфиксия новорожденного. Клиническая картина: • Одышка, возникающая в первые минуты – первые часы жизни; • Экспираторные шумы («стонущее дыхание»), обусловленные развитием компенсаторного спазма голосовой щели на выдохе; • Западение грудной клетки на вдохе (втягивание мечевидного отростка грудины, подложечной области, межреберий, надключичных ямок) с одновременным возникновением напряжения крыльев носа, раздувания щек (дыхание «трубача»); • Цианоз при дыхании воздухом; • Ослабление дыхания в легких, крепитирующие хрипы при аускультации; • Нарастающая потребность в дополнительной оксигенации после рождения. ОСОБЕННОСТИ ОКАЗАНИЯ ПЕРВИЧНОЙ И РЕАНИМАЦИОННОЙ ПОМОЩИ НОВОРОЖДЕННЫМ ИЗ ГРУППЫ ВЫСОКОГО РИСКА ПО РАЗВИТИЮ РДС В РОДИЛЬНОМ ЗАЛЕ Профилактика гипотермии в родильном зале у недоношенных новорожденных У недоношенных детей, родившихся на сроке гестации 28 недель и более, также как и у доношенных новорожденных, используется стандартный объем профилактических мероприятий: обсушивание кожи и обертывание в теплые сухие пеленки. Поверхность головы ребенка дополнительно защищается от теплопотери при помощи пеленки или шапочки. Профилактика гипотермии у недоношенных детей, родившихся до завершения 28-й недели гестации, предусматривает обязательное использование пластиковой пленки (пакета) Отсроченное пережатие и пересечение пуповины МЕТОДЫ РЕСПИРАТОРНОЙ ТЕРАПИИ (СТАБИЛИЗАЦИЯ ДЫХАНИЯ) в настоящее время у недоношенных более предпочтительной считается стартовая терапия методом СРАР с предшествующим продленным раздуванием легких. Создание и поддержание непрерывного положительного давления в дыхательных путях является необходимым элементом ранней стабилизации состояния глубоконедоношенного ребенка, как при спонтанном дыхании, так и при проведении ИВЛ. Постоянное положительное давление в дыхательных путях способствует созданию и поддержанию функциональной остаточной емкости легких, препятствует ателектазированию, снижает работу дыхания. Результаты исследований последних лет показали эффективность так называемого «продленного раздувания легких» в качестве старта респираторной терапии у недоношенных новорожденных. Маневр «продленного раздувания» представляет собой удлиненный искусственный вдох. Его следует проводить по окончании первичных мероприятий, при отсутствии самостоятельного дыхания, при нерегулярном дыхании или при дыхании типа «gasping» с давлением 20-25 см Н2О в течение 15-20 секунд (В). При этом у недоношенных детей эффективно формируется остаточная емкость легких. Этот прием выполняется однократно. Если ребенок с рождения кричит, активно дышит, то продленное раздувание проводить не следует. В этом случае детям, родившимся на сроке гестации 32 недели и менее, следует респираторную терапию начинать методом СРАР с давлением 5-6 см Н2О. Недоношенным детям, родившимся на сроке гестации более 32 недель, СРАР следует проводить при наличии дыхательных нарушений 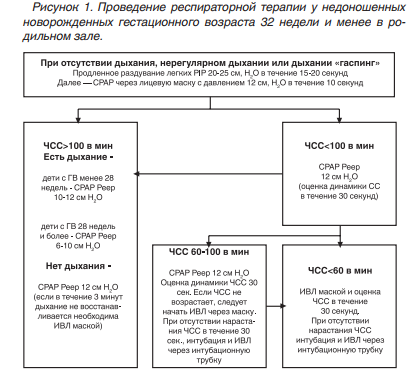 Представленная на рисунке (1) последовательность действий заключается в следующем: После завершения продленного раздувания легких следует перейти к респираторной терапии методом СРАР в течение 10 секунд с последующей оценкой ЧСС. Если у ребенка по истечении 30 секунд начальной респираторной терапии показатели ЧСС более 100 ударов в минуту, то следует продолжить дыхательную терапию методом СРАР с давлением 6 - 12 см. Н2О (в зависимости от гестационного возраста) при наличии самостоятельного дыхания и с давлением 12 см. Н2О при отсутствии самостоятельного дыхания. Если в течение 5 минут самостоятельное дыхание не восстановилось, следует начать ИВЛ маской с Pip 20 - 22 см. Н2О, Рeep 5 - 6 см. Н2О, временем вдоха 0,5 секунд и частотой 60 в минуту. При отсутствии эффекта от ИВЛ маской - появления самостоятельного дыхания, следует провести интубацию трахеи и продолжить ИВЛ через интубационную трубку. Если у ребенка отмечается брадикардия с ЧСС 60 - 100 спустя 20 секунд проведения продленного раздувания и 10 секунд СРАР, следует продолжить СРАР с давлением 12 см. Н2О и каждые 30 секунд оценивать ЧСС. При сохранении ЧСС 60 - 100 и при отсутствии динамики нарастания ЧСС, необходимо начать ИВЛ маской. Сохраняющаяся брадикардия и отсутствие тенденции к увеличению ЧСС на фоне ИВЛ маской в течение 30 секунд является показанием к интубации и продолжению ИВЛ через интубационную трубку. При проведении неинвазивной респираторной терапии недоношенным новорожденным в родильном зале необходимо введение в желудок зонда для декомпрессии на 3 - 5 минуте. Критериями неэффективности СРАР (помимо брадикардии) как стартового метода респираторной поддержки можно считать нарастание степени тяжести дыхательных нарушений в динамике в течение первых 10 - 15 минут жизни на фоне СРАР: выраженное участие вспомогательной мускулатуры, потребность в дополнительной оксигенации (FiO2 > 0,5). Эти клинические признаки свидетельствуют о тяжелом течении респираторного заболевания у недоношенного, что требует введения экзогенного сурфактанта. ОСОБЕННОСТИ ПРОВЕДЕНИЯ ИВЛ В РОДИЛЬНОМ ЗАЛЕ У НЕДОНОШЕННЫХ НОВОРОЖДЕННЫХ Искусственная вентиляция легких у недоношенных проводится при сохраняющейся на фоне СРАР брадикардии и/или при длительном (более 5 минут) отсутствии самостоятельного дыхания. Необходимыми условиями для эффективной ИВЛ у глубоко недоношенных новорожденных являются: • Контроль давления в дыхательных путях; • Обязательное поддержание Реер +4 - 6 см. Н2О; • Возможность плавной регулировки концентрации кислорода от 21 до 100%; • Непрерывный мониторинг ЧСС и SрO2. Стартовые параметры ИВЛ: Pip – 20 - 22 см. Н2О, Рeep – 5 см. Н2О, частота 40 - 60 вдохов в минуту. Основным показателем эффективности ИВЛ является возрастание ЧСС > 100 уд/мин. ОКСИГЕНОТЕРАПИЯ И ПУЛЬСОКСИМЕТРИЯ У НЕДОНОШЕННЫХ НОВОРОЖДЕННЫХ В РОДИЛЬНОМ ЗАЛЕ «Золотым стандартом» мониторинга в родильном зале при оказании первичной и реанимационной помощи недоношенным новорожденным является мониторинг показателей ЧСС и SрO2 методом пульсоксиметрии. . Пульсоксиметрический датчик устанавливается в области запястья или предплечья правой руки ребенка («предуктально») при проведении начальных мероприятий. Стартовую респираторную терапии у детей, родившихся на сроке гестации 28 недель и менее, следует осуществлять с FiO2 = 0,3. Респираторная терапия у детей большего гестационного возраста осуществляется воздухом. Начиная с конца 1-й минуты жизни, следует ориентироваться на показатели пульсоксиметра (см. таблицу 1) и следовать описанному ниже алгоритму изменения концентрации кислорода.  При нахождении показателей, определенных у ребенка за пределами указанных значений, следует изменять (увеличивать/уменьшать) концентрацию дополнительного О2 ступенчато на 10-20% каждую последующую минуту до достижения целевых показателей. Исключение составляют дети, требующие непрямого массажа сердца на фоне проведения ИВЛ. В этих случаях одновременно с началом непрямого массажа сердца концентрацию О2 следует увеличить до 100%. СУРФАКТАНТНАЯ ТЕРАПИЯ Таким образом, введение сурфактанта может быть рекомендовано: 1. Профилактически, в первые 20 минут жизни, всем детям, родившимся на сроке гестации 26 недель и менее при отсутствии проведения их матерям полного курса антенатальной профилактики стероидами и/или невозможности проведения неинвазивной респираторной терапии в родильном зале (А). 2. Всем детям гестационного возраста ≤ 30 недель, потребовавшим интубации трахеи в родильном зале. Наиболее эффективное время введения первые 20 минут жизни. 3. Недоношенным детям гестационного возраста > 30 недель, потребовавшим интубации трахеи в родильном зале при сохраняющейся зависимости от FiO2 > 0,3-04. Наиболее эффективное время введения – первые два часа жизни. 4. Недоношенным детям на стартовой респираторной терапии методом СРАР в родильном зале при потребности в FiO2 ≥ 0,5 и более для достижения SpO2 = 85% к 10 минуте жизни и отсутствии регресса дыхательных нарушений, а также улучшения оксигенации в последующие 10-15 минут. К 20-25 минуте жизни нужно принять решение о введении сурфактанта или о подготовке к транспортировке ребенка в ОРИТН на СРАР (D). 5. Детям, родившимся на сроке гестации ≤28 недель, на стартовой терапии методом СРАР, при наличии показаний в родильном зале сурфактант может быть введен неинвазивным методом. Детям, большего гестационного возраста, настартовой терапии методом СРАР, при наличии показаний в родильном зале сурфактант может быть введен традиционным методом (В). 6. В отделении реанимации детям, родившимся на сроке ≤ 35 недели, на респираторной терапии методом СРАР/неинвазивная ИВЛ при оценке по шкале Сильверман > 3 баллов в первые 3-6 часов жизни и/или потребности в FiO2 до 0,35 у пациентов < 1000 г. и до 0,4 у детей > 1000 г. (В). Повторное введение показано: 1. Детям гестационного возраста ≤35 недель на СРАР, уже получившим первую дозу сурфактанта, при переводе их на ИВЛ в связи с нарастанием дыхательных нарушений (FiO2 до 0,3 у пациентов <1000 г. и до 0,4 у детей >1000 г.) в первые сутки жизни. 2. Детям гестационного возраста ≤35 недель на ИВЛ, уже получившим первую дозу сурфактанта, при ужесточении параметров вентиляции (МАР до 7 см. Н2О и FiO2 до 0,3 у пациентов <1000г и до 0,4 у детей >1000 г.) в первые сутки жизни. Повторное введение следует проводить только после проведения рентгенографии органов грудной клетки. Третье введение может быть показано детям на ИВЛ с тяжелым РДС (А). Интервалы между введениями 6 часов. Однако интервал может сокращаться при нарастании у детей потребности в FiO2 до 0,4. Противопоказания: • Профузное легочное кровотечение (можно вводить после купирования при наличии показаний); • Пневматоракс. | ||||||||||||||||||||||||||||||||
