Автореферат_Бидненко. Автореферат дисертації на здобуття наукового ступеня кандидата фармацевтичних наук Харків 2017
 Скачать 1.05 Mb. Скачать 1.05 Mb.
|
|
Склад таблеток «Ангіолін»
Отримані в лабораторних умовах таблетки за фармако-технологічними властивостями (однорідність маси, стійкість до роздавлювання, стиранність, розпадання, розчинення) відповідають вимогам ДФУ. Розроблена технологічна схема виробництва таблеток «Ангіолін», яка була апробована на базі ДП «Державного наукового центру лікарських засобів і медичної продукції». Розробка методик стандартизації таблеток «Ангіолін» У розділі 4 наведені результати досліджень з розробки сучасних фізико-хімічних методик стандартизації отриманих таблеток сучасними методами. Спираючись на хімічну будову ангіоліну, (рис.2) було проведено аналіз субстанції згідно з розробленими методиками.  Рис. 2. Структурна формула ангіоліну ((S)-2,6-діаміногексанової кислоти 3-метил-1,2,4-триазоліл-5-тіоацетат) Досліджувана субстанція ангіоліну являє собою кристалічний порошок білого або майже білого кольору із слабким специфічним запахом, є гігроскопічною речовиною. Для аналізу субстанції ангіоліну нами запропоновано та проведено її дослідження хімічними методами та розроблена методика спектрофотометричного визначення кількісного вмісту. Результати аналізу субстанції наведено в табл. 3. Таблиця 3 Результати аналізу субстанції ангіоліну методом спектрофотометрії
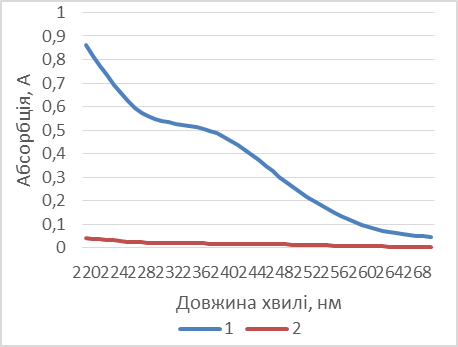 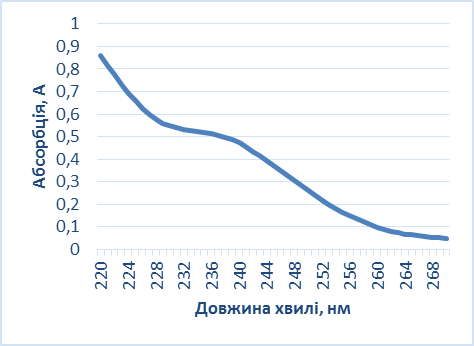 Рис. 3. Абсорбція допоміжних речовин (2) і таблеткової маси ангіоліну (1). Рис. 4. Абсорбція РСЗ ангіоліну Як видно з наведених рисунків, допоміжні речовини у складі таблеткової маси практично не впливають на результати аналізу. Результати кількісного визначення ангіоліну в лабораторних серіях таблеткових мас наведено в табл. 4. Як видно з наведених в таблиці даних, розроблена методика визначення кількісного вмісту ангіоліну в таблетковій масі методом спектрофотометрії є зручною та простою у виконанні, точною і відтворюваною. Наступним етапом дослідження стала розробка методів стандартизації, специфікації та складання на основі розроблених методик проекту МКЯ. Доброякісність таблеток визначали за показниками згідно вимог ДФУ. Таблиця 4 Результати аналізу таблеткової маси «Ангіолін» методом спектрофотометрії
Далі досліджували отримані таблетки «Ангіолін». Розробку методів стандартизації проводили на 6 серіях таблеток, виготовлених в лабораторних умовах. В ході роботи лабораторні серії таблеток «Ангіолін» досліджували за наступними показниками: Середня маса.Середня маса таблеток ангіоліну має бути в межах від 0,304 г до 0,336г. Було проведено дослідження на 6-ти серіях отриманих в лабораторних умовах таблеток та встановлено, що середня маса розроблених нами таблеток знаходиться у допустимих межах 0,32±0,0160 г і відповідає вимогам ДФУ, 2.9.5. Однорідність маси для одиниці дозованого лікарського засобу,ДФУ, 2.9.5. (Відхилення маси кожної таблетки від середньої маси має бути в межах 5%. При випробуванні 6-ти серій отриманих таблеток, по 20 таблеток в кожній серії, відхилень від середньої маси на величину понад 5% не спостерігалось. Однорідність вмісту діючої речовини в одиниці дозованого лікарського засобу,ДФУ, 2.9.6. Вимоги тесту вважаються виконаними за умови, що вміст діючої речовини у кожній з 10 одиниць, визначений за методом прямого визначення, знаходиться в межах 85,0 – 115,0% від зазначеного в розділі "Склад", а відносне стандартне відхилення (стандартне відхилення, виражене у відсотках до середнього результату) не перевищує 7,5 %. Тест проводили методом спектрофотометрії, використовуючи 10 таблеток ангіоліну, отриманих в лабораторних умовах. Розпадання, ДФУ, 2.9.1. Дослідження проводили на кафедрі фармацевтичної хімії ЗДМУ з використанням тестеру для визначення розпадання таблеток ERWEKA серії ZTx20. В результаті дослідження 6-ти серій отриманих таблеток час розпадання не перевищував 15 хв, що відповідає вимогам ДФУ. Розчинення.Відомо, що в таблетованих лікарських формах велику увагу приділяють біодоступності. Тому для оригінального лікарського препарату «Ангіолін» нами було проведено тест «Розчинення». Визначення кількісного вмісту речовини, яка перейшла у розчин, було знайдено за допомогою метода спектрофотометрії, який застосовували для аналізу субстанції і таблеткової маси. Випробуваний розчин. Для випробування у посуд для розчинення поміщали одну таблетку. Через 45 хв відбирали 25 мл розчину і фільтрували крізь фільтр з діаметром пор не більше 0,45 мкм, відкидаючи перші 5-10 мл фільтрату. Приготування стандартного розчину (розчин порівняння). Близько 0,2000 г (точна наважка) робочого стандартного зразка (РСЗ) ангіоліну вносять у мірну колбу ємкістю на 1000 мл, розчиняють у 50 мл води очищеної, доводять водою очищеною до мітки, ретельно перемішують і фільтрують через фільтр із діаметром пор не більше ніж 0,45 мкм., перші 5 – 10 мл відкидаємо. Далі 10 мл отриманого розчину переносимо у колбу ємкістю на 25 мл і доводимо до мітки. Вимірювання абсорбції розчинів проводили на скануючому спектрофотометрі Optizen POP, товщина кювети 10 мм, та при довжині хвилі λ = 238 нм, використовуючи воду очищену в якості компенсаційного розчину. Вміст діючої речовини в одній таблетці розраховували за формулою: де Ax – абсорбція розчину однієї таблетки; mо – наважка стандартного зразка ангіоліну, г; Р – відсотковий вміст ангіоліну в стандартному зразку; Aо – абсорбція РСЗ; mx – маса діючої речовини в одній таблетці, г. m – середня маса однієї таблетки, г. Отримані результати дослідження довели, що грамовий вміст діючої речовини, що перейшла в розчин з таблеток «Ангіолін» через 45 хв становить від 96,25% до 100,55%, що відповідає вимогам ДФУ. Кількісне визначення. В результаті проведених фармако-технологічних досліджень розроблено таблетки ангіоліну з середньою масою 320,0 мг, із вмістом діючої речовини 200,0 мг. Попередньо була розроблена методика визначення діючої речовини в таблетковій масі спектрофотометричним методом, яка застосовується при постадійному контролю якості таблеток. Для кількісного визначення вмісту ангіоліну в отриманих таблетках апробували методику спектрофотометричного визначення, яку розробили та використали для стандартизації таблеткової маси. Приготування випробуваного розчину. Близько 0,073 г (точна наважка) порошку подрібнених таблеток ангіоліну вносять у мірну колбу ємкістю на 250 мл, розчиняють у 10 мл води очищеної, доводять водою очищеною до мітки, ретельно перемішують і фільтрують через фільтр із діаметром пор не більше ніж 0,45 мкм, перші 5 – 10 мл відкидаємо. Далі 10 мл отриманого розчину переносимо у колбу ємкістю на 25 мл і доводимо до мітки. Вимірюють абсорбції розчину таблеткової маси (S)-2,6-діаміногексанової кислоти 3-метил-1,2,4-триазоліл-5-тіоацетату при довжині хвилі λ = 238 нм. Розчин порівняння. 0,05 г (точна наважка) робочого стандартного зразка (РСЗ) (S)-2,6-діаміногексанової кислоти 3-метил-1,2,4-триазоліл-5-тіоацетат (ДП «Завод хімічних реактивів» Науково-технологічного комплексу «Інститут монокристалів» НАН України, Україна) вносять у мірну колбу ємкістю на 250 мл, розчиняють у 10 мл води очищеної, доводять до мітки тим же розчинником, ретельно перемішують. Далі 10 мл отриманого розчину переносимо у колбу ємкістю на 25 мл і доводимо до мітки. Вимірюють абсорбцію РСЗ при довжині хвилі λ = 238 нм. Як стандартний зразок використали ФСЗ (S)-2,6-діаміногексанової кислоти 3-метил-1,2,4-триазоліл-5-тіоацетат (ДП «Завод хімічних реактивів» Науково-технологічного комплексу «Інститут монокристалів» НАН України, Україна). Вимірювання абсорбція випробуваного розчину і розчину порівняння проводили на скануючому спектрофотометрі Optizen POP, в кюветах з товщиною шару 10 мм при довжині хвилі λ = 238 нм, використовуючи воду очищену в якості компенсаційного розчину. Вміст діючої речовини в одній таблетці розраховували за формулою: де: Ax – абсорбція робочого розчину; m0 – наважка стандартного зразка, г; m – маса однієї таблетки, г; Р – відсотковий вміст речовини в стандартному зразку, %; A0 – абсорбція розчину порівняння; mx – наважка порошку подрібнених таблеток, г. Результати аналізу таблеток ангіоліну методом спектрофотометрії наведено в табл. 5. Розглянувши результати, наведені в таблиці, можна зробити висновок, що розроблена методика визначення кількісного вмісту діючої речовини в таблетках ангіоліну є зручною та простою у виконанні, точною та відтворюваною. За результатами проведених досліджень розроблено проект МКЯ та специфікацію на таблетки «Ангіолін». Далі була проведена валідація розроблених методик таблеток «Ангіолін». Для того, щоб аналітична методика зайняла гідне місце в системі забезпечення якості, відповідала своєму призначенню, тим самим гарантувала достовірні та точні результати аналізу, передбачена процедура валідації аналітичних методик. Згідно з ДФУ запропоновані методики кількісного визначення досліджуваних таблеток мають бути перевірені за валідаційними характеристиками такими як специфічність, лінійність, діапазон застосування, точність, правильність та робасність. Таблиця 5 Результати аналізу зразків таблеток ангіоліну методом спектрофотометрії
Лінійну залежність досліджували у межах діапазону застосування розробленої методики. Вона була підтверджена безпосередньо на таблетках, шляхом розведення стандартних розчинів (використано 9 концентрацій). За отриманими даними будували графіки залежності абсорбція отриманих розчинів від їх концентрації. Одержані результати обробляли методом найменших квадратів та розраховували рівняння лінійної регресії. 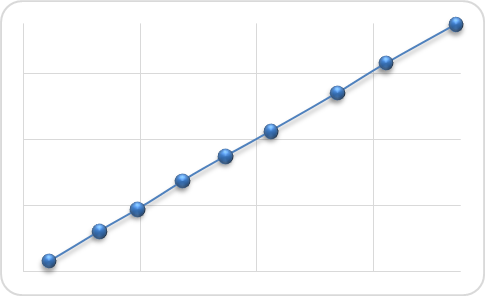 Рис.5. Лінійна залежність абсорбції від концентрації ангіоліна у нормалізованих координатах Згідно з вимогами ДФУ, таку валідаційну характеристику як правильність та точність розроблених методик кількісного визначення діючої речовини у складі лікарських препаратів встановлювали методом модельних сумішей (табл. 6). Прецизійність методики визначається близькістю результатів для серії вимірів, виконаних за даною методикою при різних пробах одного і того самого однорідного зразка, та обумовлюється наявністю випадкових похибок. Згідно ДФУ, прецизійність методики розглядається на трьох рівнях: внутрішньолабораторна прецизійність, збіжність та відтворюваність. В даному дослідженні було проведено визначення прецизійності запропонованої методики на рівні збіжності. Для цього в кожному випадку проводили п'ятнадцять паралельних визначень (п’ять наважок, три повтори), а за результатами розрахували метрологічні характеристики. Встановлено, що у всіх випадках однобічний довірчий інтервал не перевищує максимально допустиму невизначеність аналізу, тому методики є точними на рівні збіжності. Таблиця 6 |
