База з хімії, Крок 1. Банк тестових завдань крок Фармація
 Скачать 7.59 Mb. Скачать 7.59 Mb.
|
|
A *Основні B Подвійні C Змішані D Кислі E Середні 16.Який із перерахованих гідроксидів має найбільш виражені основні властивості? A *CsOH B LiOH C KOH D Ca(OH)2 E Mg(OH)2 17.Вкажіть, яку мінеральну кислоту не можна зберігати в скляному посуді: A *HF B HCl C HBr D HI E H2SO4 18.При взаємодії надлишку розчину лугу з амфотерними металами утворюються: A *гідроксокомплекси B оксиди C гідроксиди D середні солі E основні солі 19.Для кількісного визначення деяких лікарських засобів використовують розчини сульфатної і перхлоратної кислот. Які з наведених оксидів є ангідридами цих кислот? A *SO3, Сl2O7 B SO2, Cl2O C SO3, ClO2 D SO2, Cl2O7 E SO3, Cl2O6 20.Натрій гідрокарбонат відноситься до наступного типу солей: A *кисла сіль B змішана сіль C середня сіль D основна сіль E оксосіль 21.Вкажіть до якого типу солей відноситься ZnSO4, який використовують як краплі для очей: A *Середні B Кислі C Основні D Комплексні E Змішані 22.Назвіть тип солей, до яких відноситься така сіль - (NH4)2Fe(SO4)2: A *Подвійні B Змішані C Комплексні D Середні E Кислі 23.Серед наведених сполук вкажіть сіль ортокислоти: A *NaH2PO4 B Na2[PO3H] C KMnO4 D Na2SO3S E NaAsO2 24.Як змінюється сила кислот у ряді Н3ВО3-Н2СО3-НNO3? A *Найбільш сильна кислота – нітратна (азотна), найбільш слабка – ортоборна. B Зменшується C Найбільш сильна кислота – нітратна, найбільш слабка – карбонатна D Практично постійна E жодної правильної відповіді 25.Вкажіть амфотерний оксид, який не розчиняється в розчинах кислот та лугів A *Cr2O3 B ZnO C PbO D SnO E GeO 26.Вкажіть галогеноангідрид: A *POCl3 B SnCl2 C PbI2 D AlOHCl3 E BiOCl 27.Який оксид з наведених нижче є амфотерним? A *ZnO B As2O3 C CO2 D SiO2 E N2O5 28.Деякі метали можуть реагувати з водою. Який гідроксид утворюється при взаємодії метала з водою? A *NaOH; B Mn(OH)2; C Fe(OH)3; D Zn(OH)2; E Cr(OH)3; 29.Неметали утворюють водневі сполуки, багато з яких є леткими. Вкажіть, яка з приведених сполук найменш міцна? A *AsH3 B NH3 C H2S D PH3 E H2Te 30.Вкажіть, який із оксидів виявляє амфотерні властивості: A *Al2O3 B BaO C FeO D MnO E Na2O 31.Вкажіть, до якого класу неорганічних сполук відноситься KMnO4 A *сіль B кислота C основа D оксид E гідроксид 32.Який з наведених оксидів не реагує з водою? A *СO B CаO C СО2 D Cl2O7 E CrO3 33.Який з приведених оксидів можна використати як водовіднімаючий засіб? A *BaO B CuO C Fe2O3 D CO2 E Al2O3 34.Яку з наведених сполук можна використати як водовіднімаючий засіб? A *H2SO4 B CO2 C Al2O3 D CuO E Fe2O3 35.Для якої з наведених кислот основність не співпадає з кількістю атомів водню в кислоті? A *Пірофосфітна B Фосфітна C Ортофосфатна D Сульфідна E Сульфітна 36.Натрій гідрогенарсенат Na2HAsO4•7Н2О використовують у медичній практиці як загально укріплюючий та тонізуючий засіб. До якого типу солей він належить? A *Кислі B Середні C Основні D Подвійні E Змішані 3. Хімічна кінетика і термодинаміка 1.Який закон лежить в основі визначення швидкості хімічної реакції? A *діючих мас B Вант-Гоффа C Генрі D Рауля E періодичний закон Менделєєва 2.Закон діючих мас описує залежність швидкості хімічних реакцій від: A *Концентрацій реагуючих речовин B Площі поверхні стикання реагуючих речовин C Природи реагуючих речовин D Температури системи E Наявності каталізаторів 3.Реакція між натрієм и водою є: A *екзотермічною, заміщення B ендотермічною, сполучення C ендотермічною, обміну D ендотермічною, заміщення E ендотермічною, оборотньою 4.Принцип Ле-Шательє дає можливість контролю протікання хімічної реакції як в лабораторії, так і в промисловості. Вкажіть, який з наведених процесів повинен проводитися при підвищеному тиску: A *3H2(г)+N2(г)=2NH3(г) B Fe(т)+H2O(пара)=FeO(т)+H2(г) C N2(г)+O2(г)=2NO(г) D C(т)+О2(г)=CO2(г) E H2(г)+Cl2(г)=2HCl(г) 5.При розчиненні солі в воді температура розчину зменшилась. Значить це процес: A *ендотермічний B екзотермічний C ізобаричний D адіабатичний E ізохоричний 6.В яких одиницях вимірюється швидкість хімічної реакції в гомогенних системах? A *Моль•л-1•с-1 B Моль•мл-1•с-1 C Моль•м3•с-1 D Моль•л-1•хв-1 E Моль•м2•хв-1 7.До зростання швидкості реакції внаслідок збільшення енергії молекул приводить: A *Нагрівання B Освітлення C Опромінення D Охолодження E Всі названі способи 8.На скільки градусів потрібно підвищити температуру, щоб швидкість зросла у 64 рази, якщо γ=2,0? A *На 60°С B На 40°С C На 50°С D На 70°С E На 80°С 9.У скільки разів слід підвищити тиск, щоб швидкість утворення NO2 в реакції 2NO + O2 = 2NO2 зросла у 8 раз? A *2 B 5 C 20 D 50 E 100 10.Як зміниться швидкість реакції 2CО+О2= СО2 між карбону (II) оксидом і киснем, якщо концентрацію вихідних речовин збільшити в 5 разів? A *Зросте в 125 раз B Зросте в 5 раз C Зросте в 25 раз D Зросте в 175 раз E Зросте в 625 раз 11.Який із наведених записів, згідно закону діючих мас, виражає швидкість процесу 2SO2(г) + O2(г) = 2SO3(г): A *k[SO2]2•[O2]. B k[2SO2]•[O2]. C k[SO2]•[O2]. D k[SO2]2 + [O2]. E [SO2]2 + [O2]. 12.Одним із законів хімічної кінетики є закон, який формулюється так: "швидкість хімічної реакції пропорційна добутку молярних концентрацій реагуючих речовин". Це закон: A *діючих мас B сталості складу C еквівалентів D розведення Оствальда E збереження маси речовин 13.Під нормальними умовами (н.у.) в хімії розуміють слідуючі числові значення тиску та температури: A *р=101,3 кПа; Т=273К B р=101,3 атм; Т=298К C р=760 мм.рт.ст; Т=1000ºС D р=1,013 кПа; Т=0ºС E р=760 мм.рт.ст; Т=250ºС 14.Під стандартними в хімії розуміють слідуючі числові значення тиску та температури: A *р=101,3 кПа; Т=298К B р=101,3 атм; Т=273К C р=760 мм.рт.ст; Т=1000ºС D р=1,013 кПа; Т=0ºС E р=760 мм.рт.ст; Т=250ºС 15.Експериментально теплоти згоряння (а також ентальпії утворення) визначають приладом: A *Калориметром B Спектрофотометром C Апаратом Кіппа D Колориметром E Кондуктометром 16.Чому дорівнює температурний коефіцієнт реакції, якщо при підвищенні температури на 50ºС швидкість хімічної реакції зростає у 32 рази? A *2 B 4 C 5 D 6 E 3 17.Каталізатори, які сповільнюють швидкість хімічної реакції при підвищенні температури, називають: A *Інгібітори B Інсульти C Інкубатори D Інтерферометри E Інградієнти 18.Речовини білкової природи, які виробляються клітинами живих організмів і значно збільшують швидкість біохімічних реакцій, це - … A *Ферменти (ензими) B Феромагнетики C Ферити D Фулерени E Ферати 19.Яке співвідношення представляє собою константу рівноваги для хімічної рівноваги, що описується рівнянням реакції: 2NO(г) + О2(г) = 2NO2(г)? A* 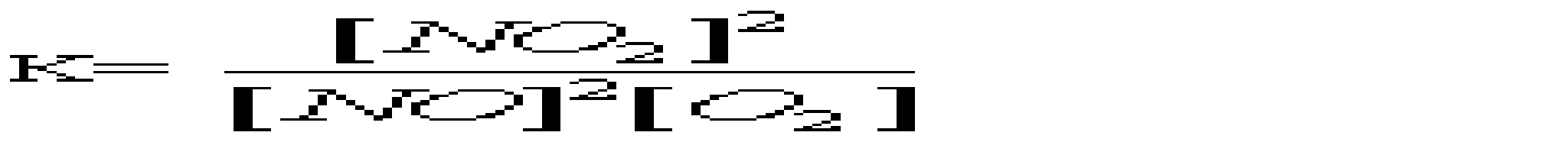 B 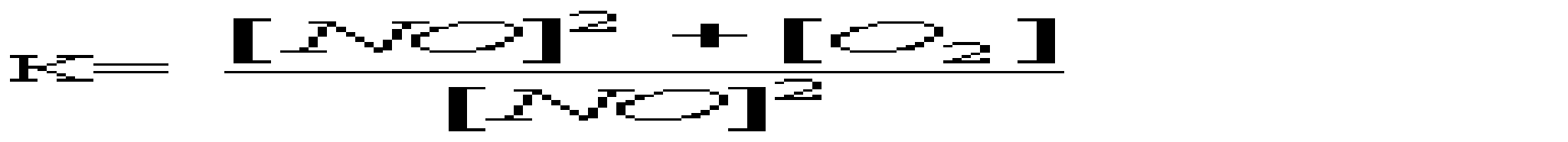 C 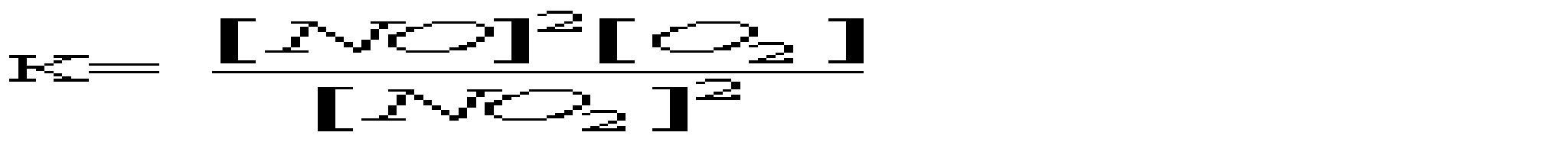 D 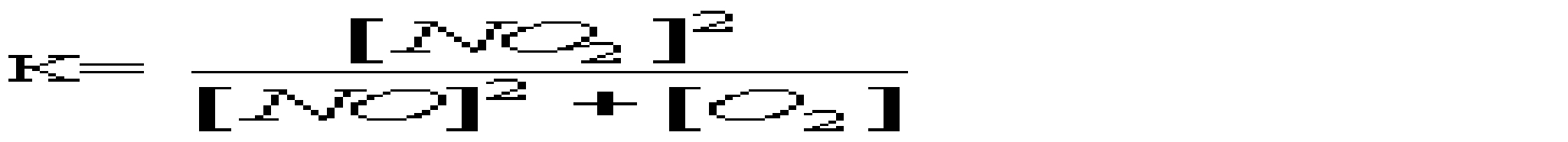 E 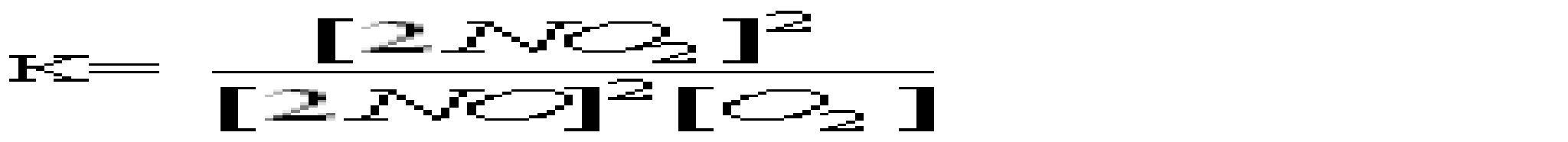 20.Зміщенню рівноваги в системі 2H2S(г) + 3O2(г) = 2SO2(г) + 2H2O(г); ∆Н<0 в сторону утворення продуктів реакції сприяє все, окрім : A *Підвищення температури B Підвищення концентрації H2S C Пониження концентрації SO2 D Підвищення тиску E Пониження температури 21.Швидкість реакції Fe2O3(т) + 3H2(г) = 2Fe(т) + 3H2O(пара) при V=const і збільшенні кількості H2 в 2 рази зросте у: A *8 разів B 2 рази C 4 рази D 16 разів E 6 разів 22.Швидкість яких реакцій підвищується із зростанням температури? A *ендотермічних B екзотермічних C будь-яких D окисно-відновних E каталітичних 23.Гомогенними називають реакції: A *які відбуваються в однорідному середовищі B які відбуваються в неоднорідному середовищі C які відбуваються з виділенням тепла D які відбуваються з поглинанням тепла E жодної правильної відповіді 24.В якому напрямі зміститься рівновага реакції 2NOCl=2NO+Cl2 при підвищенні тиску? A *вліво B не зміниться C вправо D зміниться E жодної правильної відповіді 25.Як зміниться швидкість прямої хімічної реакції N2 +3H2 = 2NH3, якщо об’єм газової суміші зменшити в 3 рази? A *збільшиться у 81 раз B збільшиться у 27 раз C збільшиться у 9 раз D збільшиться у 3 рази E зменшиться у 27 раз 26.Чому дорівнює температурний коефіцієнт реакції, якщо при підвищенні температури на 60ºС швидкість хімічної реакції зростає у 1500 раз? A *3,4 B 2,7 C 3,8 D 1,4 E 2,4 27.У скільки разів швидкість прямої реакції 3О2 = 2О3 більша від швидкості зворотної при збільшенні тиску в 3 рази? A *у 3 рази B у 27 раз C у 9 раз D у 81 раз E у 6 раз 28.В якому напрямі зміститься рівновага реакції N2+O2=2NO при підвищенні тиску? A *не зміниться B вліво C вправо D зміниться E жодної правильної відповіді 29.В яких межах змінюється температурний коефіцієнт швидкості для більшості реакцій? A *2-4 B 2-3 C 3-4 D 4-5 E 5-6 30.Яке рівняння є математичним виразом закону діючих мас для реакції 2NO(г) + Cl2(г) = 2NOCl(г): A *k[NO]2•[Cl2] B k[NO]•[Cl2] C k[NOCl2] D k[NO]2•[Cl]2 E k2[NO]•[Cl2]. 31.Яке рівняння є математичним виразом закону діючих мас для реакції 2Al(т) + 3Cl2(г) = 2AlCl3(т): A *k[Cl2]3 B k[Al]2•[Cl2]3 C k[Al]•[Cl2] D k[Al]2•[Cl]3 E жодної правильної відповіді 32.Як зміниться швидкість хімічної реакції між оксидом карбону (II) та киснем, якщо концентрацію вихідних речовин збільшити в 5 раз? A *збільшиться у 125 раз B збільшиться у 25 раз C збільшиться у 5 раз D збільшиться у 35 рази E не зміниться 33.У скільки разів слід збільшити концентрацію водню в системі N2 + 3H2 = 2NH3, щоб швидкість прямої реакції збільшити в 125 раз? A *у 5 раз B у 15 раз C у 25 раз D у 3 рази E у 27 раз 34.Чому дорівнює константа рівноваги реакції І2 + H2 = 2НІ, якщо константа швидкості прямої реакції дорівнює 0,16, а зворотної – 0,05? A *3,2 B 2,3 C 0,3 D 1,8 E 2,7 35.Які з перерахованих взаємодій приведуть до зміни константи швидкості реакції? A *зміна температури B зміна тиску C зміна реакційного об’єму D введення в систему каталізаторів E освітлення 36.У скільки разів слід підвищити тиск, щоб швидкість утворення NO2 в реакції 2NO + O2 = 2NO2 зросла у 1000 раз? A *10 B 5 C 20 D 50 E 100 37.Обчисліть константу рівноваги реакції 2NO+O2=2NO2, якщо рівноважні концентрації дорівнюють: [NO2]=0,8 моль/дм3, [O2]=0,2 моль/дм3, [NO]=0,4 моль/дм3. A *20 B 16 C 18 D 22 E 24 38.Що вивчає хімічна термодинаміка? A *перетворення різних форм енергії при фізичних та хімічних процесах B перетворення різних форм енергії хімічних реакціях C теплові ефекти реакцій D перетворення лише певного виду енергії E жодної правильної відповіді 39.Для якої речовини ентальпія утворення не дорівнює нулю? A *С(алмаз) B С(графіт) |
