База з хімії, Крок 1. Банк тестових завдань крок Фармація
 Скачать 7.59 Mb. Скачать 7.59 Mb.
|
|
A *Na+ і OH- B Zn2+ і OH- C Al3+ і OH- D Cu2+ і OH- E H+ і CO32- 11.Кількість розчиненої речовини, що міститься в 1 дм3 розчину, визначає: A *Молярну концентрацію B Масову частку C Молярну концентрацію еквіваленту D Мольну частку E Моляльну концентрацію 12.Водневий показник 0,005 М розчину сульфатної кислоти дорівнює: A *2 B 0 C 1 D 3 E 4 13.Для приготування 200 г 10% розчину калій йодиду необхідно взяти: A *20 г KI B 2 г KI C 0,2 г KI D 10 г KI E 4 г KI 14.У 0,1 М розчині якої з наведених кислот найбільша концентрація йонів Гідрогену? A *H2SO4 B HCl C H2CO3 D CH3COOH E H2SO3 15.Які з наведених пар йонів можуть одночасно знаходитися в розчині: A *Fe3+, Cl- B Ba2+, SO42- C Fe2+, OH- D Fe3+, OH- EАg+, Cl- 16.В якому з приведених розчинів водневий показник дорівнює нулю? A *1M HCl B 0,1M HCl C 0,1M KOH D 1M H3PO4 E 1M Ba(OH)2 17.У розчині [ОН-] = 1•10-6 моль/л. Вкажіть рН розчину. A *8. B 6. C 1 D 7 E 4 18.У фармацевтичному аналізі, в якості титранту використовують 0,1 М розчин хлоридної кислоти. Який об'єм цієї кислоти можна приготувати виходячи з 100 cм3 0,5 М розчину HCl? A *500 cм3 B 50 cм3 C 200 cм3 D 1000 cм3 E 5000 cм3 19.Водневий показник 0,01 М розчину хлоридної кислоти дорівнює: A *2 B 0 C 1 D 3 E 4 20.Водневий показник 0,001 М розчину хлоридної кислоти дорівнює: A *3 B 0 C 10 D 7 E 5 21.Який з наведених розчинів має найбільший осмотичний тиск? A *1% розчин NaCl B 1% розчин ZnSO4 C 1% розчин глюкози D 1% розчин сахарози E 1% розчин білка 22.Водневий показник 0,001 М розчину KOH дорівнює: A *11 B 13 C 10 D 12 E 9 23.Водневий показник 0,05 М розчину H2SO4 дорівнює: A *1 B 2 C 5 D 4 E 3 24.Водневий показник 0,005 М розчину Ba(OH)2 дорівнює: A *12 B 13 C 10 D 11 E 9 25.Концентрація йонів Гідрогену у рівнянні для розрахунку рН виражається у: A *Моль/дм3 B Моль/см3 C Моль D Моль/кг E Мольних частках 26.До колігативних властивостей розчинів відносять A *осмос і осмотичний тиск B седиментаційну стійкість C кінетичну стійкість D ефект Тіндаля E синерезис 27.Яка концентрація гідроксид-йонів (в моль/дм3) в розчині, рОН якого рівний 9? A *10-9 B 10-3 C 10-1 D 10-5 E 10-7 28.Яка концентрація йонів водню (в моль/дм3) в розчині, рОН якого рівний 9? A *10-5 B 10-3 C 10-1 D 10-9 E 10-7 29.Розрахуйте масу натрію хлориду для приготування 100 г ізотонічного (0,9%) розчину, який використовують для внутрішньовенного введення. A *0,9 г B 1,8 г C 18 г D 0,36 г E 0,18 г 30.Розчинність малорозчинних речовин (типу AgCl або BaSO4) характеризують за допомогою спеціальної константи, яка називається: A *Добутком розчинності B Константою гідроліза C Ступінню дисоціації D Коефіцієнтом абсорбції E Ступінню гідролізу 31.Розчинність газів у воді при підвищенні температури: A *Зменшується B Не змінюється C Збільшується D Спочатку збільшується, а потім зменшується E Спочатку зменшується, а потім збільшується 32.При зберіганні відкритої колби з розчином солі на дні колби утворились кристали. Яким буде розчин над кристалами? A *Насиченим. B Ненасиченим. C Пересиченим. D Розбавленим. E Концентрованим. 33.В 0,1 М розчині якої речовини концентрація йонів найменша? A *СН3СООН B НCl C СаCl2 D H2SO4 E NaNO3 34.Для приготування 1 дм3 0,1М розчину сульфатної кислоти (М(H2SO4})=98 г/моль) необхідно взяти: A*9,8 г H2SO4 B 980 г H2SO4 C 0,098 г H2SO4 D 49 г H2SO4 E 98 г H2SO4 35.Вкажіть формулу, яку застосовують для обчислення молярної концентрації розчину A * 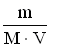 B 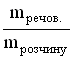 C 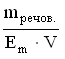 D 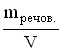 E 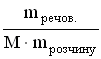 36.Молярна концентрація показує кількість розчиненої речовини A *в 1 дм3 розчину B в 1000 г розчину C в 1 кг розчинника D в 1 дм3 розчинника E в 100 г розчинника 37.Для приготування 1 дм3 1 М розчину натрій хлориду необхідно брати NaCl A *58,5 г B 5,85 г C 0,585 г D 1,170 г E 2,34 г 38.Закон Вант-Гоффа для осмотичного тиску виражається математичним рівнянням: A *Π=iCмRT B Π=m/MR T C Π=iCmRT D Π=iCнRT E Π=CmRT 39.У якому з наведених розчинів водневий показник дорівнює 14? A *1М КОН B 0,1M HCl C 0,1M KOH D 1M H2SO4 E 1M HCl 40.Вкажіть розчин з мінімальним значенням йонної сили, якщо молярні концентрації їх дорівнюють 0,01 моль/дм3: A *NaNO3 B K2SO4 C CoCl2 D K3PO4 E (CH3COO)2Ca 41.Вкажіть розчин з максимальним значенням йонної сили, якщо молярні концентрації їх дорівнюють 0,01 моль/дм3: A *Al2(SO4)3 B K2SO4 C CoCl2 D K3PO4 E (CH3COO)2Ca 42.До складу буферних систем крові не входить такий буферний розчин: A *ацетатний B білковий C гідрокарбонатний D фосфатний E жодної правильної відповіді 43.Розчинність газів у воді при підвищенні тиску, як правило: A *Збільшується B Не змінюється C Зменшується D Спочатку збільшується, а потім зменшується E Спочатку зменшується, а потім збільшується 6. Періодичний закон 1.Одна з класифікацій хімічних елементів ґрунтується на будові їх електронних оболонок. Згідно неї всі елементи можна поділити на s-, p-, d- і f-елементи. Які з наведених елементів належать лише до р-елементів? A *Br, O, P B Cl, Ca, O C N, Al, Cd D K, Ca, Ni E Fe, Cu, F 2.Амфотерні сполуки – це речовини, які реагують з: A *Кислотами та лугами B Тільки з лугами C Тільки з кислотами D Тільки з кислотними оксидами E Тільки з основними оксидами 3.Благородні гази практично не утворюють хімічних сполук, тому що: A *вони мають повністю завершений зовнішній електронний рівень B вони знаходяться у восьмій групі періодичної системи Д.І. Менделеєва C з усіх елементів періоду вони мають найменший радіус D у періодичній системі Д.І. Менделеєва вони розташовані після галогенів E заряд ядра благородних газів дорівнює кількості електронів у атомі 4.Атомний номер хімічного елемента характеризує: A *Кількість протонів у ядрі атома B Кількість нейтронів у ядрі атома C Кількість нуклонів у ядрі атома D Кількість нейтронів і протонів у ядрі атома E Масу ядра атома 5.Посилення металічних властивостей у головних підгрупах ПС зверху вниз зумовлено: A *збільшенням радіуса атома B збільшенням атомного номера C збільшенням атомної маси D збільшенням нуклонного числа E збільшенням заряду ядра 6.У який з наведених молекул ступінь окиснення дорівнює нулю, а валентність дорівнює одиниці? A *H2 B HCl C NH3 D N2 E SO3 7.Максимальний ступінь окиснення елемента, як правило, дорівнює: A *номеру групи в періодичній системі B номеру підгрупи в періодичній системі C номеру періода D номеру ряду E різниці між позитивним ступенем окиснення та числом 8 8.Одна з класифікацій хімічних елементів ґрунтується на будові їх електронних оболонок. У відповідності до неї всі елементи можна поділити на s-, p-, d- і f-елементи. Які з наведених елементів належать лише до р-елементів? A *Cl, S, N B Ag, Mg, O C Al, Pt, N D Na, Ca, Fe E Fe, Cu, Cr 9.Відомо, що періодичний закон дозволяє передбачати властивості хімічних елементів та їх сполук, що і було продемонстровано у свій час Д.І. Менделєєвим. Користуючись цим законом знайдіть у ряді представлених елементів ІІІ періоду найбільш сильну кислоту: A *HСlO4 B H3PO4 C H2SO4 D HСl EH4SiO4 10.Вкажіть фактор, який визначає періодичність зміни властивостей елементів: A *заряд ядра B ступінь окислення C валентність D атомний радіус E електронегативність 11.Одна з класифікацій хімічних елементів грунтується на будові їх електронних оболонок. Згідно неї всі елементи можна поділити на s-, p-, d- і f-елементи. Які з наведених елементів належать до р-елементів? A *S, P, Cl B K, Ca, Sc C Be, Mg, Al D Mn, Br, Mo E P, S, Cr 12.Одна з класифікацій хімічних елементів грунтується на будові їх електронних оболонок. Згідно неї всі елементи можна поділити на s-, p-, d- і f-елементи. Які з наведених елементів належать до s-елементів? A *K, Ca, Sr B S, P, Cl C Be, Mg, Al D Mn, Br, Mo E P, S, Cr 13.Вкажіть максимально можливе число електронів на 4-ому енергетичному рівні. A *32 B 16 C 8 D 25 E 40 14.Який запис електронної конфігурації валентних електронів відповідає елементу 4-ого періоду VI групи головної підгрупи: A *4s24p4 B 4s13d5 C 6s26p2 D 6s25d2 E 3s23p4 15.Чим відрізняються великі періоди елементів від малих? A *Наявністю d і f –елементів. B Наявністю s –елементів. C Наявністю інертних газів. D Наявністю металів. E Наявністю неметалів. 16.Вкажіть який з елементів належить до p-елементів: A *Р B Сu C Fe D Mg E K 17.Вкажіть, у якому рядку розміщені тільки ізотопи: A *16О, 17О, 18О B 11К, 41Са, 41Sc C 16О, 32О, 12О D 40Ar, 40K, 40Ca E 39K, 40Ca, 42Ca 18.Вкажіть елемент, якщо його електронна формула [Ar]4s23d8 A *Ni B Cu C Zn D Pt E Mn 19.Вкажіть елемент, якщо його електронна формула [Ar]4s13d10 A *Cu B Ni C Zn D Pt E Mn 20.Вкажіть число протонів в P-3: A *15 B 16 C 17 D 18 E 31 21.Вкажіть число електронів в P-3: A *18 B 16 C 17 D 15 E 31 22.Вкажіть молекулярну формулу продукту реакції між простими речовинами, утвореними елементами, які мають наступну будову зовнішнього енергетичного рівня : 3s23p1 та 3s23p5 A *AlCl3 B NaI C BeBr2 D LiCl E BaO 23.На основі електронної структури атома 35Cl вкажіть сумарне число нейтронів у цьому атомі. A *18 B 52 C 10 D 17 E 35 24.Серед поданих схем розподілу електронів деяких елементів вкажіть негативно заряджені йони: A *+14 ) ) ) 2 8 8 B +13 ) ) ) 2 8 0 C +13 ) ) ) 2 8 3 D +10 ) ) 2 8 E +15 ) ) ) 2 8 5 25.Хімічний знак елементу, електронна формула якого 1s22s22p63s23p64s23d104p3: A *As B Ga C Ge D Se E Zn 26.Вкажіть орбіталь із найбільшим значенням енергії: A *4f B 5s C 4p D 3d E 4s 27.Вкажіть елемент 4 періоду, якщо на його зовнішньому енергетичному шарі є 2, а на передостанньому 16 електронів A *Ni B Cu C Cu D Zn E Ga 28.Вкажіть елемент, який може проявляти тільки додатню ступінь окислення? A *магній B бісмут C сульфур D нітроген E арсен 7. Гідроліз солей 1.Продуктом гідролізу якої з наведених солей є основна сіль? A *CuSO4 B CaCl2 C K2CO3 D NaCl E KBr 2.Вкажіть сіль, яка не піддається гідролізу: A *K2Cr2O7 B Cr2(CO3)3 C KCrO2 D CrCl3 E Cr2S3 3.Вкажіть, яка з наведених солей не підлягає гідролізу? |
